新生7日龄高胆红素血症大鼠海马区神经元Tau、p-Tau蛋白表达及其细胞凋亡的实验研究
史瑞玲,阴怀清
新生儿黄疸是因胆红素在体内积聚引起的皮肤或其他器官黄染,新生儿血清胆红素升高可出现肉眼可见的黄疸[1]。新生儿黄疸在足月新生儿中的发病率为84%,早产儿发病率更高,是新生儿期再入院的最常见原因,其中2%的患儿可出现重型高胆红素血症。发达国家新生儿急性胆红素脑病或核黄疸发病率为0.4/10万~2.7/10万[2]。研究发现,同一水平胆红素在不同个体中可致不同程度的神经损伤[3-4]。但目前尚缺乏客观生化指标评判高胆红素血症所致脑损伤风险。
Tau蛋白是微管相关蛋白家族(MAPs)的主要成员之一,是脑中含量最高的微管相关蛋白,在脑内主要分布于大脑的额叶、颞叶、海马和内嗅区神经元轴突内[5]。由17q21,31的MAPT基因编码,分子量低,结构相对简单,具有高度亲水性[6]。Tau蛋白一级结构具有氨基末端、羧基末端和重复区域的3个不同结构域,羧基末端与轴突微管结合,氨基末端与神经质膜相结合,参与微管组装和稳定、神经极性建立、细胞内物质运输、有丝分裂、神经递质和信号传递等生理过程[7]。因其重要作用,Tau蛋白成为近年来神经系统领域研究重点。
临床中,急性胆红素脑病和核黄疸为新生儿高胆红素血症最严重的并发症,胆红素常造成基底神经节、海马、下丘脑神经核和小脑神经元坏死[1]。此外,Dal Ben等[8]在胆红素诱导的新生大鼠脑损伤的脑组织OBC切片中发现海马区神经元受损明显。故本实验通过观察分析7日龄大鼠高胆红素血症模型中海马区神经元Tau、p-Tau蛋白表达与其凋亡的关系,探讨高胆红素血症所致脑损伤的可能理论基础,为新生儿胆红素脑病的早期诊断和治疗提供实验依据。
1 材料与方法
1.1 实验动物 144只7日龄清洁级SD大鼠,体重12~18 g,购自山西医科大学动物实验中心,已通过动物伦理委员会审查。饲养环境温度20~25 ℃,湿度60%~70%。幼鼠出生后与母鼠共同饲养至7日龄。
1.2 材料与试剂 胆红素购自美国 Sigma公司,兔抗鼠 Tau多克隆抗体、兔抗鼠 p-Tau单克隆抗体、封闭液、脱氧核糖核酸末端转移酶介导的缺口末端标记法(TUNEL)试剂盒均购自武汉博士德生物技术公司。NaOH粉末、浓盐酸由山西医科大学生理化学实验室提供,其余试剂[多聚甲醛、二甲苯、无水乙醇、90%乙醇、乙二胺四乙酸(EDTA)抗原修复液、磷酸缓冲盐溶液(PBS)、枸橼酸缓冲液、DAB 显色试剂盒等]则由山西医科大学第一医院病理科提供,5%水合氯醛由山西医科大学第一医院儿科提供。
1.3 实验动物分组及模型制作
1.3.1 实验分组 根据随机数字表法,将实验动物分成对照组(C组)、T1组、T2组,根据不同处死时间点(2 h、6 h、12 h、24 h、48 h 和 72 h),将每组划分为6个亚组,每个亚组各8只。
1.3.2 胆红素溶液的配制及模型制作 分别将40 mg和60 mg胆红素溶于1 mL氢氧化钠溶液(浓度0.5 mol/L)中,加入9 mL双蒸水,用氯化氢溶液(0.5 mol/L)将pH调至8.5,制备成4 mg/mL和6 mg/mL浓度,避光保存,现配现用。C组腹腔注射等体积生理盐水,每只0.025 mL/g;T1 组腹腔注射胆红素溶液,每只100 μg/g(胆红素浓度为4 mg/mL);T2组腹腔注射胆红素溶液,每只150 μg/g(胆红素浓度为6 mg/mL),造模后将各组大鼠分别在避光、恒温、恒湿环境下放回母鼠饲养笼,由母鼠喂养至各个时间点,观察记录体重增长情况及异常行为表现(如嗜睡、拒乳、活动力低下、反应迟钝、抽搐、尖叫等)。
1.3.3 大鼠脑组织的提取、标本制备及表达测定 在不同时间点,腹腔注射5%水合氯醛(0.04 mL/10 g)对大鼠进行麻醉,5~7 min后,大鼠进入深昏迷状态,将其固定于手术台上,用眼科剪、镊子暴露大鼠肝脏、心脏,在肝缘剪一小口,用一端连接20 mL注射器的穿刺针小心刺入大鼠心尖部,依次用20 mL生理盐水和20 mL 10%多聚甲醛灌洗,直至肝缘小口处流出液体由红色变清亮,停止灌洗,冰盒上断头取脑,从视交叉及其后5 mm处将一侧海马区脑组织切下,组织块的大小约0.5 cm×0.5 cm×0.5 cm,置于甲醛溶液中固定,送至病理科进行石蜡包埋,同一脑组织连续进行4次冠状位切片,厚度约为4 μm,烘片2 h,依次用于:①苏木素-伊红(HE)染色观察光镜下海马区组织结构及神经元细胞改变;②免疫组织化学法观察Tau 及p-Tau蛋白的表达;③TUNEL法检测神经细胞凋亡。滴定试剂前进行预实验,选择合适的滴度;操作过程严格按照试剂说明书进行。
1.4 显微图像分析 切片由美国Aperio公司的Scanscope数字病理扫描系统进行扫描,从每张切片海马区随机选取5个高倍镜视野(×400)用于图像分析,在免疫组化切片中进一步利用扫描软件分析其灰度值,阳性表达越高,平均灰度值越低;在TUNEL切片中计数每个视野中神经元细胞凋亡数和视野中神经元细胞总数,计算其凋亡率(即凋亡细胞数占细胞总数的百分比)。

2 结 果
2.1 行为学改变 造模后,C组大鼠各时间点反应良好,未出现异常神经行为表现;T1组、T2组大鼠造模后6~24 h出现嗜睡、拒乳、活动力低下、反应迟钝;24~72 h部分大鼠出现间歇性尖叫、抽搐等,T2组较T1组明显。造模开始至处死前无大鼠死亡。 多因素方差分析显示,在大鼠体重总变异中,时间效应为86.20%(F=1 365.0,P<0.05);胆红素剂量效应为8.154%(F=322.8,P<0.05);交互效应为4.054%(F=32.1,P<0.05)。详见表1。

表1 各组不同时间点体重比较(±s) 单位:g
与C组同时间点比较,①P<0.05;与T1组同时间点比较,②P<0.05。
2.2 HE染色结果 C组海马区神经元细胞排列规整,高倍镜下细胞核大而圆、透明。T1组、T2组造模后2 h海马区神经元细胞排列较整齐,细胞未肿胀、无皱缩,细胞核未见异常;6 h神经元细胞排列基本整齐,细胞略皱缩,核稍有偏位;12 h 神经元细胞排列出现紊乱,细胞体积皱缩,数量略有减少,核深染、偏位,少数神经元出现肿胀、淡染,出现凋亡小体;24 h、48 h、72 h神经元细胞排列进一步紊乱,数目进行性减少,核固缩、裂解加重,空泡增多,凋亡小体增多。T2组各时间点脑组织病变程度均较T1组明显。详见图1。
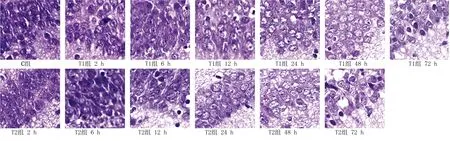
图1 各组不同时间点新生大鼠脑组织海马区HE染色结果(×400)
2.3 Tau蛋白的表达及定量检测 Tau蛋白因其分布部位,阳性表达时神经元细胞的胞质、轴丘及轴突处出现棕黄色颗粒沉积。多因素方差分析显示,在Tau蛋白表达总变异中,时间效应为36.79%(F=198.7,P<0.05);胆红素剂量效应为41.81%(F=564.5,P<0.05);交互效应为16.73%(F=45.2,P<0.05)。详见图2、表2。
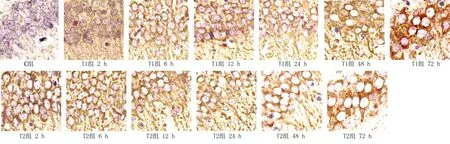
图2 各组不同时间点新生大鼠脑组织海马区Tau蛋白表达(DAB,×400)

组别只数2 h6 h12 h24 h48 h72 hC组8203.07±2.59202.75±3.17201.63±2.21201.50±1.96200.95±2.57200.54±2.36T1组8201.02±2.91197.67±1.59①188.87±3.23①174.77±2.56①183.07±2.73①188.22±3.14①T2组8200.50±2.44 194.21±2.82①② 182.57±1.33①② 163.74±3.47①② 177.59±3.38①②185.06±2.62①
与C组同时间点比较,①P<0.05;与T1组同时间点比较,②P<0.05。
2.4 p-Tau蛋白的表达及定量检测 p-Tau为Tau蛋白磷酸化状态,阳性表达时神经元胞质、轴丘、轴突处染成棕黄色,神经纤维增粗,部分神经纤维发生缠结。多因素方差分析显示,在p-Tau蛋白表达总变异中,时间效应为33.99%(F=183.2,P<0.05);胆红素剂量效应为45.23%(F=609.5,P<0.05);交互效应为16.11%(F=43.4,P<0.05)。详见图3、表3。
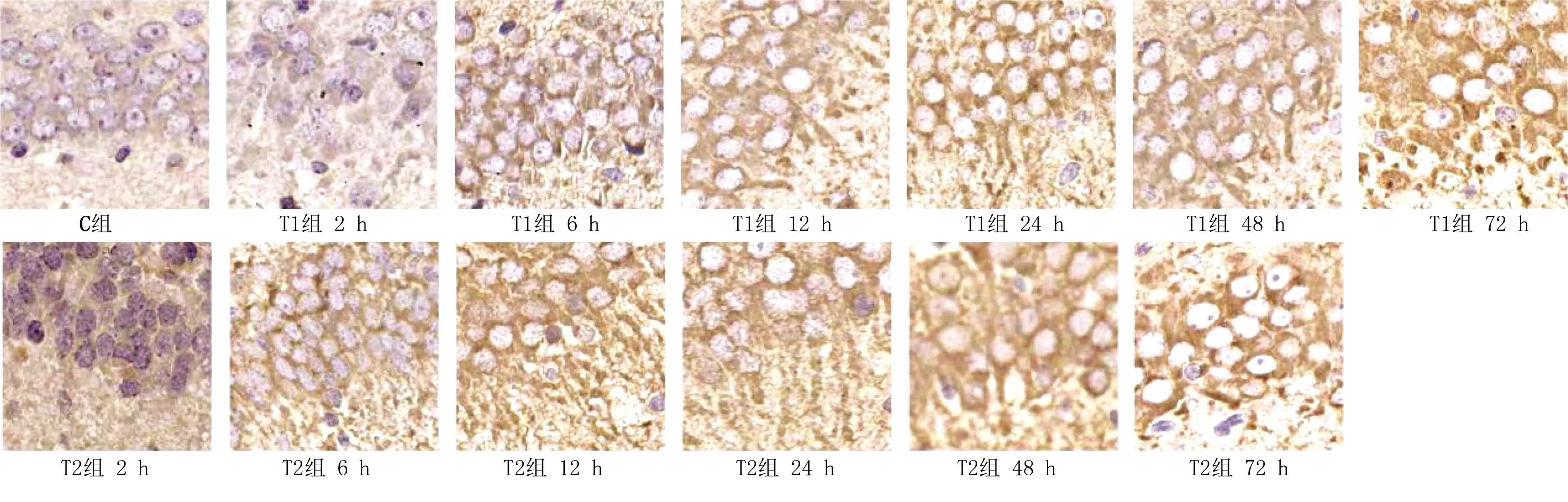
图3 各组不同时间点新生大鼠脑组织海马区p-Tau蛋白表达(DAB,×400)
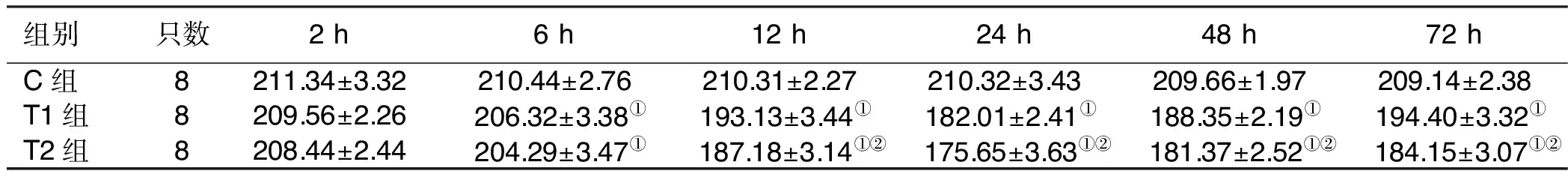
组别只数2 h6 h12 h24 h48 h72 hC组8211.34±3.32210.44±2.76210.31±2.27210.32±3.43209.66±1.97209.14±2.38T1组8209.56±2.26206.32±3.38①193.13±3.44①182.01±2.41①188.35±2.19①194.40±3.32①T2组8208.44±2.44204.29±3.47① 187.18±3.14①② 175.65±3.63①② 181.37±2.52①② 184.15±3.07①②
与C组同时间点比较,①P<0.05;与T1组同时间点比较,②P<0.05。
2.5 神经细胞凋亡情况 TUNEL试剂盒中,酶与发生凋亡的神经元细胞核中断裂的DNA特异性结合,显色后凋亡细胞呈棕褐色圆形颗粒。多因素方差分析显示,在神经元细胞凋亡率总变异中,时间效应为45.97%(F=616.8,P<0.05);胆红素剂量效应为32.48%(F=1 090.0,P<0.05);交互效应为19.68%(F=132.0,P<0.05)。详见图4、表4。
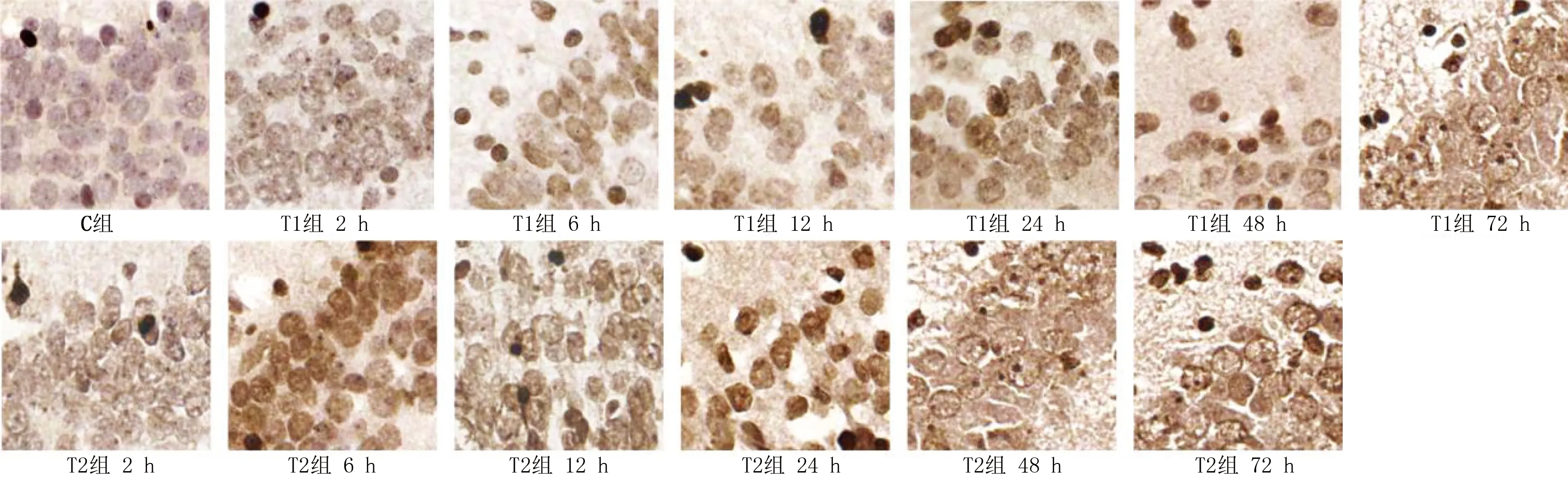
图4 各组不同时间点新生大鼠脑组织海马区神经细胞凋亡情况(DAB,×400)

单位:%
与C组同时间点比较,①P<0.05;与T1组同时间点比较,②P<0.05。
2.6 Tau、p-Tau蛋白表达与神经元细胞凋亡趋势 根据公式OD=LogA/B(A=240,B为软件扫描所得灰度值),得出OD值(又称吸光度,与蛋白表达呈正相关)。从图5、图6发现C组各时间点Tau与p-Tau蛋白表达及神经元细胞凋亡三者表达无明显变化。T1组、T2组6 h、12 h、24 h时Tau与p-Tau蛋白、Tau与神经元凋亡、p-Tau蛋白与神经元凋亡存在线性正相关关系(r=0.967 7,P<0.05;r=0.592 8,P<0.05;r=0.524 2,P<0.05)。详见图5、图6。
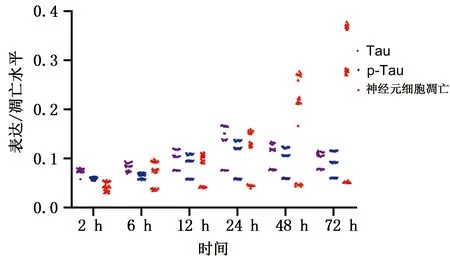
图5 各组Tau、p-Tau蛋白表达与神经元细胞凋亡散点图
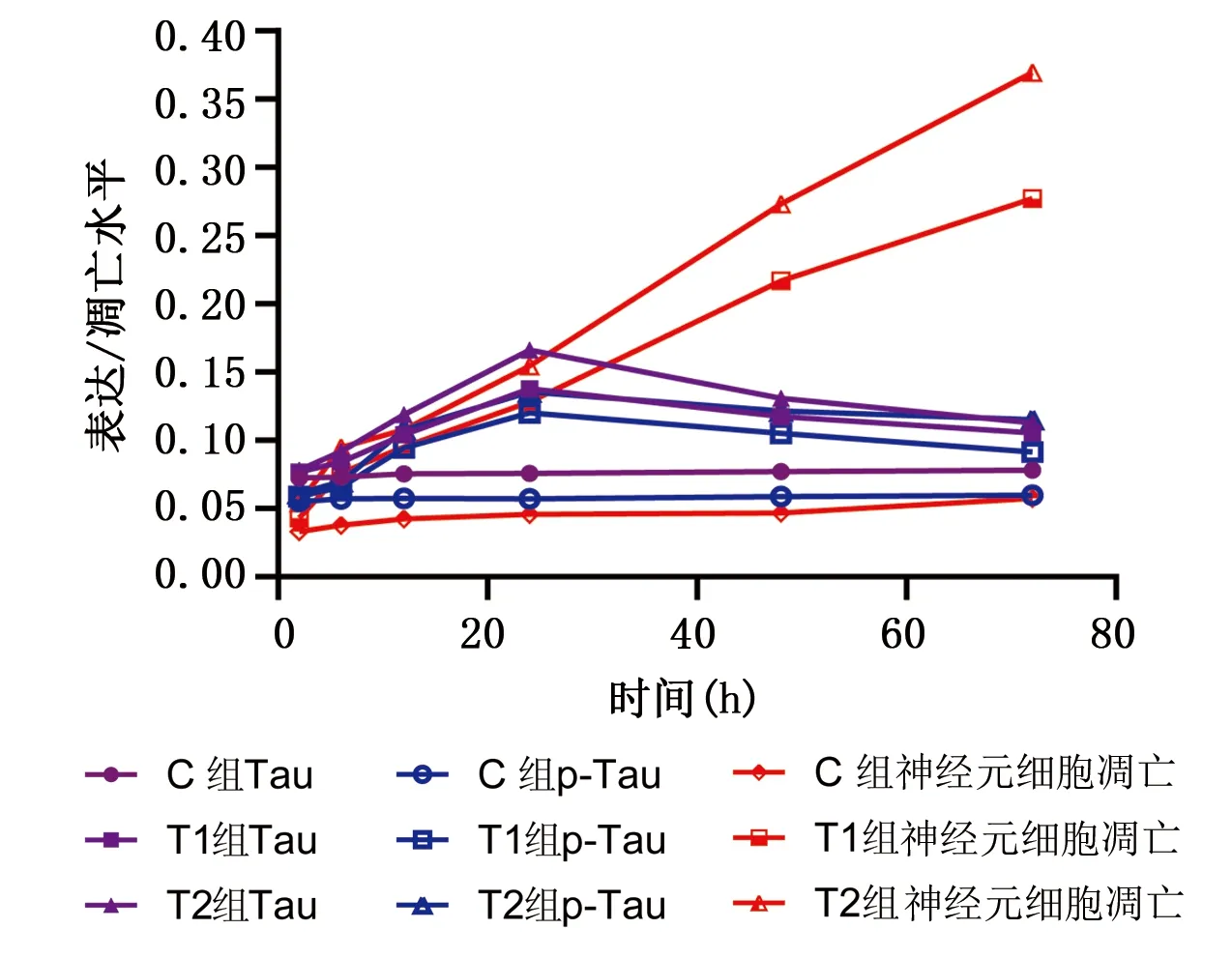
图6 各组Tau、p-Tau蛋白表达与神经元细胞凋亡折线图
3 讨 论
胆红素是哺乳动物体内最丰富的内源性抗氧化剂之一,具有显著的抗氧化作用。Doré等[9]在大鼠原代海马区神经元培养中发现低浓度胆红素可起到抗氧化应激神经保护作用。据此推测,新生儿生理性黄疸是机体自身产生的过渡性抗氧化应激的保护机制。但过高浓度的胆红素(血清中游离的未结合胆红素为主)可透过血脑屏障,在脑组织中特定区域沉积,通过激活氧化应激、内质网应激和炎症反应,引起线粒体膜和内质网膜的改变,进一步导致线粒体功能障碍、三磷酸腺苷(ATP)生成不足、N-甲基-D-天冬氨酸受体(NMDA)过度活化导致细胞内Ca2+超载、兴奋性氨基酸释放增多、DNA丢失和异常蛋白质合成[10-12],多种信号通路被激活[如p38MAPK信号通路、Toll样受体2(TLR2)信号通路]启动Caspase凋亡途径,神经元轴突数目减少,髓鞘形成减少[13],神经元细胞发生凋亡,星形胶质细胞与小胶质细胞反应性增生[10,13-15],出现异常神经学表现。
Tau蛋白作为一种脑中含量最高的低分子量微管相关蛋白,是轴突生长发育和神经元极性形成必不可少的因素,其生理功能取决于具有活性的蛋白磷酸激酶(糖原合酶激酶-3、细胞周期蛋白依赖性激酶5、PKA等)和磷酸酶(PP2B、PP5、PP1、PP2A等)共同作用所致蛋白磷酸化水平[16]。p-Tau与微管蛋白的结合力仅是正常Tau的1/10,难溶于水,易聚集缠绕形成神经纤维结,损害神经元的细胞骨架,导致神经元物质传输受损,加速细胞凋亡[17-18]。此外,从微管中分离出的Tau蛋白,容易聚集,不易被蛋白酶体系统或自噬系统降解,使神经元功能发生缺陷。同时与突触前蛋白synaptogyrin-3作用,导致突触释放功能受损[19]。与突触后致密蛋白PSD-95和酪氨酸激酶Fyn相互作用,稳定突触后膜NMDA受体,持续激活NMDA受体导致细胞内Ca2+超载,致钙蛋白酶激活和线粒体功能障碍,线粒体释放凋亡酶激活因子激活Caspase凋亡通路[20-21]。Bulat等[22-23]在体内外研究中发现Caspase 凋亡途径启动后,Tau蛋白作为Caspase-3的底物被裂解,裂解后的Tau片段又可促进Caspase-3的表达。Tzivion等[24]发现Tau和Bcl-2都是蛋白磷酸酶PP2A的底物,Tau 可以竞争性地抑制 Bcl-2的去磷酸化,致细胞中Bcl-2的磷酸化上调,与促凋亡蛋白Bax 结合能力下降,释放Bax的促凋亡活性,诱导线粒体释放细胞色素C,激活线粒体凋亡通路。由此可见,Tau、p-Tau与神经元凋亡密切相关。
本实验结果显示,在Tau、p-Tau蛋白表达及神经元细胞凋亡率总变异中,时间效应依次为36.79%,33.99%,45.97%;胆红素剂量效应分别为41.81%,45.23%,32.48%;且时间与胆红素剂量对上述观察指标存在交互作用,交互效应依次为16.73%,16.11%和19.68%。据此分析可得,胆红素作用时间以及剂量对Tau、p-Tau、神经元凋亡均有明显影响。图5、图6提示,T1组、T2组6 h、12 h、24 h时Tau、p-Tau与神经元凋亡间存在线性正相关,分析可得Tau、p-Tau参与早期高胆红素血症所致的海马区神经元细胞凋亡。T1组、T2组48 h、72 h时Tau、p-Tau蛋白表达下降,神经元细胞凋亡率持续升高,且T2组较T1组更明显,分析可能与多种凋亡通路激活,神经元发生凋亡、坏死,蛋白合成受限,裂解增多,星形胶质和小胶质细胞增生等有关,具体机制尚需进一步研究。
综上所述,过表达的Tau、p-Tau参与了早期新生儿高胆红素血症所致脑损伤的发生发展。Tau、p-Tau蛋白可作为早期诊断和治疗新生儿胆红素脑病的生化参考指标之一,在未来临床实践及药物研发中可将抑制Tau、p-Tau过表达作为防治胆红素脑病策略之一。

