多导睡眠监测在肥胖低通气综合征早期识别中的应用
张雨翔 杨珵璨 王文越 沈佳慧 史美龙 王 兵
超重和肥胖已成为全球公共卫生问题。2017年一项流行病学调查研究结果显示,中国肥胖儿童和肥胖成人的数量分居世界第1、2位[1]。有研究[2-3]结果表明,肥胖与多种睡眠呼吸疾病的发生密切相关,其中包括阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)和肥胖低通气综合征(obesity hypoventilation syndrome,OHS)。多导睡眠监测(polysomnography,PSG)是诊断OSA的“金标准”,呼吸紊乱指数(apnea hypopnea index,AHI)可评价OSA的严重程度[4]。约10%~20%的OSA患者同时合并OHS[5],但其发病机制目前仍不明确,可能由多种因素共同引起,如呼吸力学的改变、肥胖引起的肌肉功能不全、呼吸中枢驱动力异常、激素水平改变等[6]。OHS患者常合并OSA[7],其白天高碳酸血症的严重程度与OSA的严重程度有关[5,8]。与单纯OSA患者相比,OSA合并OHS患者的呼吸和心血管事件的发生率更高,预后更差;未经治疗的患者18个月的病死率高达23%[7]。高碳酸血症的评估依赖于动脉血气分析(arterial blood gas analysis,ABGA),但因存在有创性、对操作技术要求高、患者依从性差的缺陷,使其在临床应用中受到限制。PSG作为评价睡眠呼吸状况的有效手段,可用于OSA的诊断,但是否有助于OHS的早期识别目前尚无定论。本研究回顾性分析2017年1月—2018年12月在上海交通大学医学院附属第九人民医院行减重代谢手术(metabolic and bariatric surgery,MBS)的171例肥胖患者的临床资料,旨在探讨PSG在肥胖合并OSA患者中早期识别OHS的应用价值。
1 对象与方法
1.1 研究对象 本研究经上海交通大学医学院附属第九人民医院伦理委员会审核批准(SH9H-2018-T20-1),所有患者或其家属均签署知情同意书。选择2017年1月—2018年12月在上海交通大学医学院附属第九人民医院行MBS的病态肥胖患者171例,其中男83例、女88例;年龄18~67岁,平均年龄为(32±10)岁;BMI 26.1~78.7 kg/m2,平均BMI为(40.2±7.4) kg/m2。所有患者均于术前行整夜PSG和白天清醒状态下ABGA后明确诊断为OSA,根据有无合并OHS将患者分为OSA组(129例)和OSA+OHS组(42例)。纳入标准:BMI>30 kg/m2;PSG示AHI≥5次/h;首次诊断为OSA和OHS,尚未经任何治疗;临床资料完整。排除标准:中枢性或混合型睡眠呼吸暂停;存在引起高碳酸血症的其他原因,如肺实质疾病、气道和肺血管疾病、神经系统疾病、肌肉骨骼疾病或其他原发性疾病、先天性中枢性肺换气不足综合征(CCHS)、药物或中毒等;临床资料缺失。
1.2 ABGA 所有患者入院后常规行ABGA,按照操作实践标准[9]的要求采集患者的动脉血。嘱患者平躺或静坐5 min,以桡骨茎突为基点,向尺侧移动1 cm,再向近端移动0.5 cm,以动脉搏动最明显处作为穿刺点,穿刺针与皮肤呈30°~45°角缓慢刺入,见回血后停止进针,采集桡动脉血送检,并于30 min内完成检测。paCO2>45 mmHg(1 mmHg=0.133 kPa)表示有CO2潴留。
1.3 PSG 采用诊断性试验研究方法。所有患者均于睡眠监测室接受整夜PSG。嘱患者当日白天适当运动,不午睡;如有需要可照常服用常规用药;勿进食影响睡眠的刺激性饮料,如咖啡、浓茶,晚饭后少进水;提前进入监测室,适应环境。检查过程中,监测并记录脑电图、心电图、双侧眼电图、颏下肌电图、口鼻气流、胸腹部呼吸运动、脉搏血氧饱和度和打鼾情况。PSG结果的评估和审核均按照美国睡眠医学会(American association of Sleep Medicine, AASM)指南的标准[4],由口腔科具有丰富经验的专业技术人员完成。
1.4 观察指标 测量患者术前BMI、腰围、颈围;记录患者有无睡眠呼吸暂停、打鼾和嗜睡史,以及血脂异常、高血压、糖尿病患者所占比例。记录PSG指标:AHI、氧减指数(oxygen desaturation index, ODI) 、最长呼吸暂停时间(longest apnea time, LAT)、平均血氧饱和度(mean oxygen saturation, MSO2)、最低血氧饱和度(nadir oxygen saturation, NSO2)、 血氧饱和度<90%事件占总睡眠时间百分比(oxygen saturation less than 90% of total sleep time in total sleep time, SIT90) 。检测并记录FBG、HbA1c、TG、HDL-C水平;FBG>7.0 mmol/L、HbA1c≥6.5%或有降糖药物治疗史,认定为糖尿病;TG≥1.69 mmol/L、女性HDL-C≤1.29 mmol/L或男性HDL-C≤1.03 mmol/L,认定为血脂异常[10]。
1.5 评价标准 AHI定义为睡眠期间发生呼吸暂停和低通气的事件次数,AASM指南中将其作为OSA严重程度的评价指标,AHI<5次/h为正常,AHI为5~<15次/h为轻度OSA,AHI为15~<30次/h为中度OSA,AHI≥30次/h为重度OSA[4]。
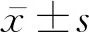
2 结 果
2.1 一般资料比较 OSA+OHS组的年龄、BMI、腰围、颈围均显著大于OSA组(P值分别<0.01或0.05),男性、高血压患者所占比例均显著高于OSA组(P值分别<0.01或0.05);两组间血脂异常和糖尿病患者所占比例的差异均无统计学意义(P值均>0.05)。见表1。

表1 两组一般资料比较
与OSA+OHS组比较:①P<0.01,②P<0.05
2.2 PSG指标比较 OSA+OHS组的AHI和ODI均显著大于OSA组(P值均<0.01),LAT显著长于OSA组(P<0.01),MSO2、NSO2、SIT90均显著低于OSA组(P值均<0.01)。见表2。


组别NAHI(次/h)ODI(次/h)LAT(s)MSO2(%)NSO2(%)SIT90(%)OSA+OHS 4282.0±42.082.7±46.565.3±25.886.9±7.461.8±16.437.6±27.7OSA129 40.3±29.0① 44.6±30.7① 46.2±23.2①93.7±3.3①77.8±12.1①9.0±5.6①
与OSA+OHS组比较:①P<0.01
2.3 OHS的预测指标分析 单因素logistic回归分析结果:肥胖合并OSA患者的年龄(OR=1.039,95%CI为1.005~1.075,P=0.026)、BMI(OR=1.063,95%CI为1.013~1.115,P=0.013)、腰围(OR=1.025,95%CI为1.001~1.049,P=0.038)、AHI(OR=1.034,95%CI为1.021~1.048,P<0.001)、ODI(OR=1.026,95%CI为1.009~1.043,P=0.002)、LAT(OR=1.033,95%CI为1.016~1.049,P<0.001)、MSO2(OR=0.772,95%CI为0.701~0.850,P<0.001)、NSO2(OR=0.930,95%CI为0.904~0.955,P<0.001)、SIT90(OR=1.055,95%CI为1.035~1.075,P<0.001)是OHS发生的预测指标;性别(OR=1.895,95%CI为0.921~3.899,P=0.083)、颈围(OR=1.077,95%CI为1.000~1.160,P=0.051)不是OHS发生的预测指标。多因素logistic回归分析结果提示:肥胖合并OSA患者的AHI和MSO2是OHS发生的独立预测指标(P值均<0.05)。见表3。
2.4 PSG指标单独或联合应用对OHS的预测能力 新变量Pre-1的ROC AUC为0.824,显著高于各检验变量单独应用的AUC(P值均<0.05)。分析Pre-1的ROC曲线不同截断点的敏感度、特异度,选择约登(Youden)指数最大的截断点对应的界值(Pre-1=826.7)作为OHS的诊断标准,得出其敏感度和特异度分别为0.733和0.818。见表4、图1。
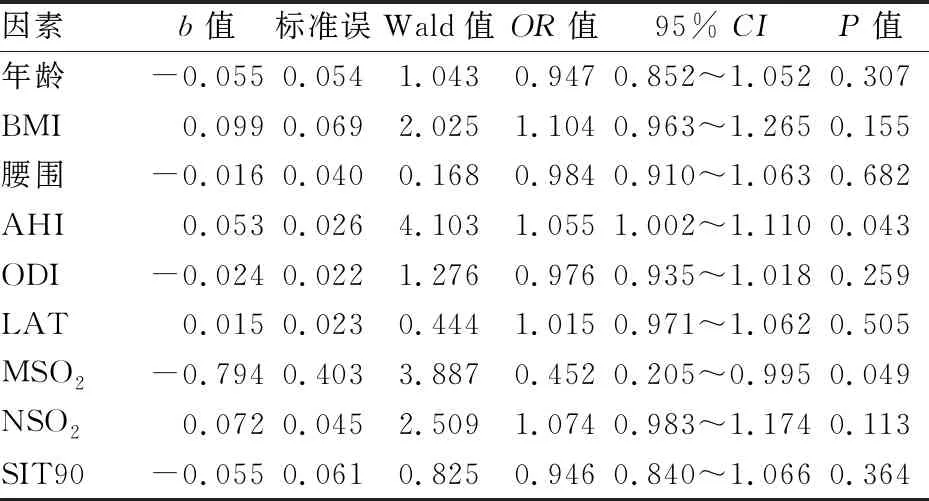
表3 logistic多因素分析OHS发生的预测指标

表4 ROC相关参数分析
与Pre-1比较:①P<0.05
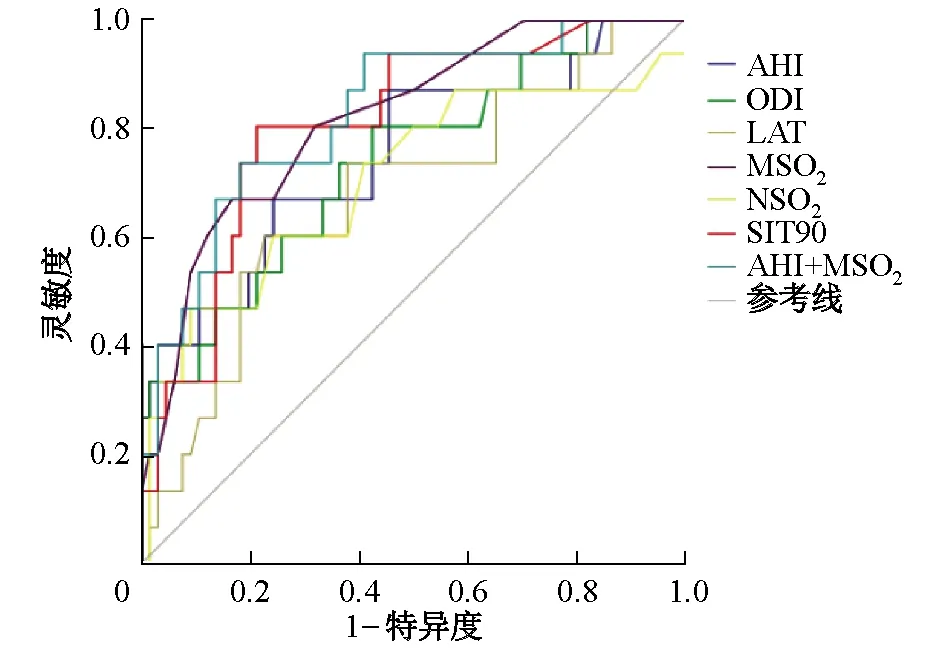
图1 肥胖合并OSA患者OHS发生的ROC曲线
3 讨 论
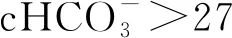
由于缺乏大规模流行病学调查研究,肥胖人群中OHS的发病率仍不清楚。在本研究中,24.6%(42/171)的肥胖OSA患者同时存在OHS,该比例略高于之前报道的10%~20%[5],这可能与人种间头影测量存在的差异,如黄种人的口咽更窄和舌骨下移有关[16-17]。OHS的发病机制复杂,主要涉及呼吸力学的改变、呼吸中枢驱动力异常和瘦素抵抗等[18]。首先,OHS患者呼吸系统顺应性下降约60%,呼吸负荷增加,呼气储备量减少,吸气肌力逐步下降,从而导致通气灌注不足和气体交换异常;其次,长期的CO2潴留提高了呼吸中枢对paCO2的反应阈值,导致其对低氧血症和高碳酸血症反应性下降,从而诱发低通气;最后,由于严重肥胖患者中存在中枢性瘦素抵抗,机体通气代偿机制受损,从而发生高碳酸血症[19]。
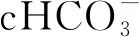
本研究尚存在一些不足:①本研究为诊断性试验,纳入病例数较少,证据力度不够;②OSA和OHS的发病机制仍不明确,两者的关系尚未得到充分解释;③PSG的结果容易受到监测期间睡眠状况的影响,睡眠时间不足和睡眠片段化均可能影响诊断性试验的准确性;④MBS对肥胖合并OSA的疗效已得到证实[24-26],而MBS对OHS的近期和远期疗效有待进一步研究。
综上所述, OHS是病态肥胖的严重并发症之一,常与OSA同时存在,早期识别OHS发生的风险对行MBS患者围术期的管理具有指导意义。对于肥胖合并OSA患者,AHI和MSO2是OHS发生的独立预测指标;与PSG相关指标单独应用相比,AHI与MSO2联合应用更有助于OHS的早期识别,其准确性有待大样本研究进一步验证。
(该论文经审稿,已入选“春蕾杯”科研论文评比)

