局部进展期肿瘤患者手术联合术中放疗的麻醉管理
黄志华 罗 艳 于布为 李一亮
局部进展期肿瘤仍是目前临床难以解决的治疗难题,术中放疗(IORT)在肿瘤治疗中的应用有很大的潜力。IORT是在手术切除肿瘤病灶后立即施行集中、精确的放射治疗,使用移动式电子加速器直接照射在瘤床或靶区,瘤床或靶区周围的照射剂量由半导体测量器评估,近年来相继应用于腹部[1-3]、胸部[4-6]、头部[7]、颈部[8-9]等局部进展期肿瘤患者,取得显著的临床疗效。IORT可单独应用也可与术后外照射等技术联合应用,并可作为肿瘤根治性切除后的辅助治疗手段,对控制局部复发具有重要作用。由于IORT存在一些局限性,在一定程度上限制了其实际应用:①麻醉状态下患者运送不便;②费时,靶区确定、对位、出束每一个步骤的时间延长都会导致手术总时间延长;③需配备特殊的防护装置防止光子泄漏;④操作技术要求较高。第一台可移动式术后放疗加速器——Mobetron,诞生于20世纪90年代,其较传统的加速器具有重量轻,与患者对位较容易、散射剂量低、自身带有射线阻挡器、阻挡机架所有运动方向的原射线等优势,使得IORT可以在手术室中进行。因此,使用Mobetron进行IORT更为简单、安全、省时、经济。本研究旨在回顾性分析局部进展期肿瘤患者手术联合IORT的麻醉管理结果。
1 对象与方法
1.1 研究对象 回顾性分析2012年1月—2015年8月在上海交通大学医学院附属瑞金医院被诊断为原发性[3]或继发性[10]局部进展期肿瘤并行手术治疗的160例年龄为35~71岁的患者的临床资料。纳入标准:①患者术前均经CT、MRI或PET-CT影像学诊断,以及CA19-9等血清肿瘤标志物检查诊断,手术切除标本或术中行活组织检查(简称活检)冰冻切片经病理学检查证实为进展期肿瘤;②原位癌或无远处转移者;③有远处转移但一般状况良好者。根据治疗方式将患者分为单纯手术组(80例)和手术联合IORT组(80例),所有患者均签署知情同意书。
1.2 麻醉方法 术前静脉注射盐酸昂丹司琼4 mg止吐,氟比洛芬酯50 mg镇痛,右美托咪定1 μg/kg镇静和地塞米松10 mg抗过敏。静脉注射丙泊酚2.0 mg/kg、芬太尼(1.0~1.5 μg/kg)和顺阿曲库胺0.2 mg/kg行麻醉诱导。气管插管后,以体积分数为0.7的氧气+体积分数为0.06的地氟烷吸入维持麻醉,调整潮气量和呼吸频率,维持呼气末二氧化碳分压为35~45 mmHg(1 mmHg=0.133 kPa), Narcotrend指数(反映麻醉深度)为45~55。予丙泊酚2.0 μg/mL持续经静脉泵注射,按需使用芬太尼和顺阿曲库胺行麻醉维持,保持血压、心率波动不超过诱导前基础值的20%。保持房间温度22~24 ℃,持续性鼻咽温监测36~37 ℃。常规行心电监护,监测动脉压、中心静脉压、脉搏血氧饱和度,以及术中尿量、出血量、输血量。IORT过程中,氧气的体积分数由0.7调至1,以提高肿瘤细胞对IORT的敏感度。在腹部肿瘤手术中调低潮气量(<8 mL/kg)限制腹式呼吸幅度,以减少IORT中不必要的移动和呼吸造成对位偏移。
1.3 IORT 对于能局部切除的肿瘤,在外科医师手术切除肿瘤并获取手术冰冻切片的病理结果后,外科与放疗科医师共同放置限光筒于瘤床和淋巴结引流区;对于手术无法切除的肿瘤,在活检的组织经病理诊断为恶性肿瘤后,放置限光筒包括肿瘤外正常组织1 cm,并将邻近的、正常的、射线敏感组织置于限光筒外。通过激光软到位进行精确对位,核对无误后操作控制单元完成直视下大剂量的照射,限光筒直径为6~10 cm,使用的电子能量为9~12 MeV,照射剂量为12~20 Gy。在瘤床或靶区周围(如胰腺附近的肝脏、十二指肠和胃等部位)放置半导体测量仪测量IORT中正常组织的射线吸收剂量。外科和放疗科医师确定靶区并放置限光筒后,进床对位[11],由麻醉科医师确认呼吸回路、静脉通路、监测装置均正常后离开手术室。出束完成照射后,外科医师在靶区留置金属钛夹以便术后放射治疗定位。
1.4 观察指标 术后患者转到麻醉后恢复室(PACU),监测其自主呼吸、清醒程度、反射恢复等,观察术中有无麻醉并发症,以及术后苏醒质量。由外科医师根据患者的情况决定其转回ICU还是普通病房。术中、术后观察有无呼吸系统(机械通气时间延长)、心血管系统(心肌梗死、充血性心力衰竭、心律失常)、神经系统(脑血管意外、休克时间>24 h)、泌尿系统(需透析的急性肾衰竭)和其他并发症(肝衰竭、精神状态异常、脓毒血症、深静脉血栓栓塞)的发生。
2 结 果
2.1 两组患者临床基本资料的比较 两组间患者的性别构成、年龄、肿瘤病种和肿瘤性质的差异均无统计学意义(P值均>0.05)。见表1。
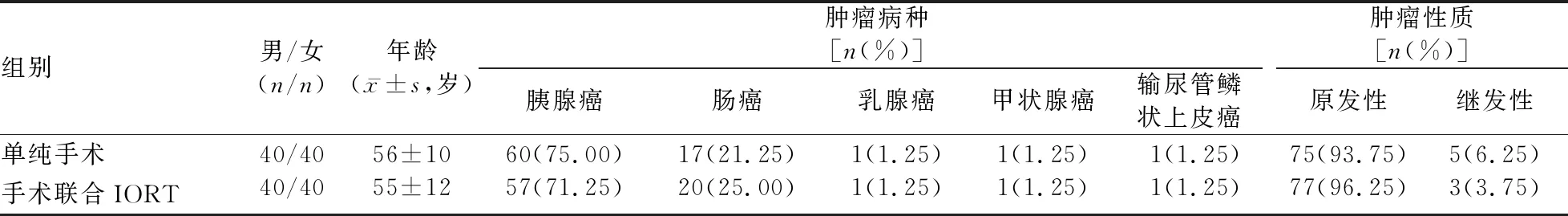
表1 两组患者的临床基本资料比较 (N=80)
2.2 两组患者术中麻醉管理的比较 手术联合IORT组的麻醉时间和手术时间均显著长于单纯手术组(P值均<0.05)。两组患者术中失血量、尿量、输血例数、晶体胶体输入量的差异均无统计学意义(P值均>0.05)。见表2。

表2 两组患者术中麻醉管理的比较 (N=80)
与单纯手术组比较:①P<0.05
2.3 两组患者麻醉监测指标的比较 两组患者的复苏时间、最低体温、Narcotrend指数、心率、脉搏血氧饱和度、呼气末二氧化碳分压的差异均无统计学意义(P值均>0.05)。见表3。


组别复苏时间(x-±s,min)最低体温(℃)Narcotrend指数心率(次/min)脉搏血氧饱和度(%)呼气末二氧化碳分压(mmHg)单纯手术16.22±13.6736.00±0.8948.00±5.6672.10±2.3099.10±0.8035.70±2.88手术合并IORT 15.05±10.1536.43±0.2245.00±4.7970.30±3.6099.45±0.5134.80±3.22
2.4 手术联合IORT组患者的放射治疗安全参数 本组无1例患者发生与麻醉相关的严重并发症。靶区组织吸收的剂量[12(10, 20) Gy]显著高于靶区周围正常组织吸收的剂量[0.20(0.02, 0.30) Gy,P<0.01]。应用热释光剂量仪监测距手术室最近的房间(Mobetron IORT单位距邻近房间中心位置大约5 m),测得每年平均累计照射剂量为(0.44±0.28) mSv。
3 讨 论
与常规外照射相比,IORT具有靶区小、表面剂量高、生物学效应高的特点:①术中可在直视下对肿瘤、瘤床和淋巴引流区进行一次性直接、精确、大剂量照射,有效破坏无法切除和手术后残留的肿瘤组织;②正常组织能够被最大限度地排除或者遮挡在照射野之外,利用高能电子束表面剂量高、达到最大剂量点深度后急剧衰减的特性,使靶区照射剂量均匀,病灶后方的正常组织和器官的照射量剂小,从而避免和减少放射治疗并发症(如与胰腺毗邻的十二指肠最高耐受量不超过54 Gy,外照射容易产生3、4级毒性反应);③一般一次18~20 Gy的IORT同50 Gy的外照射效果相当[12],其生物学效应是同剂量分次体外照射生物效应的1.5~2.5倍[13]。
麻醉科医师在实施IORT的手术麻醉时面临的挑战[14]:突发大出血急需大量输血、输液,低血压,手术时间延长,放射治疗期间远程监护的风险,以及如何保持充分的镇静、镇痛、呼吸循环稳定。IORT患者的麻醉管理除遵从全身麻醉的常规原则之外,还需关注其特殊之处:①IORT需要多学科间良好协作。此类手术要求外科医师、麻醉科医师、放疗科医师、物理师、设备工程师和手术室护士在术前充分沟通,术中密切合作。②避免移动。在整个IORT过程中避免移动患者至关重要。常规的气管插管麻醉是IORT最合适的选择,虽然可使用喉罩,但此类患者多有自主呼吸,潮气量或呼吸频率突然大幅波动会导致电子束聚焦不准确,从而影响精确度。肌肉松弛的气管插管麻醉是一种理想的麻醉方法,因为患者处于呼吸机控制中,解决了潮气量或呼吸频率大幅波动的问题[15]。同时,IORT前可适当加深麻醉,以防患者出现无意识的体动或自主呼吸;Narcotrend指数监测可有助于麻醉科医师更好地把握麻醉深度,通常将Narcotrend指数控制在45~55范围。③加强监测。遵照放射保护法,在IORT进行的2 min中,医护和技术人员必须撤离手术室,麻醉科医师需远程密切监测患者的重要生命体征,保证其安全。IORT前麻醉科医师必须反复确认电路、气路、麻醉系统和监护系统的工作状态,以及患者的体位,检查呼吸回路连接稳固通畅。通过闭路电视进行远距离监测以便于麻醉科医师自身的放射防护。④采用适当调低潮气量等方法限制腹式呼吸幅度,减少呼吸运动对照射野的影响。⑤克服乏氧细胞的放射抗拒性。乏氧是肿瘤放射抗拒的重要原因之一,但长时间吸入高浓度氧可引起肺泡萎缩,术后呼吸系统并发症增多,高低氧吸入的方法可能有助于上述问题的解决。先吸入高浓度氧,正常组织氧浓度很快上升,1 min后可达最大值,而肿瘤组织需要5 min才能达到最大值,此时将吸入氧改为低浓度氧,1 min后正常组织氧浓度迅速下降,肿瘤组织仍保持高水平,从而出现一个肿瘤组织中氧浓度高而正常组织氧浓度低的最佳放疗时期。在IORT时,通常会吸入较高浓度的氧气,机体组织普遍处于高氧浓度状态,但IORT的照射野集中于肿瘤组织,因此对正常组织的影响很小[16]。
麻醉科医师在腹部手术的围术期管理中起着至关重要的作用,可影响患者的预后[17]。由于靶区确定、放置限光筒、进床对位和出束完成照射使手术联合IORT组较单纯手术组的麻醉时间、手术时间均明显延长。如胰腺癌手术患者多为高龄老人,多合并糖尿病或糖耐量异常,加之手术部位的解剖原因,术式尤为复杂,常伴术中大量失血,从而增加了麻醉的风险。麻醉科医师应参与患者的术前风险评估和抗生素应用、优化术中通气、输血和输液管理、预防低体温、预防血栓形成和手术区域感染等治疗过程。充分的围术期准备,优化围术期条件,术中正确地施行麻醉管理,使患者保持生命体征稳定,有助于手术联合IORT的安全施行。合理的麻醉用药、完善的术中监测、适当的液体治疗,均有助于维持患者的呼吸和循环稳定,以及内环境平衡。
本研究中手术联合IORT患者均无与麻醉相关的严重并发症发生,如心力衰竭、肾衰竭或脑功能衰竭、术后进入ICU的患者大多在3 d内转入普通病房,术后30 d内无患者死亡。Wojciezek等[18]和Sawaki等[19-20]的研究认为,全身麻醉下将患者转至加速器室进行IORT是安全的。本研究进一步肯定了手术联合IORT麻醉的可行性和安全性。患者接受安全、有效的麻醉管理后,IORT过程无需转运。术后管理包括早期拔除胃管和引流管、早期给予胃肠营养支持、液体治疗、镇痛治疗、预防静脉血栓形成,以及加强呼吸恢复等。
Loi等[21]报道了使用Mobetron在手术中进行高能量(12 MeV)照射的剂量同样可用于无防护的手术。Wenz等[22]认为,IORT可在手术室中实施,而无需过度放射防护。本研究未发现由Mobetron造成的光子泄漏和散射辐射,进一步证实在无特殊防护的手术室使用Mobetron是安全的。同时,距手术室最近的房间测得每年平均累计照射剂量远低于国家规定的安全阈值(5 msn/年),说明IORT对医护人员和周围环境的影响较小。高剂量精确放射治疗和治疗的短时效均有助于安全地对患者进行全身麻醉,手术联合IORT中的麻醉和IORT本身都是可控且安全的。
综上所述,多学科间良好协作,充分的术前评估,优化患者手术条件,保持血流动力学、心肺功能和代谢稳定均可减少麻醉并发症的发生。此外,还要关注麻醉深度控制、患者体位、设备管理、放射防护、患者的放射治疗增敏、放射治疗并发症的预防等,麻醉科医师必须做好围术期的充分准备和合理的麻醉管理以确保手术联合IORT的安全实施。
由于手术联合IORT开展时间不长,临床积累的经验有限,给麻醉科医师带来诸多挑战,为确保患者的安全性,本研究选取了一般条件较好的患者,希望积累一定经验后,可考虑将其用于体弱患者、肿瘤手术切除术中可能发生大量失血等患者的术中麻醉管理。

