镁、铁离子降低羧甲基纤维素保水剂吸水率的机理探讨
张志成,乔秀臣
(华东理工大学 资源与环境工程学院,上海 200237)
交联化羧甲基纤维素(CCMC)拥有很高的吸水保水性能,被广泛应用于农林保水与沙漠治理。但在实际应用中,多价阳离子的介入,导致其吸水能力显著降低[1]。镁[2]、铁[3]等是植物生长必须的中量元素,广泛存在于煤气化灰渣中。如能将煤气化灰渣应用到抗旱治沙,所带来的环境与经济效益将非常显著。但必需理解CCMC中羧基与多价离子的结合方式如何影响其吸水机制。
本文以Mg2+、Fe3+为目标离子,采用IR测试探讨CCMC中羧基与Mg2+、Fe3+的结合方式;采用TG测试有机物交联密度的方法,分析引入Mg2+、Fe3+对CCMC交联密度的影响;以期明确Mg2+、Fe3+降低CCMC吸水率的机理。
1 实验部分
1.1 试剂与仪器
羧甲基纤维素钠(CMC,300~800 mPa·s)、氢氧化钠、环氧氯丙烷(ECH)、六水合氯化铁、六水合氯化镁均为分析纯;实验用水为去离子水。
iS10型傅里叶变换红外光谱仪(FT-IR);AL204型电子分析天平(精度为0.000 1 g);OST20 digital型机械搅拌器;STA 449 F3型热重-示差扫描量热仪(TG-DSC);DHG-9017A型电热恒温干燥箱。
1.2 交联羧甲基纤维素合成
将CMC溶解于NaOH溶液(3%),形成澄清均匀的CMC溶液(5%)。取100 mL溶液,加入5 mL ECH,不断搅拌,至形成均匀透明的溶液,放入60 ℃电热恒温干燥箱中反应12 h。将烘干的样品取出,用去离子水反复洗涤,直至凝胶变为无色透明,再用无水乙醇洗涤脱水。重复洗涤操作3次。将洗涤后的凝胶破碎成小块,放入60 ℃电热恒温干燥箱烘干至恒重。用研钵研磨至粒径0.3~0.9 mm。
1.3 吸水率测量
利用茶袋法测量吸水率,将0.10 g左右(Wp1)保水剂颗粒装入已知质量(W0)的200目尼龙茶袋中,浸入溶液中,充分吸水后,取出,悬空15 min并用滤纸擦拭茶袋表面除去浮水,然后称取吸水后茶袋与水凝胶总重(Wg)。计算吸水率。
WA=(Wg-Wp1-W0)/Wp1
(1)
式中,WA表示吸水率,Wg表示吸水后水凝胶和茶袋重量,W0表示茶袋质量,Wp1是放入茶袋的吸水剂颗粒质量。
在盐溶液中充分吸水的保水剂放入去离子水中,再次充分吸水后,测其茶袋和水凝胶总重(Wg2)。此时计算出的吸水率记为WAS→D。
所用溶液为去离子水和0.10 mol/L NaCl、MgCl2、FeCl3溶液。在MgCl2和FeCl3溶液中充分吸水后在60 ℃电热干燥箱中烘干的样品分别命名为CCMC-Mg和CCMC-Fe。
1.4 红外测试
由Flory公式可知,保水剂的亲水性强弱与亲水基团的种类有关,同时也与亲水基团和阳离子结合形成的离子对电离度有关[4]。Zelenak V等[5]通过IR分析发现,Zn2+与肉桂酸中羧基以双原子螯合方式结合;Wafaa M H等[6]结合IR与磁电子光谱研究发现Ni2+、Cu2+与CMC中羧基都是以单原子螯合方式结合,同时连接CMC上的一个羟基。
采用NICOLET iS10型红外光谱仪对粉末样品直接进行红外测定,扫描范围为500~4 000 cm-1。
1.5 热重测试
针对有机物交联密度的测试方法有单轴压缩方法、自由溶胀法和13C-NMR等[7-8],但这些方法只适用于测试吸水率高,凝胶强度大的保水剂,而对于吸附多价离子后吸水率显著降低的保水剂则不适用。此外,当有Fe元素存在时,对13C NMR测试的准确性会造成显著干扰。借鉴林燕宜等[9]和余芬等[10]采用TG测试有机物交联密度的方法。
本文采用STA 449 F3型号热重示差扫描量热仪测试物相在温度升高过程中,热量及重量变化。将在盐溶液中饱和吸水后的CCMC取出,悬挂15 min除去表面溶液后,置于60 ℃电热干燥箱中12 h,研磨过100目筛网。将10 mg固体样品放入氧化铝材质的坩埚中,在20 mL/min的氮气氛围中,以20 K/min从室温升到1 100 ℃。根据不同阶段质量变化曲线(TG曲线)定性分析固相中的成分及相关分解过程。
2 结果与讨论
2.1 Mg2+、Fe3+对CCMC电离度的影响
2.1.1 吸水率 见表1。

表1 CCMC在不同盐溶液中的吸水率Table 1 Water absorbency of CCMC in various solutions
由表1可知,CCMC在去离子水中的吸水率为969.0 g/g,保水能力与文献和商品化样品相当。当置于MgCl2溶液中后,其吸水率降低约26倍,为36.7 g/g;置于FeCl3溶液中后,其保水能力几乎全部丧失,仅为1.7 g/g。受Mg2+、Fe3+影响的CCMC,即使再置于去离子水中,其吸水率也无法有效恢复,分别为125.6,2.3 g/g。恢复能力也随着阳离子价态的提高而降低。
2.1.2 FTIR CCMC、CCMC-Fe和CCMC-Mg的红外谱图见图1。
由图1可知,3 400 cm-1(O—H的轴向变形) 和1 380~1 300 cm-1(O—H平面角变形)处的振动峰源自于材料表面吸收的水分子、聚合物上的仲醇羟基、分子间或分子内氢键的羟基;1 200~1 000 cm-1处振动峰源自β-1,4糖苷键或醚键的轴向变形峰;1 589 cm-1和1 413 cm-1处的振动峰分别对应羧酸盐形式的羧酸基团的非对称振动和对称振动。CCMC-Mg在3 400 cm-1处的O—H振动强度显著增强,这可归因于MgCl2的强吸湿性。CCMC-Fe在1 721 cm-1处出现的新振动峰,是因为FeCl3溶液较低的pH致使羧酸基团质子化的结果[11]。
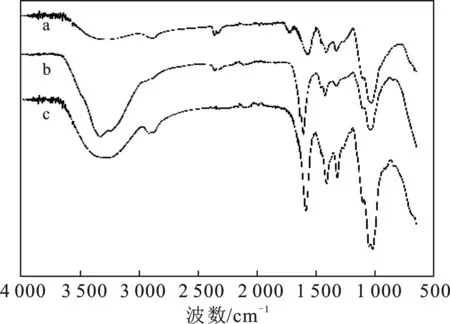
图1 CCMC-Fe(a)、CCMC-Mg(b)、CCMC(c)的红外谱图Fig.1 IR spectra of CCMC-Fe(a),CCMC-Mg(b),CCMC(c)
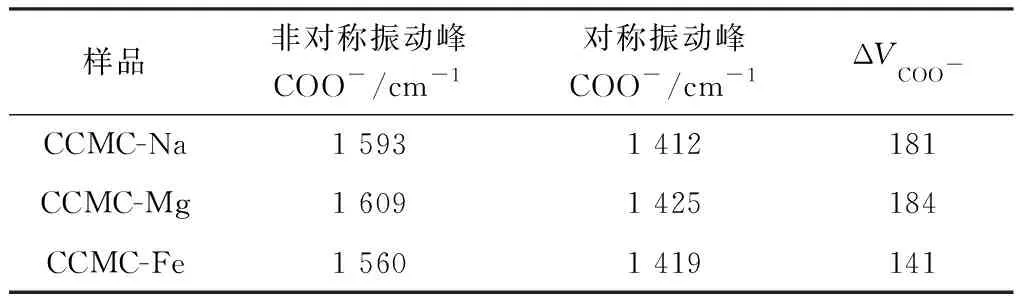
表2 CCMC、CCMC-Mg和CCMC-Fe中的羧基对称振动和非对称振动的差值ΔVCOO- Table 2 ΔVCOO- of COO- asymmetric and symmetric stretching vibrations in CCMC,CCMC-Mg and CCMC-Fe
El-wahab Z H[12]的研究显示,羧基与阳离子结合通常有4种途径:①单原子螯合配位(羧基上只有一个氧原子结合金属阳离子);②双原子螯合配位(羧基上的两个氧原子结合在同一个金属阳离子上);③双原子桥连作用(羧基的两个氧原子分别连接两个不同的金属阳离子);④离子作用。Atef A I等[13]通过比较羧基和阳离子所结合形成羧酸盐的非对称和对称振动峰波数之间的差值ΔV(COO-)聚合物与钠盐形式ΔV(COO-)Na,来判断金属阳离子与羧基的结合途径。他们将ΔV(COO-)聚合物大于ΔV(COO-)Na的阳离子和CCMC的结合视为单原子螯合配位,将差值ΔV(COO-)聚合物远小于ΔV(COO-)Na的阳离子和CCMC的结合视为双原子螯合配位,将ΔV(COO-)聚合物与ΔV(COO-)Na相近的阳离子和CCMC的结合视为双原子桥连配位。同时Zelenak V等[5]研究表明,双原子螯合会促进非对称羧基振动向低频移动,降低对称非对称振动差值,而双原子桥连作用下的非对称振动峰则不会改变位置。由表2可知,CCMC-Fe的非对称峰向低频移动,ΔV(COO-)聚合物(141)远小于ΔV(COO-)Na(181),说明Fe3+与CCMC羧基结合是双原子螯合配位;而CCMC-Mg的非对称峰向高频移动,且ΔV(COO-)聚合物(184)大于ΔV(COO-)Na,说明Mg2+与羧基结合是单原子螯合配位。
CCMC在去离子水中吸水时,—COONa在水中电离出可以自由移动的Na+,从而在网络结构内部形成渗透压,促进外界水分子进入网络结构内部,同时固定在聚合物长链上的—COO-彼此间相互排斥,扩大网络结构,容纳更多的水分子,从而实现高吸水率。CCMC在MgCl2溶液中饱和吸水后,再次置于去离子水中,由于Mg2+与—COO-单原子螯合配位后,CCMC-Mg的电离度降低,无法电离出自由移动的阳离子,从而形成稳定的离子浓度,进而形成有效的渗透压,以此产生高效吸水;而只能通过CCMC-Mg的网络结构中已经吸附的水溶液中的MgCl2增加渗透压,促进CCMC-Mg外部的去离子水向网络结构内部扩散,同时网络结构内部的MgCl2也由于缺乏必要的束缚力,在浓度差作用下向网络结构外部的去离子水中扩散,最终达到扩散平衡,因此,CCMC-Mg在去离子水中的吸水率只能部分恢复(表1)。CCMC在FeCl3溶液中饱和吸水后,再次置于去离子水中,由于Fe3+与多个—COO-双原子螯合配位后,会形成新的交联结构,在降低羧酸基团电离度的同时,还限制了网络结构的吸水膨胀程度,加之CCMC-Fe的网络结构中吸附的FeCl3水溶液量非常低,因此,CCMC-Fe在去离子水中的吸水率也仅有少量恢复(表1)。
2.2 Mg2+、Fe3+对CCMC交联度的影响
2.2.1 CCMC的交联度分析 由图2、图3可知,CMC与CCMC在加热至1 100 ℃过程中有4个失重阶段,各失重阶段温度范围和质量损失见表3。
第1个失重阶段主要是水分损失。可以看出CCMC具有更高的水分损失,同时从CCMC的DTG曲线可以看出,水分损失分阶段对应两个最大降解速率温度(Tm),分别为78.7 ℃和193.7 ℃,分别对应自由水和结合水失去[14]。
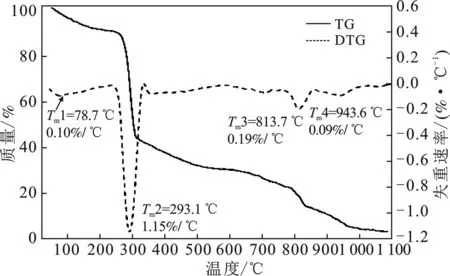
图2 CMC的TG,DTG曲线Fig.2 TG and DTG curves of CMC
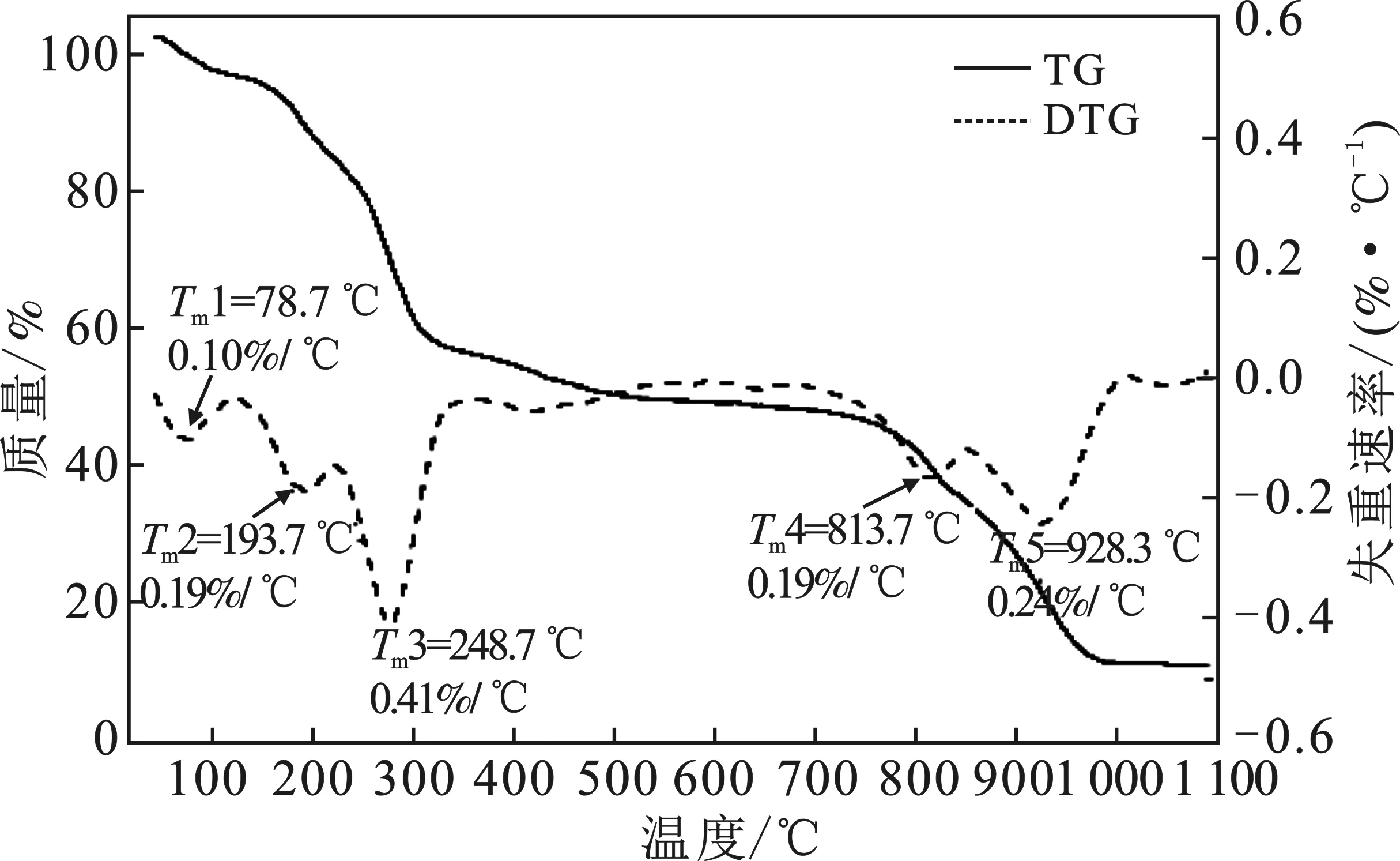
图3 CCMC的TG,DTG曲线Fig.3 TG and DTG curves of CCMC
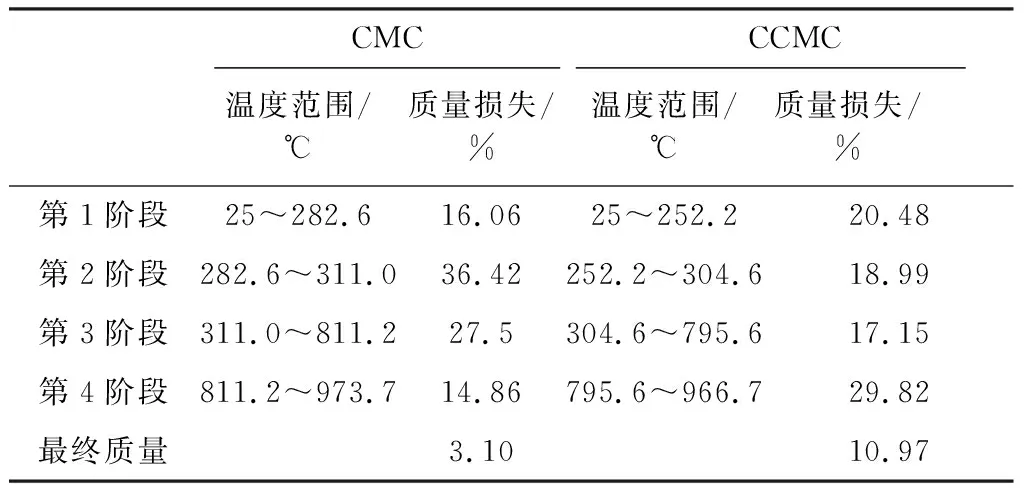
表3 CMC和CCMC的失重阶段温度范围、质量损失Table 3 Temperature range and mass loss of CMC and CCMC
第2个失重阶段是纤维素的解聚、开环以及碳化过程,伴随糖苷键的断裂,形成以左旋葡萄糖为主的呋喃以及吡喃类物质,同时纤维素单体内部开环和分裂生成小分子物质[15]。在此阶段,CCMC进一步失重的起始温度提前了30.4 ℃,Tm提前了16.1 ℃,但是质量损失却降低了17.43%。结合第3个失重阶段CCMC依然很低的质量损失结果,可以确定CCMC结构更稳定。说明引入ECH产生的交联反应增加了CCMC结构中纤维素单体的稳定性。最终 CCMC的残余质量是CMC的3倍有余,这一方面是由于CCMC结构稳定而让较多的有机碳得以碳化,另一方面,CCMC中Na的存在也利于碳化发生[16]。
2.2.2 CCMC-Mg、CCMC-Fe的交联度变化 见图4、图5和表4。
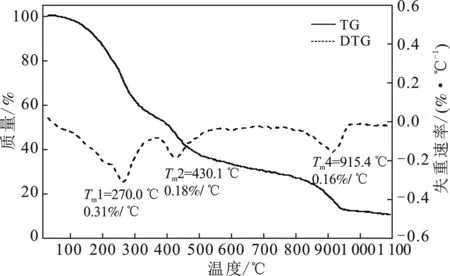
图4 CCMC-Mg的TG,DTG曲线Fig.4 TG and DTG curves of CCMC-Mg

图5 CCMC-Fe的TG与DTG曲线Fig.5 TG and DTG curves of CCMC-Fe
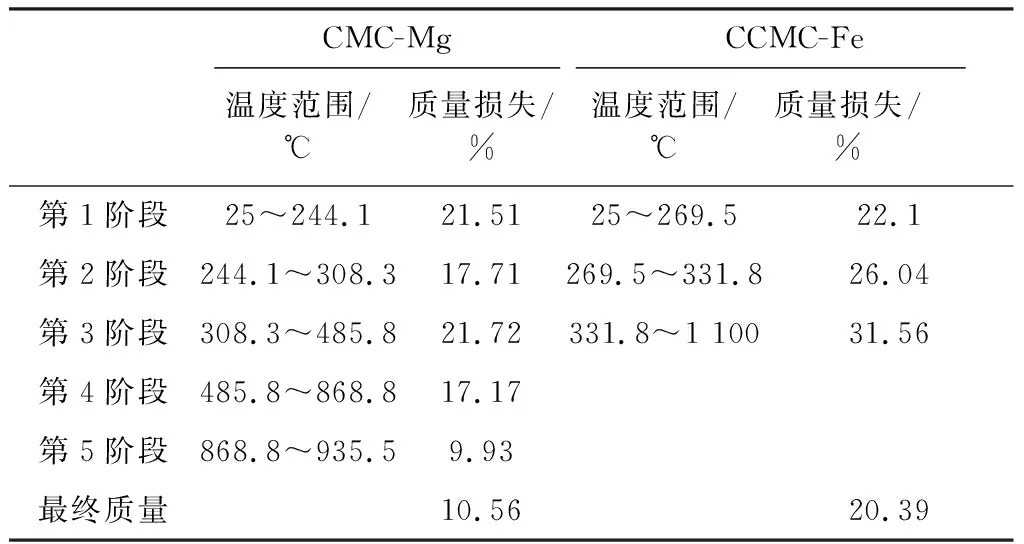
表4 CCMC-Mg 和 CCMC-Fe的失重阶段温度范围、质量损失Table 4 Temperature range and mass loss of CCMC-Mg and CCMC-Fe
由图4和表4可知,CCMC-Mg的第1个失重阶段(25~244.1 ℃)是一个连续失重的过程,这是因为MgCl2晶体的结晶水在此温度范围是一个连续脱除的过程[17]。相比CCMC,第2个失重阶段中(244.1~308.3 ℃),CCMC-Mg的起始失重温度、质量损失和Tm分别降低8.1 ℃、1.28%和 8.7 ℃,这主要是因为MgCl2对CCMC的热解有催化作用[18-19]。如果忽略Mg2+与CCMC化学结合的量,根据表1数据计算可知,单位质量CCMC-Mg所吸收的溶液中所含MgCl2为0.35 g(3.67×10-3mol)。因此,每克CCMC-Mg的组成可以记为0.74 g CCMC和0.26 g MgCl2。如果假定含结晶水MgCl2全部高温分解为MgO (反应式1~4)[17]:
69 ℃时,

(1)
129 ℃时,

(2)
167 ℃时,

+bMgOHCl+bHCl
(3)
(4)
依据CCMC最终的质量残余10.97%计算,CCMC-Mg的质量残余为19.11%(其中CCMC碳化贡献42.49%,MgCl2全部分解为MgO贡献57.51%),而表4中CCMC-Mg的实测质量残余为10.56%,因此可以推断部分MgCl2并未形成MgO,而是以MgCl2形式在高温下挥发。余芬等[10]发现随着交联反应产物交联度增加,其碳化反应起始温度上升,而林燕宜等[9]发现,交联度增大会降低质量损失。与CCMC相比,CCMC-Mg热解起始温度降低,质量损失增大,由此可见CCMC-Mg的交联度并没有增强,Mg2+单原子螯合羧基没有形成新的交联结构。
由图5和表4可知,CCMC-Fe的分解过程与CCMC-Mg差异显著,其失重仅包含3个阶段,第1个失重阶段(25~269.5 ℃)是一个连续失重的过程,可以归因于FeCl3晶体的结晶水在此温度范围是一个连续脱除的过程。相比CCMC,第2个失重阶段中(269.5~331.8 ℃),CCMC-Fe的起始失重温度、质量损失和Tm分别升高17.3 ℃、7.05%和16.7 ℃,这说明Fe3+存在提高了CCMC-Fe的结构稳定性。如果忽略Fe3+与CCMC化学结合的量,根据表1数据计算可知,单位质量CCMC-Fe所吸收的溶液中所含FeCl3为0.03 g(1.7×10-4mol)。因此,每克CCMC-Fe的组成可以记为0.97 g CCMC与0.03 g FeCl3。如果假定含结晶水FeCl3全部高温分解为Fe2O3(反应式5~7)[18-20]:

FeOCl·H2O+(x-2)H2O+2HCl
(5)

(6)
(7)
依据CCMC最终的质量残余10.97%计算,CCMC-Fe的质量残余为12.11%(其中CCMC碳化贡献87.86%,FeCl3全部分解为Fe2O3贡献12.14%),而表4 CCMC-Fe的实测质量残余为20.39%,可知Fe3+与CCMC化学结合的量不仅无法忽略,而且占比很高。这说明Fe3+能够与CCMC的羧基通过双原子螯合配位有效结合。与CCMC和CCMC-Mg相比,CCMC-Fe的失重起始温度明显升高,同时质量损失显著降低,这说明Fe3+双原子螯合羧基,增强了CCMC的交联度。
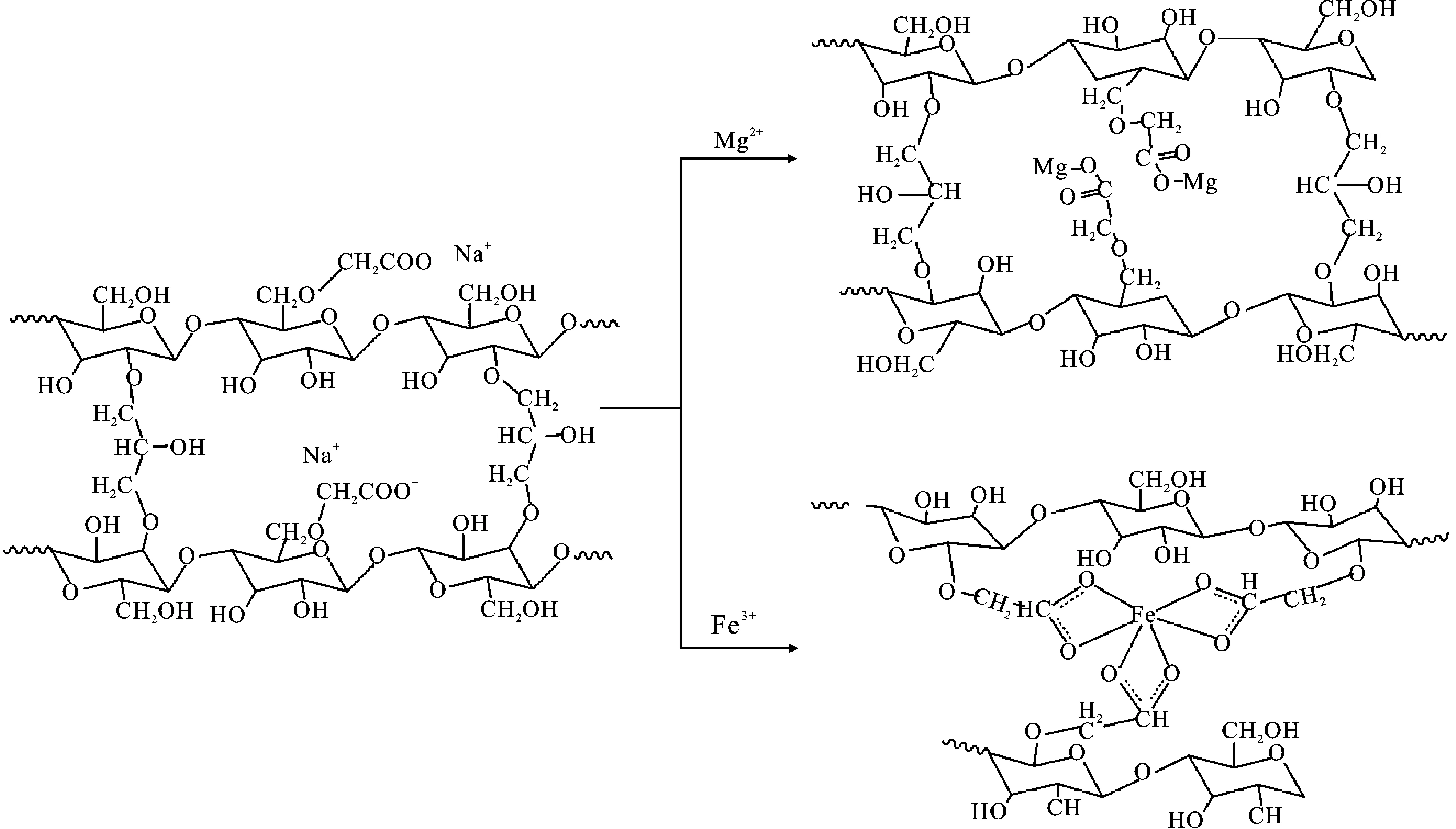
因此,Mg2+或Fe3+降低CCMC在吸水率的机理见图6。
3 结论
CCMC虽然在去离子水中表现出很高的吸水保水能力,但是当溶液中含有Mg2+时,Mg2+可以与CCMC中的—COO-通过单原子螯合形成配位,降低离子对电离程度,进而降低CCMC网络结构内外的渗透压差,导致其吸水保水能力降低;当CCMC与溶液中的Fe3+接触后,Fe3+会与CCMC中多个—COO-通过双原子螯合形式配位,降低羧酸基团电离度的同时,形成新的交联结构,提高交联度,进而限制了网络结构的吸水膨胀程度。因此,要解决离子型农用保水剂耐二价,特别是耐三价盐离子的能力,可以通过提升交联剂的链长来实现。

