水滑石基Ni(Mn,Cu)Fe复合氧化物的制备及其低温NH3-SCR应用
次超,杜亚丽,杨宝拴,邹春蕾,吴旭
(1. 太原理工大学化学化工学院,山西太原,030024;2. 晋中学院化学化工学院,山西晋中,030619)
化石燃料燃烧产生的氮氧化物(NOx)会造成严重的环境问题,包括酸雨、光化学烟雾和温室效应等[1-3]。随着人们环保意识的不断增强,世界各国纷纷颁布相应的法律法规控制NOx排放,NOx的高效脱除已成为相关工业生产单元的重要任务。在众多脱硝技术中,氨选择性催化还原技术(NH3-SCR)因其脱除效率高、气体处理量大、反应条件易于控制等优势而在当前得到国内外广泛应用,而该技术能否发挥高效性能的关键取决于催化剂的性能[4-5]。鉴于很多企业排烟温度相对较低,探索研发低温活性好、N2选择性高、抗水抗硫性能强的脱硝催化剂意义重大。Ni 基氧化物催化剂价格低廉,将其与其他金属掺杂可有效调节催化剂的氧化还原性及酸碱性,从而抑制NH3的过氧化,提高N2选择性[6]。Fe基氧化物催化剂具有较高的中高温脱硝活性和较好的抗SO2中毒性能[7]。基于类水滑石衍生物晶体粒径分布均匀、热稳定性良好和抗烧结等优点,WANG 等[8]通过研究发现,经NiFe 类水滑石(NiFe-LDH)衍生制备的镍铁复合氧化物(NiFe-LDO)催化剂具有较好的抗硫性能和催化稳定性,但其低温脱硝活性并不突出,仍需要进一步优化。LIU 等[9]指出金属掺杂能够有效分散活性中心,增强催化剂与气体之间的吸附和活化,提升催化剂的低温脱硝活性。在低温SCR 反应的活性组分中,锰基氧化物由于丰富多变的价态和良好的氧化还原能力得到了深入研究[10-12],铜基氧化物则因其拥有适中的氧化还原能力及配位不饱和的酸性位点也备受关注。基于以上研究现状,本文作者在NiFe-LDH层板中原位引入适量协同功能组分Mn和Cu,经同晶取代制备Ni(Mn,Cu)Fe类水滑石(Ni(Mn, Cu)Fe-LDHs)前驱体,将高温拓扑转变衍生构筑的Ni(Mn,Cu)Fe 复合氧化物(Ni(Mn,Cu)Fe-LDO)催化剂应用于NH3-SCR 反应,借助一系列表征技术揭示Mn 和Cu 掺杂对镍铁基复合氧化物理化性能及脱硝效果的影响,优选低温SCR催化剂。
1 实验
1.1 材料准备
实验所用原料:Ni(NO3)2·6H2O(分析纯,国药集团化学试剂有限公司);Fe(NO3)3·9H2O(分析纯,天津市天力化学试剂有限公司);Mn(NO3)2(质量分数为50%(下同)分析纯,天津市天力化学试剂有限公司);Cu(NO3)2·3H2O(分析纯,天津市天力化学试剂有限公司);尿素(分析纯,天津市北辰方正试剂厂);柠檬酸钠(分析纯,天津市凯通化学试剂有限公司)和蒸馏水(太原理工大学中试基地)。
1.2 催化剂的制备
采用尿素水热分解法,制备NiFe-LDH 和Ni(Mn, Cu)Fe-LDHs 前驱体。制备NiFe-LDH 时,保持n(Ni2+):n(Fe3+)为4:1(其中,n为物质的量),将Ni(NO3)2·6H2O 和Fe(NO3)3·9H2O 溶于去离子水;制备Ni(Mn, Cu)Fe-LDH 时,保持n(Ni2+):n(M2+):n(Fe3+)为3:1:1,将Ni(NO3)2.6H2O,Fe(NO3)3.9H2O和Mn(NO3)2(50%)溶液(或Cu(NO3)2.3H2O)溶于去离子水,称取少量络合剂柠檬酸钠加入上述混合溶液中,按(尿素)为9:7向溶液中加入尿素,将混合溶液置于磁力搅拌器上搅拌30 min 后转移至高压反应釜,于120°C水热反应24 h后经抽滤、洗涤和干燥(80°C,12 h),即得到NiFe-LDH 和Ni(Mn,Cu)Fe-LDHs前驱体。将研磨至细粉末的水滑石前驱体500°C煅烧5 h,产物催化剂分别标记为NiFe-LDO,NiMnFe-LDO和NiCuFe-LDO。
1.3 催化剂表征
1) X-射线衍射(XRD)。采用Rigaku D/max-2500X 射线粉末衍射仪(X-ray diffraction,XRD)表征样品的物相组成及晶型结构。测试的辐射源为Cu Kα射线,工作电压为40 kV,电流为30 mA,扫描速度为8(°)/min,扫描范围为5°~85°。
2) N2-吸附脱附。采用Nova1 200(Quanta106 Chrome)仪器对催化剂样品测试N2-吸附脱附性能。将0.1 g催化剂在300°C真空条件下预处理4 h,并在-198°C(液氮)条件下测试N2-吸附脱附性能,获取对应的吸附脱附等温线。采用BET 法和BJH 法获得被测样品的比表面积和孔隙结构等信息。
3) 傅里叶变换红外光谱(FT-IR)。采用Bruker Vertex 70 傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FT-IR spectrometer)测试催化剂,使用KBr 法制片。称取1 mg 催化剂和100 mg KBr,将两者混合充分研磨均匀后,进行压片处理。仪器的分辨率选择4 cm-1,测定样品的红外图像(400~4 000 cm-1波数内)。
4) NH-程序升温脱附(NH3-TPD)。使用程序升温脱附化学吸附仪FINESORB-3010C(浙江泛泰仪器有限公司)来确定催化剂的表面酸性。称取0.08 g 催化剂装入石英反应管,为了排除水以及其他气体的干扰,通入纯氦气在300°C 下预处理1 h,降温至50°C通入NH3吸附30 min,再用氦气吹扫l h 以除去气态和物理吸附的NH3,以10°C/min的升温速率从50°C升温至700°C,在升温过程中,热导检测器记录NH3程序升温脱附信号。
5)H2-程序升温还原(H2-TPR)。在程序升温化学吸附仪(FINESORB-3010C,浙江泛泰仪器有限公司)上进行H2-TPR 测试。称取0.08 g 催化剂装入石英反应管,通入纯氩气在300°C 下预处理1 h,降温至50°C 通入氩气吹扫1 h,然后以10°C/min的升温速率从50°C 升温至700°C 进行还原实验,采用热导检测器对相关信号进行检测。
6) X 射线光电子能谱测试(XPS)。借助英国Kratos 公司生产的Axis Ultra 多功能表面能谱分析仪进行X 射线光电子能谱(X-ray photoelectron spectroscopy)测试,获取催化剂表面元素含量和价态分布信息。测试条件如下:辐照光源采用Al Kα,能量为1 486.6 eV,操作功率为150 W。图谱校正采用Cls=284.6。使用非线性Shirley 型背景分析XPS信号。
2 前驱体表征
图1所示为前驱体产物的XRD测试。由图1可见:3 种前驱体均呈现出相似的衍射峰,在2θ为11.44°,22.97°,35.39°,38.68°,46.29°,59.91°和62.70°处分别出现了类水滑石(003),(006),(012),(015),(018),(110)和(113)晶面的衍射峰,说明成功制备Ni(Mn,Cu)Fe-LDHs;同时,伴随着过渡金属的掺杂,前驱体的结晶度发生变化,相比于NiFe-LDH,Mn 和Cu 掺杂后得到NiMnFe-LDH 和NiCuFe-LDH峰形更尖锐,结晶度更高。

图1 前驱体的XRD图Fig.1 XRD patterns of precursors
图2所示为制备所得前驱体的红外谱图。由图2 可知:3 种前驱体均在3 430,1 630,1 370 和722 cm-1处存在吸收峰。其中位于3 430 cm-1附近的宽吸收峰与氢键—OH 以及层间水分子的—OH伸缩振动有关,1 630 cm-1左右的尖锐吸收峰归因于结晶水中—OH的弯曲振动,1 370 cm-1处出现的尖峰为CO32-的振动吸收峰,而在722 cm-1处的吸收峰归因于M—O (M—OH,M—O—M 或O—M—O)的振动[13]。红外表征结果进一步证实了NiFe-LDH,NiMnFe-LDH和NiCuFe-LDH前驱体的成功制备。
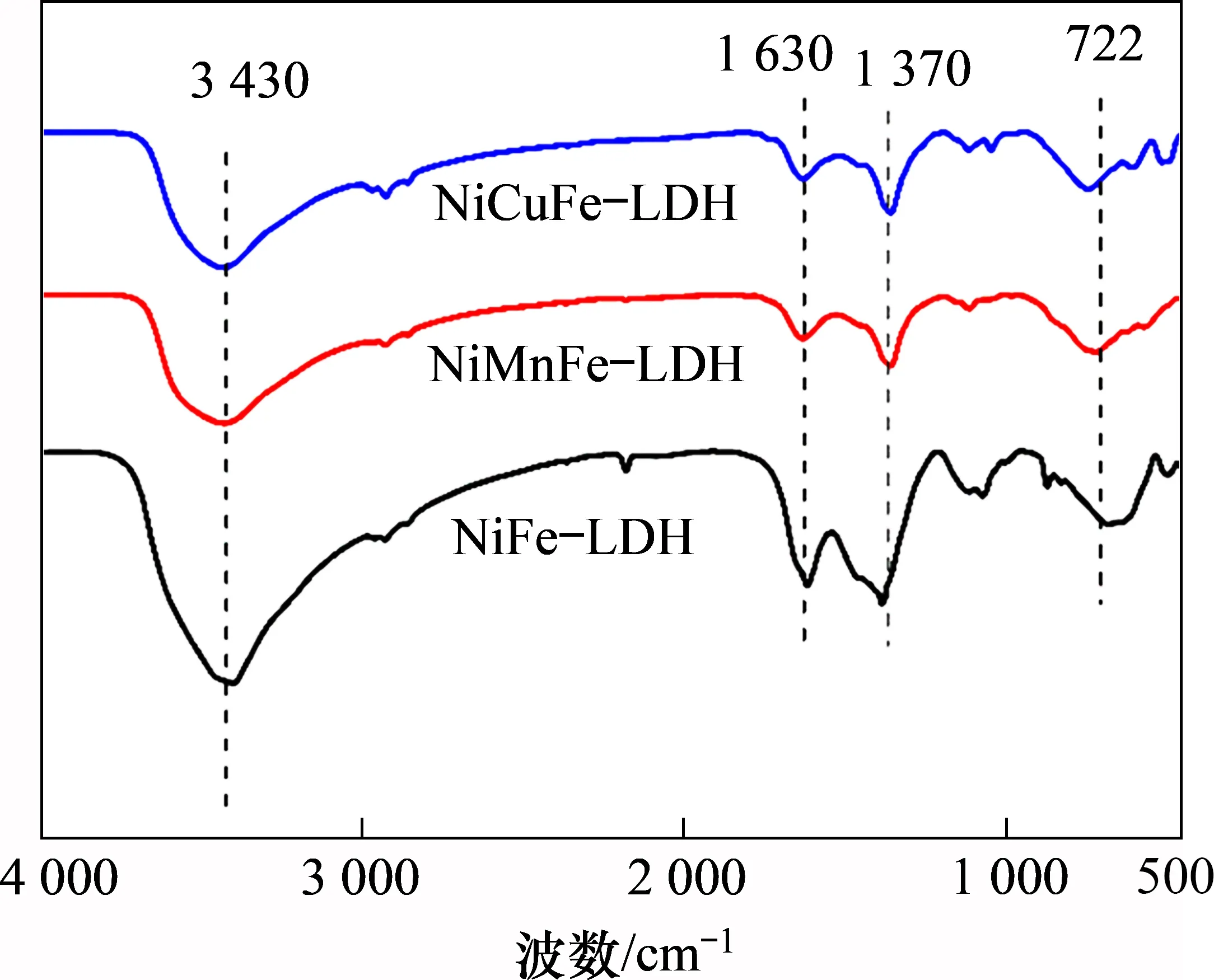
图2 前驱体的红外谱图Fig.2 FT-IR spectra of precursors
3 Ni(Mn,Cu)Fe-LDO催化剂表征
3.1 XRD图分析
图3 所示为金属Mn 和Cu 掺杂制备的Ni(Mn,Cu)Fe-LDHs 前驱体在500 ℃焙烧后得到的Ni(Mn,Cu)Fe-LDO催化剂的XRD图。由图3可见:3种催化剂呈现了不同的物相组成;NiFe-LDO 催化剂的物相组成为NiO 和NiFe2O4尖晶石;在NiMnFe-LDO催化剂中,Mn掺杂减少了NiFe2O4尖晶石相,其物相组成主要为NiO 和Ni6MnO8;而在NiCuFe-LDO 催化剂中,不仅存在NiO 和NiFe2O4尖晶石相,而且出现了新的CuO物相。
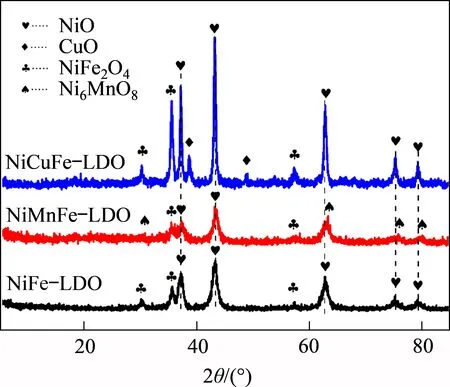
图3 Ni(Mn,Cu)Fe-LDO催化剂的XRD图Fig.3 XRD patterns of Ni(Mn,Cu)Fe-LDO catalysts
3.2 N2-吸附脱附分析
图4所示为Ni(Mn,Cu)Fe-LDO催化剂的N2-吸附脱附等温线和孔径分布,表1所示为Ni(Mn,Cu)Fe-LDO 催化剂的比表面积和孔结构参数。由图4(a)可知:NiFe-LDO和NiMnFe-LDO催化剂的吸附脱附等温线为IV型,滞后环为H2型,结合图4(b)及表1可知这2种催化剂均为介孔材料,且其孔径分布较为均匀;而NiCuFe-LDO催化剂的吸附脱附等温线为IV型,滞后环为H3型,根据图4(b)和表1推测该催化剂应该既有介孔也有大孔。
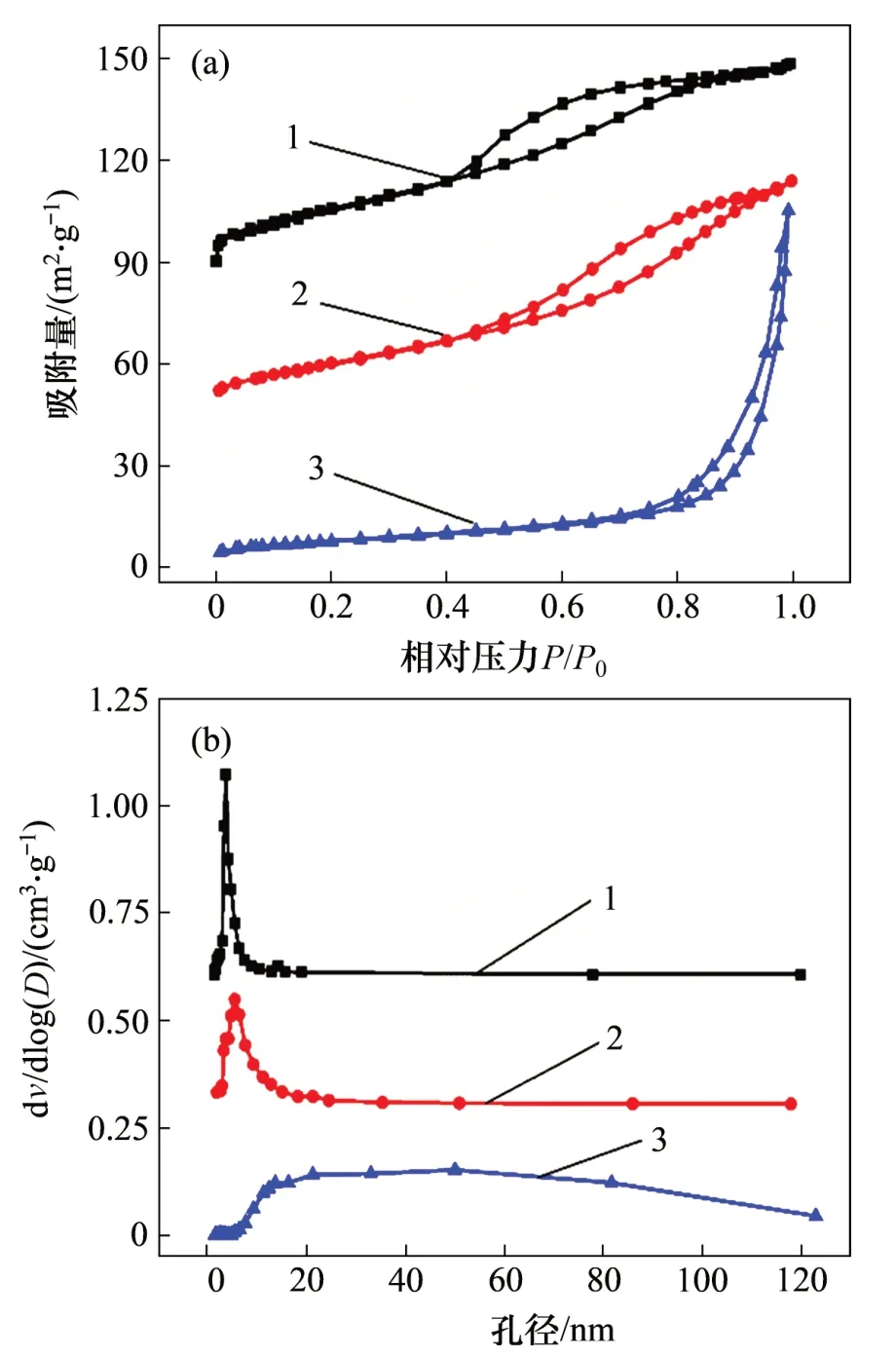
图4 Ni(Mn,Cu)Fe-LDO催化剂的N2-吸附脱附等温线和孔径分布图Fig.4 N2-adsorption desorption isotherms and pore size distribution of Ni(Mn,Cu)Fe-LDO catalysts
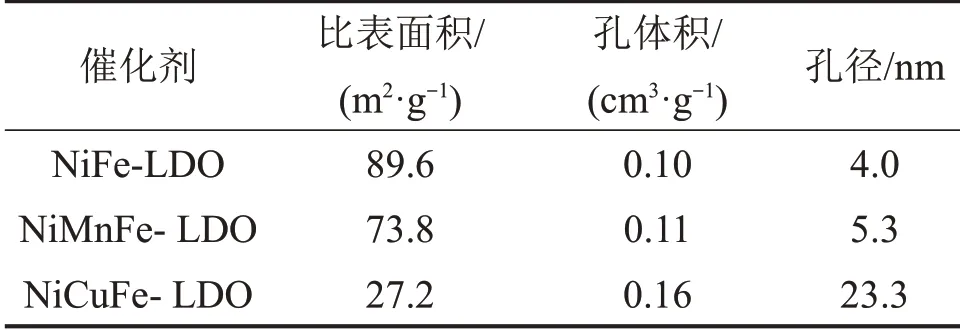
表1 Ni(Mn,Cu)Fe-LDO催化剂的比表面积与孔结构参数Table 1 Specific surface area and pore structure parameters of Ni(Mn,Cu)Fe-LDO catalysts
由表1 可知:相比于NiFe-LDO 的比表面积,Ni(Mn,Cu)Fe-LDO的比表面积均有一定程度减小,其中,NiCuFe-LDO催化剂的比表面积更小;相比于NiCuFe-LDO 催化剂,NiFe-LDO 和NiMnFe-LDO 催化剂具有较大的比表面积,可提供更多的吸附位点,促进催化反应。
3.3 NH3-TPD和NO+O2-TPD图分析
图5(a)所示为Ni(Mn, Cu)Fe-LDO 催化剂的NH3-TPD 图,表2 所 示为Ni(Mn, Cu)Fe-LDO 催化剂对应酸性位点比例(借助Origin 拟合峰面积计算酸性位点数量并用归一化法计算)。由图5(a)可见:相 比 于NiCuFe-LDO 催 化 剂, NiFe-LDO 和NiMnFe-LDO催化剂的NH3脱附峰更明显。在低温段(100~300 ℃)的脱附峰为吸附在Lewis 酸性位上NH3的脱附以及吸附在Brønsted酸性位上的NH4+的脱附[14],在高温段(300~600 ℃)的脱附峰为强Lewis和Brønsted 酸位上的化学吸附氨[15]。对于NiFe-LDO 和NiMnFe-LDO 催化剂,低温段第1 个脱附峰位置相差不大。而在高温段,NiFe-LDO 催化剂脱附峰的位置为471 ℃,NiMnFe-LDO催化剂脱附峰的位置为446 ℃。结合表2 可知,3 种催化剂的表面酸量由高到低依次为NiFe-LDO,NiMnFe-LDO 和NiCuFe-LDO,随着Mn 和Cu 掺杂进入NiFe-LDO,其弱酸量与强酸量均有不同程度变化。其中,NiMnFe-LDO 催化剂的弱酸位比例明显增大,这预示着NiMnFe-LDO 催化剂可能有更加优异的低温活性。
图5(b)所示为Ni(Mn, Cu)Fe-LDO 催化剂的NO+O2-TPD图,反映了催化剂对NOx的吸附能力。250°C 以下的脱附峰对应于吸附在催化剂表面的单齿硝酸盐的脱附,而250°C 以上的脱附峰则对应于桥式硝酸盐及双齿硝酸盐的分解。单齿硝酸盐的产生对SCR 性能有利,而且吸附量越大,越有利于反应物参与反应[16]。
结合NH3-TPD 的结果初步推断类水滑石衍生催化剂的脱硝机理如下:低温下(<350°C),3种催化剂既能够吸附NH3也能够吸附NOx,2 种反应物共同吸附在催化剂表面的活性位点上并转化为活性中间体,随后相邻近的中间体发生反应,生成N2和H2O,属于双分子反应机理,即L-H机理。高温下(>350°C),NiFe-LDO 催化剂既能够吸附NH3也能够吸附NOx,属于双分子反应机理,即L-H机理。而NiMnFe-LDO和NiCuFe-LDO催化剂只能吸附NH3,属于单分子反应机理,即E-R机理。

图5 Ni(Mn,Cu)Fe-LDO催化剂的TPD图Fig.5 TPD profiles of Ni(Mn,Cu)Fe-LDO catalysts

表2 Ni(Mn,Cu)Fe-LDO催化剂的NH3脱附量和酸性位比例Table 2 Amount of NH3 desorption and proportion of acid sites of the Ni(Mn,Cu)Fe-LDO catalysts
3.4 H2-TPR图分析
图6 所示为Ni(Mn, Cu)Fe-LDO 催化剂的H2-TPR 图。由图6 可知:对于NiFe-LDO 催化剂,曲线呈现出2个还原峰,其中,位于355 ℃左右的还原峰为Fe3+→Fe2+或Ni3+→Ni2+,而位于436 ℃附近的还原峰为Ni2+→Ni0[17-18]。过渡金属Mn和Cu掺杂后,还原峰的个数增加。NiMnFe-LDO催化剂呈现出3个还原峰,还原峰的出峰位置分别为229,387和487 ℃左右,依次可以归属于Mn4+→Mn3+,Mn3+→Mn2+或Fe3+→Fe2+或Ni3+→Ni2+和Ni2+→Ni0的还原过程[6,19-20]。而NiCuFe-LDO 曲线中出现了4 个还原峰,分别位于300,373,466 和625 ℃附近。还原峰的出现与Cu2+/Cu+→Cu0,Fe3+→Fe2+或Ni3+→Ni2+以及Ni2+→Ni0过程有关。值得注意的是,NiMnFe-LDO 催化剂的初始还原峰温度明显低于NiFe-LDO 和NiCuFe-LDO 催化剂,较低的还原温度说明NiMnFe-LDO 催化剂表面物种更易被还原,具有更加优异的氧化还原性能。

图6 Ni(Mn,Cu)Fe-LDO催化剂的H2-TPR图Fig.6 H2-TPR profiles of the Ni(Mn,Cu)Fe-LDO catalysts
3.5 XPS图分析
图7 所示为Ni(Mn, Cu)Fe-LDO 催化剂的XPS图。利用XPS Peak 4.1软件对其能谱图进行分峰拟合,同时根据其峰面积计算出其表面离子相对含量,所得催化剂表面化学价态分布如表3所示。由图7(a)可见:Ni 2p3/2谱图可观察到3 个特征峰,分别位于854.6,856.0~856.2 和860.4~861.3 eV,依次可归属于Ni2+,Ni3+特征峰和卫星峰[21]。采用同样的方法对Fe 2p3/2,Mn 2p3/2和Cu 2p3/2进行分峰拟合,结果如图7(b)~(d)所示。很明显,NiCuFe-LDO 催化剂表面Cu2+含量远高于Cu+含量,NiFe-LDO 和NiCuFe-LDO 催化剂表面都含有更多Ni3+,而NiMnFe-LDO催化剂中Ni3+含量相对较低,但其表面Mn4+含量高达48.7%,推测可能与该催化剂表面发生Mn3++Ni3+↔Mn4++Ni2+反应有关,NiMnFe-LDO催化剂表面大量高氧化态锰(Mn4+)会导致其具有更好的氧化还原性能[22-23]。
由表3可见:相较于NiFe-LDO催化剂,经Mn和Cu 掺杂后衍生所得催化剂表面Fe3+含量均呈现升高的趋势,NiCuFe-LDO 催化剂中含有NiFe2O4尖晶石相,Cu掺杂后其表面Ni3+含量减少而Fe3+含量升高可能与NiFe2O4尖晶石上存在Ni和Fe元素间的氧化还原反应(Ni3++Fe2+↔Ni2++Fe3+)有关;通过相应特征峰面积比值计算的催化剂表面Oα与(Oα+Oβ)含量之比说明,金属掺杂合成的Ni(Mn,Cu)Fe-LDO 催化剂相较于NiFe-LDO 其Oα(表面氧)含量明显降低,这可能是由于NiFe2O4尖晶石中氧原子排列方式为立方紧密堆积,金属离子位于部分四面体和八面体空隙中,因此,存在该氧化物较多的表面氧空位以及金属离子交换的可能性[24]。结合XRD表征,Mn和Cu离子的掺杂引起Ni基尖晶石相及结晶度发生了变化,这可能导致部分表面吸附氧向晶格氧转移而引起表面氧含量降低[25-26]。
4 讨论
4.1 催化剂NH3-SCR催化性能
所有催化剂的活性测试均在固定床气态反应装置上进行,反应混合气组成为体积分数φ(NO)=φ(NH3)=0.06%(φ为体积分数)φ(O2)=5%(φ(H2O)=10%,φ(SO2)=0.01%抗H2O/SO2测试),N2为平衡气,石英反应管的直径为6 mm,催化剂用量为0.35 g (250~380 μm),气体空速(gas hourly space velocity,GHSV)为45 000~75 000 h-1,程序升温速率设置为3°C/min,测试温度为120~420°C。每隔30°C 记录1 组数据,待气体浓度稳定后,由红外烟气检测仪(Thermofisher IS10)分析固定床反应器进出口气体组分及浓度。本文中NO 的转化率η(NO)和N2选择性η(N2)按下式计算:
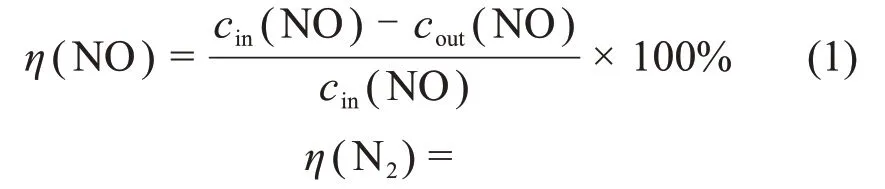
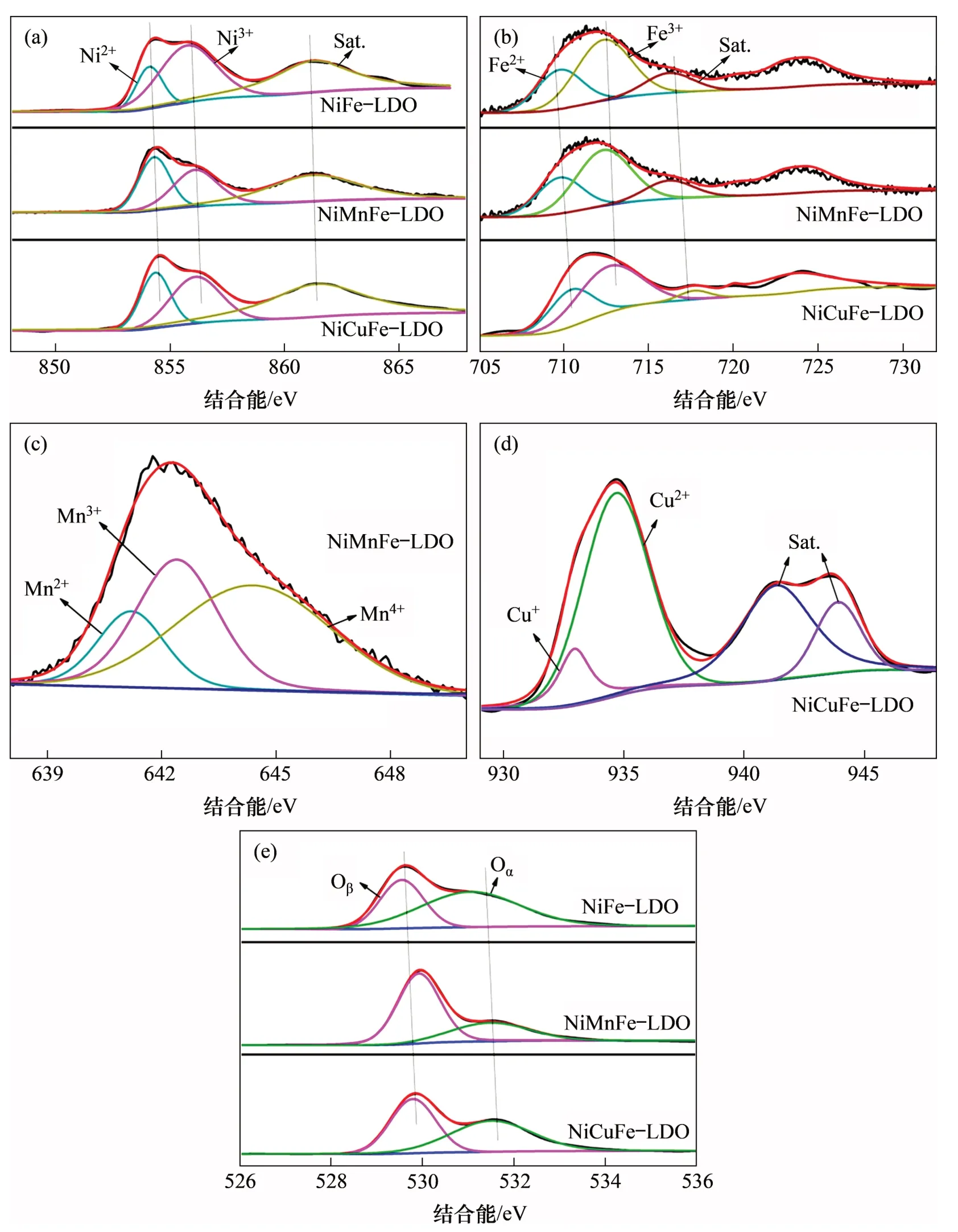
图7 Ni(Mn,Cu)Fe-LDO催化剂的XPS图Fig.7 XPS spectra of the Ni(Mn,Cu)Fe-LDO catalysts
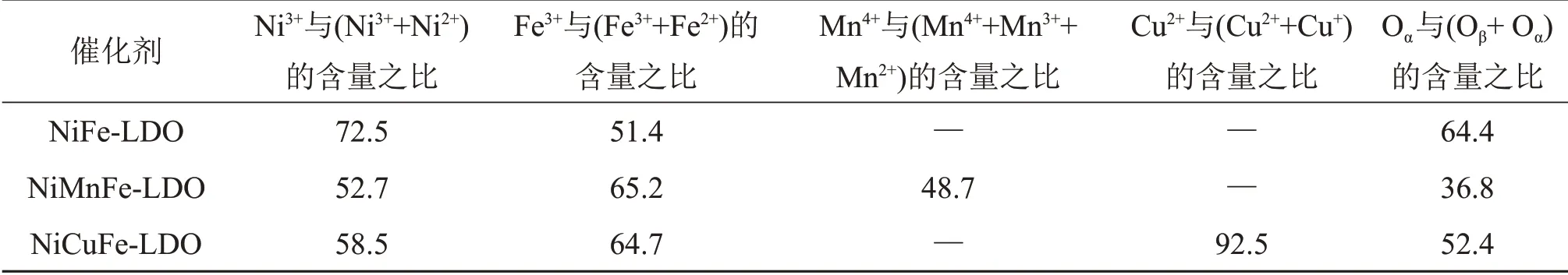
表3 Ni(Mn,Cu)Fe-LDO催化剂表面元素价态分布Table 3 Valence distribution of elements on the surface of Ni(Mn,Cu)Fe-LDO catalysts %
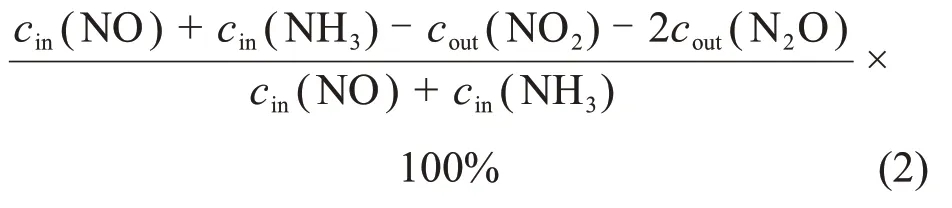
式中:cin(NO)和cin(NH3)分别为反应器入口处的NO和NH3浓度;cout(NO),cout(NO2)和cout(N2O)分别为反应器出口处NO,NO2和N2O的浓度。
图8 所示为金属掺杂制备的Ni(Mn, Cu)Fe-LDO催化剂的催化性能测试图。由图8(a)可见:过渡金属Mn 和Cu 掺杂NiFe-LDH 衍生制得的NiMnFe-LDO和NiCuFe-LDO催化剂的低温脱硝活性相较于NiFe-LDO催化剂均有一定幅度提升,而且活性温度窗口均得到拓宽,Mn 掺杂对NiFe-LDO 催化剂的低温活性提升幅度明显比Cu 掺杂的高。NiMnFe-LDO催化剂拥有更宽的活性温度窗口(150~360 ℃),其在反应温度为150 ℃时,NO转化率已达90%,当反应温度为180 ℃时,该催化剂NO 转化率接近99%。NiMnFe-LDO 催化剂优异的低温脱硝性能与NiMnFe-LDO 催化剂表面物种更易被还原,Ni3+和Mn3+间的电子转移加速了氧化还原循环有关,此外,NiMnFe-LDO催化剂更宽的温度窗口(150~360 ℃)还与催化剂中酸性位比例较为合理且弱酸位比例较大紧密相关。
由图8(b)可见:在120~270 ℃,各催化剂的N2选择性差别不大;当反应温度超过300 ℃时,NiFe-LDO 和NiMnFe-LDO 催化剂仍然保持较高的N2选择性,而NiCuFe-LDO 催化剂的N2选择性出现轻微下降。这是由于Ni3+和Mn3+之间存在电子转移,在一定程度上调节了Mn氧化物过强的氧化能力,因此,NiMnFe-LDO 催化剂的N2选择性要比NiCuFe-LDO催化剂的略高。
4.2 催化剂动力学评价
根据SCR 反应中NOx转化率为5%~20%之间数据测定催化剂表观活化能(Ea),计算速率常数和表面活化能公式如下:

式中:k为反应速率常数,cm3/(g·s);V为体积流量,cm3/s;W为催化剂质量,g;Ea为表观活化能,kJ/mol;R为摩尔气体常数,J/(mol·K);T为热力学温度,K;A为指前因子,cm3/(g·s)。NH3-SCR 反应中NO 的反应级数为1,NH3的反应级数为0。
据阿仑尼乌斯公式可知:如以lnk对1/T作图,直线的斜率为-Ea/R,这样通过作图求解不同催化剂在SCR反应中的表观活化能(Ea)。图9所示为Ni(Mn,Cu)Fe-LDO催化剂反应活化能求解图。由图9可见:在测试的温度范围内(120~240 ℃),NiMnFe-LDO(53.85 kJ/mol)表观活化能(Ea)最小,其次是NiCuFe-LDO(77.77 kJ/mol) 和NiFe-LDO(89.96 kJ/mol),这与3种催化剂的低温脱硝性能相一致。
4.3 优选催化剂的性能
4.3.1 不同空速下的催化性能

图8 Ni(Mn,Cu)Fe-LDO催化剂的催化性能Fig.8 Catalytic performance of Ni(Mn,Cu)Fe-LDO catalysts
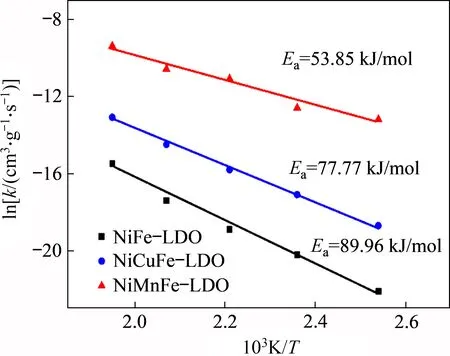
图9 Ni(Mn,Cu)Fe-LDO催化剂反应活化能求解图Fig.9 Calculation chart of reaction activation energy of the Ni(Mn,Cu)Fe-LDO catalysts

图10 不同空速下NiMnFe-LDO催化剂的催化性能Fig.10 Catalytic performance of NiMnFe-LDO catalyst at different GHSV
图10 所示为优选出的NiMnFe-LDO 催化剂在不同空速条件下所对应的NH3-SCR 活性。由图10可见:随着空速增加,NiMnFe-LDO催化剂的脱硝活性略有降低,但总体趋势变化不大,该催化剂在较高空速下依然保持着比较高的NO转化率和N2选择性。在实验范围内,空速变化对NiMnFe-LDO催化剂的脱硝性能影响不大,该催化剂表现出较好的空速适应性。
4.3.2 优选催化剂的抗水抗硫性能
在实际生产实践中,烟气中可能会存在一定体积分数的SO2,因此,对优选出的NiMnFe-LDO催化剂进行抗水抗硫性能测试显得尤为重要。图11 所示为优选催化剂NiMnFe-LDO 在210 ℃,45 000 h-1空速下进行50 h 抗H2O/SO2测试的结果。首先,当通入体积分数为0.01%的SO2后,测试在10 h内NO转化率变化趋势,发现催化剂的脱硝活性仍然保持在较高水平;然后,当通入体积分数为10%的H2O后,NO转化率呈现出明显下降趋势(从97%下降到93%);将SO2气体切断后,NO 转化率略有提高,但仍达不到初始状态时的值;最后,将通入的体积分数为10% H2O 切断,催化活性显著提升,大致可恢复到初始NO转化率。由此可见:NiMnFe-LDO催化剂在该实验条件下表现出良好的抗H2O/SO2性能。

图11 NiMnFe-LDO催化剂的抗水抗硫性能测试Fig.11 H2O and SO2 resistance test of NiMnFe-LDO catalyst
5 结论
1)在NiFe-LDH层板上原位引入协同功能组分Mn 和Cu 后,衍生构筑的Ni(Mn,Cu)Fe-LDO 催化剂的比表面积、物相组成及表面组分含量等发生了一定改变,其氧化还原性和酸碱性得到优化。
2) NiMnFe-LDO 催化剂具有更优异的低温脱硝性能,150 ℃时NO 转化率可达90%,180 ℃时NO 转化率接近99%;在150~360 ℃活性温窗范围内,催化剂的N2选择性均可以稳定在96%以上。其优异的低温脱硝活性与Ni3+和Mn3+间的电子转移加速氧化还原循环直接相关。
3) 优选催化剂NiMnFe-LDO 在实验范围内对空速变化呈现出较强的适应性,同时具有较好的抗水抗硫性能。

