冷熏对高白鲑理化性质及肌球蛋白构象的影响
李 新,汪 兰,石 柳,吴文锦,丁安子,熊光权
冷熏对高白鲑理化性质及肌球蛋白构象的影响
李 新,汪 兰,石 柳,吴文锦,丁安子,熊光权※
(湖北省农业科学院农产品加工与核农技术研究所/湖北省农业科技创新中心,武汉 430064)
以新疆塞里木湖高白鲑为研究对象,研究冷烟熏过程对鱼肉理化性质及肌球蛋白构象的影响。冷熏温度为(20±2)℃,发烟温度140 ℃,冷熏时间分别为0、6、12、18、24 h,研究冷熏鱼肉理化性质(含水率、水分活度、色泽、质构特性、TVB-N)及肌球蛋白构象(蛋白浓度、总巯基含量、Ca2+-ATPase、表面疏水性)变化。研究结果表明,冷熏0~24 h,鱼肉含水率由75.75%下降至53.03%,水分活度(Aw)由0.988下降至0.952;鱼肉亮度值(*)显著降低(<0.05),红度值(*)缓慢增加,黄度值(*)显著增加(<0.05);表征鱼肉质构特性的剪切力与韧性均呈明显上升趋势(<0.05);鱼肉挥发性盐基氮(TVB-N)由9.81上升至14.23 mg/100g;肌球蛋白浓度、总巯基含量、Ca2+-ATPase活性均显著降低(<0.05),表面疏水性增加(<0.05);综上,控制冷熏时间12~18 h有利于提高冷熏鱼肉品质,降低鱼肉肌球蛋白变性与氧化程度。该研究为特色淡水鱼冷熏制品开发与烟熏过程中蛋白氧化调控提供理论依据与技术参考。
鱼;理化性质;蛋白质;高白鲑;冷熏;肌球蛋白
0 引 言
高白鲑(),为鲑科、白鲑属其中一种,是一种高好氧冷水性鱼类[1]。1998年开始新疆从俄罗斯引种,经过多年繁育,高白鲑已具备产业化生产的规模[2]。高白鲑鱼肉蛋白质、脂肪、必需氨基酸含量远高于大宗鱼类,是一种营养价值高可生鲜食用特色淡水鱼[3]。目前高白鲑主要通过冷藏和冷冻2种方式储运,高白鲑在冷藏温度下货架期非常短,而冻结解冻后鱼肉质地软烂,导致商品价值急剧降低,因此探寻和开发新型保鲜方法与加工制品具有重要的意义。
烟熏技术是一种肉类传统的保藏方法。熏烟中主要包含酚类、醇类、羰基类化合物以及有机酸、烃类等,这些化合物渗透至肌肉内部,赋予肉品特有的色泽和风味,另外熏烟中化合物具有抑菌和抗氧化作用,可以有效延长肉品货架期[4-5]。冷熏技术在低于30℃条件下通过果木不完全燃烧产生的熏烟进行熏制,最大程度保留了肉品的营养价值与食用品质,是烟熏技术发展方向[6-7]。
肌肉蛋白在加工过程中受到温度、光照、pH值、离子强度等因素影响发生改变,导致多肽链断裂,氨基酸侧链损伤,二级结构变化和形成大分子交联聚合体等,主要表现在蛋白总羰基、巯基、各类二级结构改变[8]。肌球蛋白是肌肉中的主要蛋白,对肉制品质构、赋形、保水性和保留其他成分有重要意义。在肌肉加工过程中,不同的加工工艺参数都会引起肌球蛋白氧化变性,大部分研究主要集中于不同热处理温度对肌球蛋白性质的影响,而关于烟熏加工过程中肌球蛋白氧化变性规律鲜见报道[9]。本文以高白鲑为研究对象,重点研究冷熏时间对鱼肉理化性质的影响,为开发高品质高白鲑烟熏制品提供技术参考;另外研究冷熏时间对鱼肉肌球蛋白构象的影响,为探讨冷熏工艺对蛋白质氧化变性影响提供理论依据。
1 材料与方法
1.1 试验材料
冷冻高白鲑由新疆赛湖渔业科技开发有限公司提供(捕捞后新鲜高白鲑,去鳞、去内脏、去腮,平均质量1 000 g/条,平均体长40 cm/条,-18℃冻藏15 d),于4 ℃条件下自然解冻。取脊背整块肌肉部分,且去除鱼皮。置于烟熏箱中进行熏制,箱温设定20 ℃,温差设定2 ℃,发烟参数140 ℃,木屑电机工作间歇时间10 s,熏制时间分别为0、6、12、18和24 h,熏制0 h即为空白对照组。
1.2 试验试剂与仪器
BYXX-II烟熏箱,嘉兴艾博实业有限公司;LabStart水分活度仪,瑞士NOVASINA公司;970CRT/XP荧光分光光度计,上海仪电分析仪器有限公司;TU-1810PC紫外可见分光光度计,北京普析通用仪器有限责任公司;CR-400色差仪,柯尼卡美能达(中国)投资有限公;TA-XTPlus质构仪,英国Stable Micro System公司;GL-25MS 高速冷冻离心机,上海卢湘仪离心机仪器有限公司;AL104分析天平、PL602-L分析天平,梅特勒-托利多上海有限公司。
五水硫酸铜、酒石酸钾纳、氢氧化钠、氯化钾、叠氮化钠、Tris、盐酸、硼酸、三氯乙酸、甲基红、溴甲酚、-巯基乙醇、醋酸镁、乙二醇双四乙酸(EGTA)、三磷酸腺苷二纳、碳酸氢钾、氯化镁、马来酸、乙二胺四乙酸(EDTA)、牛血清蛋白等均为AR级,采购于国药集团化学试剂有限公司。
1.3 试验方法
1.3.1 含水率测定
参照食品安全国家标准《食品中水分的测定》[10]。
1.3.2 Aw测定
鱼肉搅碎后均匀放入水分活度仪测定盒子中,测定温度25 ℃,每组5份样品,取平均值。
1.3.3 色泽测定
取鱼肉内部肌肉样,用滤纸吸附表面水分油脂,采用便携式色差计测定*(亮度)、*(红度)和*(黄度)值,以标准空白版校正,每组5份样品,取平均值。
1.3.4 质构测定
鱼肉分割切成2 cm×2 cm×2 cm大小相同的块状,采用质构仪 A/CKB 探头下进行剪切力、韧性的测定,测前速率 5.0 mm/s,测中速率1.0 mm/s,测后速率5.0 mm/s,每组5份样品,取平均值。
1.3.5 TVB-N测定
参照食品安全国家标准《食品中挥发性盐基氮的测定》[11]。
1.3.6 肌球蛋白提取与浓度测定
溶液A:0.1mol/L KCl,0.02% NaN3,20 mmol/L Tris-HCl(pH值7.5)。
溶液B:0.45 mol/L KCl,5 mmol/L-巯基乙醇,0.2 mol/L醋酸镁,1 mmol/L EGTA,20 mmol/L Tris-HCl(pH值6.8)。
溶液C:0.5 mol/L KCl,5 mmol/L-巯基乙醇,20 mmol/LTris-HCl(pH值7.5)。
搅碎后鱼肉中加入预冷过的10倍体积的溶液A,并用高速分散均质机23 000 r/min均质1 min,5 ℃静置15 min,4 000 r/min离心5 min,取沉淀加入5倍体积溶液B,搅拌制成悬浮液,同时缓缓加入ATP-Na2使肌球蛋白与肌动蛋白解离,ATP-Na2最终浓度为5 mmol/L,均质30 s使其混匀,5 ℃静置1 h,10 000 r/min离心10 min,上清液用5倍体积1 mmol/L KHCO3稀释,5 ℃静置2 h,10 000 r/min离心15 min,沉淀用2.5倍体积溶液C悬浮,5 ℃静置10 min,用2.5倍体积1 mmol/L KHCO3稀释并加MgCl2至终浓度为10 mmol/L,均质30 s使其混匀,5 ℃放置过夜,10 000 r/min离心25 min,沉淀为肌球蛋白,用20 mmol/L Tris-马来酸缓冲液溶解备用。
采用双缩脲法测定蛋白浓度,准确称取0.5 g牛血清蛋白(BSA),用生理盐水溶解后定容至100,即为溶度为5 mg/mL的标准蛋白质溶液。取6支25 mL具塞比色管,分别加入5 mg/mL标准蛋白溶液0.0、0.2 、0.4、0.6、0.8、1.0 mL,加蒸馏水至1.0 mL,加入双缩脲试剂4 mL,用水稀释至10 mL,摇匀,在室温下放置30 min后,于560 nm处测定每管吸光值,然后以蛋白质浓度为横坐标,吸光值为纵坐标如图1。
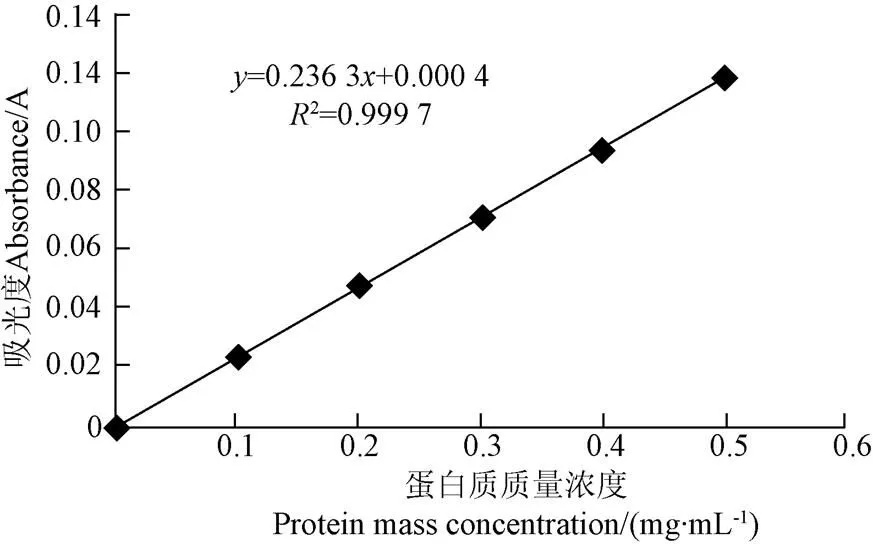
图1 蛋白质标准曲线
1.3.7 总巯基含量测定
参照You 等[12]的方法并稍加修改。取1 mL肌球蛋白样品溶液(0.4%),加入9 mL 0.2 mol/L Tris-HCl(其中含8 mol/L尿素,10 mmol/L EDTA,2%SDS,pH值7.0)缓冲液,混匀后在室温下放置30 min,取4 mL,加入0.4 mL 0.1% DTNB(Tris-HCl,pH值为8.0);在40 ℃反应25 min后,测定412 nm处的吸光值,以0.2M PBS为空白对照。计算公式如下
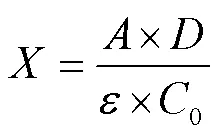
式中为总巯基摩尔浓度,mol/g;0为蛋白质浓度,mg/mL;为412 nm 处的吸光值;为稀释倍数;为摩尔消光系数,13 600 L/(mol·cm)。
1.3.8 Ca2+-ATPase测定
根据Wang 等[13]方法并稍加修改。将肌球蛋白浓度调节至4 mg/mL,在离心管中依次加入0.20 mL 0.50 mol/L Tris-马来酸(pH值为7.0)、0.20 mL 0.10 mol/L CaCl2,0.40 mL肌球蛋白溶液,3.00 mLH2O,置于25 ℃的水浴中,最后加入0.20 mL20 mmol/L ATP(pH值为7.0),反应开始。在反应进行3 min后,加入2 mL15%TCA停止反应,10 000 g离心2 min,取上清液备用。空白先加入TCA,后加入ATP。取上述离心液4 mL加入3 mL Tris-MgCl2缓冲液(pH值为7.5),混合均匀加入3 mL定磷试剂(20%抗坏血酸:3 mol/L H2SO4:3%钼酸胺等体积混合),在45 ℃恒温水浴发色30 min,在640 nm测定吸光度。ATPase活性的表示方法为1 mg蛋白在1 min内生成的无机磷酸量。
1.3.9 表面疏水性测定
参照You 等[12]方法。用双缩脲法测定蛋白浓度,采用缓冲溶液(0.6 mol KCl-20 mmol Tris-马来酸,pH值为7.0)稀释至浓度分别为0.1、0.2、0.3和0.5 mg/mL浓度的蛋白溶液。分别取上述蛋白溶液2 mL加10L ANS溶液(8 mmol/L,溶解在0.1 mol/L pH值为7.0 PBS溶液中)。混匀后采用荧光光谱仪测定,操作条件为:激发波长为385 nm,扫描范围400~700 nm,扫描速度500 nm/min,激发狭缝和发射狭缝宽均为3 nm,响应时间为0.1 s,记录470 nm波长处的荧光发射强度FI′,并测定不加ANS的蛋白溶液荧光强度(FI0),FI′与FI0的差值记为FI,以蛋白浓度为横坐标,FI为纵坐标作图,曲线初始段的斜率即为蛋白质分子的表面疏水性指数0。
1.4 数据处理
试验所得数据均用平均值±标准偏差表示,采用SAS分析软件检验组间差异显著性(<0.05)。
2 结果与讨论
2.1 冷熏对鱼肉含水率与水分活度的影响
表1表示不同冷熏时间鱼肉含水率与水分活度,结果表明,新鲜鱼肉含水率较高,达到75.75%,冷熏过程中,鱼肉含水率不断下降,其中冷熏18 h,鱼肉含水率显著降低(<0.05),冷熏18~24 h,鱼肉含水率无显著性变化。鱼肉水分活度随冷熏时间延长而降低(<0.05)。冷熏鱼肉水分活度与含水率呈正相关,即水分活度随含水率降低而降低,然而冷熏过程中鱼肉水分活度均高于0.950,由此可以推断,水分活度对于冷熏鱼肉货架期的延长不是主要因素。
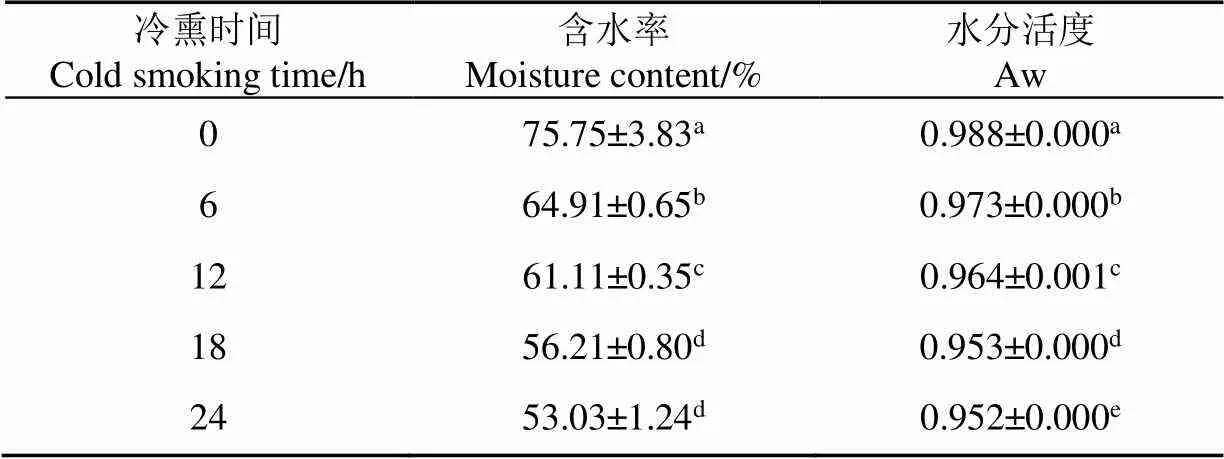
表1 不同冷熏时间鱼肉含水率与水分活度(n=5)
注:不同字母表示差异显著(<0.05),下同。
Note: Different letters indicate significant difference at 0.05 level, the same as following.
2.2 冷熏对鱼肉色泽的影响
表2结果表明,新鲜鱼肉亮度值(*)、红度值(*)、黄度值(*)分别为58.64、−0.80、3.00,呈现一种亮白色,随着冷熏时间延长,鱼肉亮度值显著降低(<0.05),红度值呈缓慢增加趋势,黄度值显著增加(<0.05),熏制24 h,鱼肉呈现一种黄褐色。熏制过程中,熏烟中酚类、醛酮类、酸类等有机化合物附着渗透作用使鱼肉色泽发生改变。另外,鱼肉色泽指标变化与肌肉中含水率与分布改变存在相关性[14-15]。鱼肉色泽褐变与肌红蛋白氧化与脂肪氧化有关,还原型肌红蛋白氧化生成高铁肌红蛋白,而脂肪氧化产生的自由基破坏鱼肉中色素,2者之间具有相互促进作用,使鱼肉色泽向褐色转变[16]。因此鱼肉在冷熏过程中色泽的改变是基于熏烟的附着渗透、含水率与分布状态改变以及肌红蛋白与脂肪氧化的综合效应。
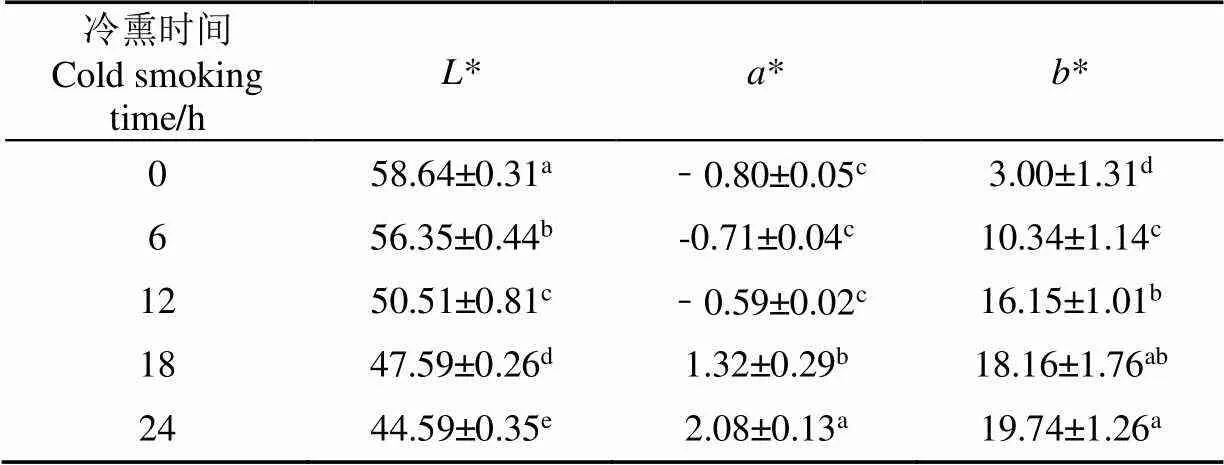
表2 色泽随冷熏时间变化(n=5)
2.3 冷熏对鱼肉质构特性的影响
鱼肉剪切力、韧性指标关系到肌肉组织嫩度和粗糙度,反应肌肉内部组织的紧密程度。冷熏过程中鱼肉剪切力、韧性变化见图2,由图2所示,随着冷熏时间延长,鱼肉剪切力呈线性平缓增加趋势,冷熏18 h,鱼肉韧性缓慢增加,18 h以后,鱼肉韧性显著增加。鱼肉剪切力、韧性增加与烟熏期间鱼肉含水率降低有关,另外肌肉蛋白氧化形成蛋白聚合物也会使鱼肉质构特性发生改变[17-19]。
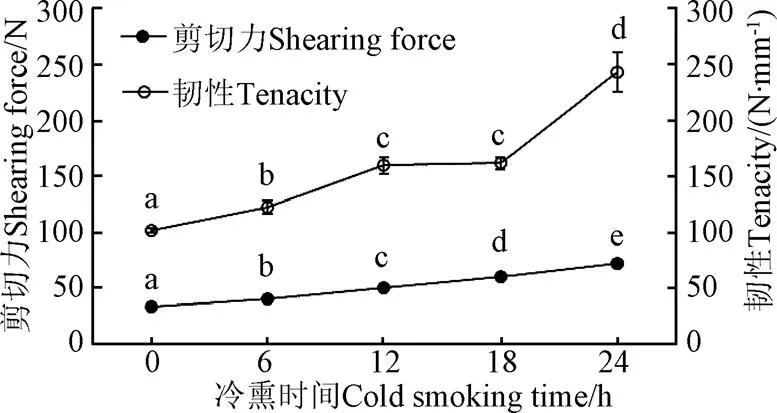
图2 剪切力、韧性随冷熏时间变化(n=5)
2.4 冷熏对鱼肉TVB-N的影响
挥发性盐基氮(TVB-N)是水产品新鲜度评价的重要理化指标,反映内源性酶和微生物的作用分解蛋白质及其非蛋白类物质产生的具有挥发性的氨、二甲胺和三甲胺等的程度[20]。由图3所示,新鲜鱼肉TVB-N为9.81 mg/100 g,随着冷熏时间延长,TVB-N缓慢增加,冷熏24 h,鱼肉TVB-N为14.23 mg/100 g,符合食品安全国家标准鲜、冻动物性水产品(GB 2733-2015)规定的淡水鱼TVB-N≤20 mg/100 g[21]。由此可以推断,冷熏过程保持熏制低温环境,熏烟中化合物可以有效抑制微生物生长,减少挥发性氨类物质产生,从而有效保持鱼肉新鲜度。
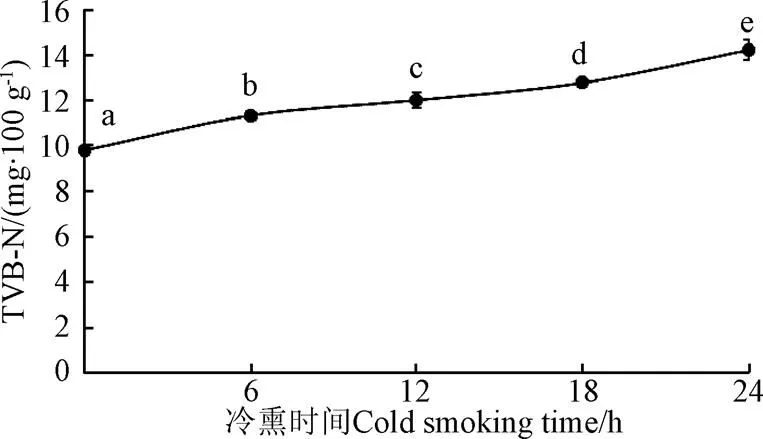
图3 TVB-N随冷熏时间变化(n=5)
2.5 冷熏对鱼肉肌球蛋白浓度的影响
鱼肉中蛋白质根据溶解性大致分为水溶性蛋白、盐溶性蛋白和不溶性蛋白,肌球蛋白是盐溶性蛋白,是各类肌细胞中含量最多的结构蛋白和收缩蛋白,是构成肌肉肌原纤维基本组成蛋白[22]。如图4所示,冷熏过程中鱼肉肌球蛋白浓度随冷熏时间延长显著降低(<0.05),新鲜高白鲑鱼肉肌球蛋白含量为9.44 mg/g,冷熏24 h后肌球蛋白含量为1.81 mg/g,下降了80.8%。冷熏期间,熏烟中的有机醇、醛、酸类化合物不断地渗入肌肉组织中,导致肌球蛋白变性使其溶解性降低,从而使蛋白浓度降低。
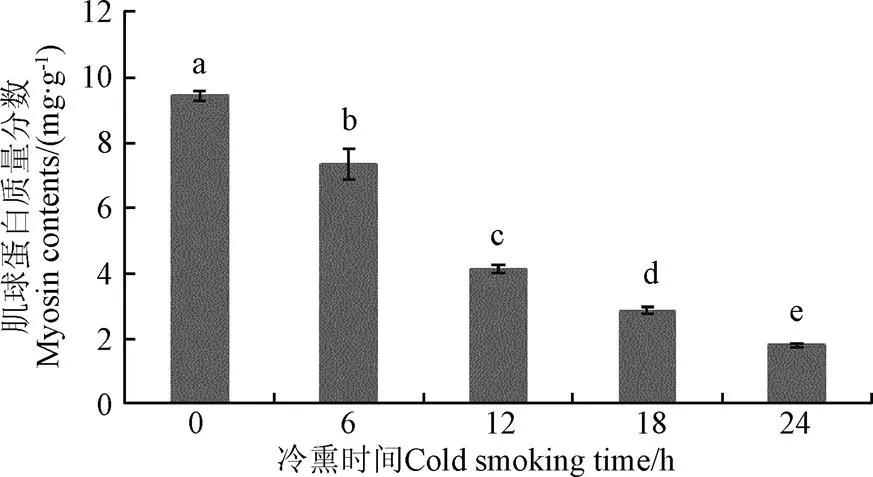
图4 肌球蛋白浓度随冷熏时间变化(n=5)
2.6 冷熏对鱼肉肌球蛋白总巯基含量的影响
疏基是蛋白质重要的功能基团,具有较高的抗氧化性,容易被氧化形成含硫化合物如-SOH、-SOOH、-SS-,使总巯基含量减少[23]。另外二硫键与其他化合键发生交联,是形成蛋白质聚合的主要途径[24-25]。如图5结果所示,新鲜鱼肉肌球蛋白总巯基含量为3.34 mol/105g蛋白,冷熏过程中,总巯基含量不断降低,冷熏24 h总巯基含量减少至0.657 mol/105g蛋白。总巯基含量持续降低表明冷熏过程中肌球蛋白发生不可逆氧化变性,其值越低表征蛋白变性程度越高。
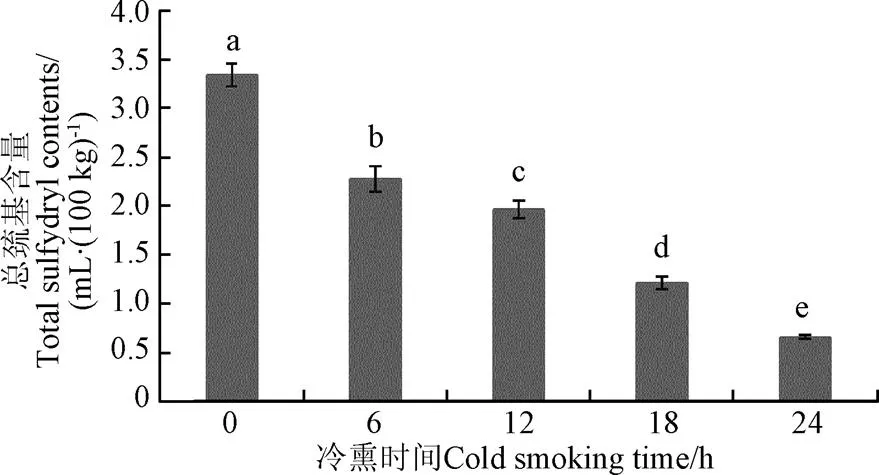
图5 总巯基含量随冷熏时间变化(n=5)
2.7 冷熏对鱼肉肌球蛋白Ca2+-ATPase活性的影响
Ca2+-ATPase活性表征肌球蛋白头部完整性的指标,Ca2+-ATPase活性下降与肌球蛋白头部的巯基发生氧化以及蛋白质交联有关[26]。如图6所示,冷烟熏条件下肌球蛋白的Ca2+-ATPase活性随烟熏时间的延长而降低。新鲜鱼肉冷熏24 h,Ca2+-ATPase活性由1.985mol/(mg·h)下降至0.244mol/(mg·h),其中冷熏0~12 h,Ca2+-ATPase活性显著降低(<0.05),冷熏12~24 h,Ca2+-ATPase活性变化不明显(>0.05)。
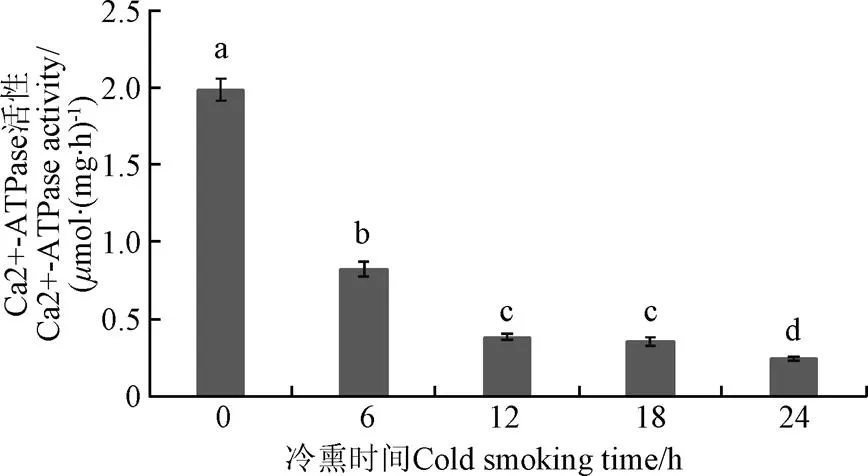
图6 Ca2+-ATPase活性随冷熏时间变化(n=5)
2.8 冷熏对鱼肉肌球蛋白表面疏水性的影响
蛋白质表面疏水性反应蛋白质分子内部疏水基团的暴露程度[27]。图7结果表明,冷熏6 h,肌球蛋白表面疏水性增加(>0.05),冷熏6~18 h,肌球蛋白表面疏水性变化不明显(>0.05),冷熏24 h,肌球蛋白表面疏水性上升(<0.05)。冷熏过程中肌球蛋白表面疏水性增加与巯基含量减少呈对应关系,与巯基氧化生成二硫键形成蛋白聚合物相关[28-29]。
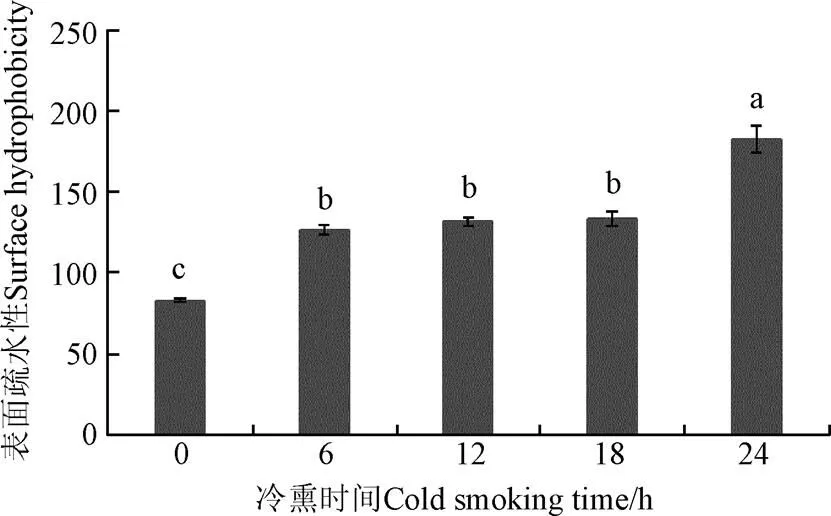
图7 表面疏水性随冷熏时间变化(n=5)
3 结 论
相比热熏而言,冷熏是一种轻度的熏制方法,冷熏温度保持在(20±2)℃左右,避免腐败微生物快速生长繁殖,另外熏烟中含有的羰基、酚类、有机酸、醇类等化合物可以有效地抑制微生物生长,因此冷熏可以较好地保持鱼肉品质。随着冷熏时间延长,鱼肉含水率、水分活度呈下降趋势,冷熏24 h,鱼肉含水率53.03%,水分活度0.952,因此冷熏鱼肉仍大部分保留新鲜鱼肉的组织形态;冷熏过程中,鱼肉亮度下降,红度缓慢增加,而黄度显著增加,鱼肉色泽由白色向褐色转变;鱼肉剪切力、韧性呈上升趋势,表明熏制鱼肉嫩度下降,咬合力增加;鱼肉TVB-N缓慢增加,冷熏24 h,TVB-N<15 mg/100 g,冷熏期间低温控制可以较好地保持鱼肉新鲜度;鱼肉肌球蛋白浓度、总巯基含量、Ca2+-ATPase活性逐渐降低,表面疏水性增加,肌球蛋白在冷熏过程中发生氧化变性。综合高白鲑鱼肉冷熏过程中感官品质、新鲜度、肌球蛋白性质变化趋势,控制鱼肉冷熏时间12~18 h可以有效地保障冷熏鱼肉品质特性。
[1] 李萌,由高铭,蒋晶华,等. 冷冻和冰鲜处理对新疆高白鲑鱼片理化指标和腐败菌的影响[J]. 大连海洋大学学报,2017,32(5):584-589.
Li Meng, You Gaoming, Jiang Jinghua, et al. Effects of frozen and fresh treatments on physical, chemical and spoilage bacteria of Xinjiang peled Coregonus peled fillets[J]. Journal of Dalian Fisheries University, 2017, 32(5): 584-589. (in Chinese with English abstract)
[2] 赵贵民,高庆全. 呼伦湖移植养殖俄罗斯高白鲑试验[J]. 中国水产,2014,2:68-69.
Zhao Guimin, Gao Qingquan. A trial of Russian high-white salmon transplanted from Lake Hulun[J]. China Fishes, 2014, 2: 68-69. (in Chinese with English abstract)
[3] 郭焱,马燕武,蔡林刚,等. 赛里木湖高白鲑和凹目白鲑肌肉、卵的营养分析评价[J]. 水产学杂志,2004,17(1):62-67.
Guo Yan, Ma Yanwu, Cai Lingang, et al. Analysis of the nutritive composition in muscle and eggs of coregonus peled and coregonus autumnalis in Sailimu Lake[J]. Chinese Journal of Fisheries, 2004, 17(1): 62-67. (in Chinese with English abstract)
[4] Koral S, Kose S, Tufan B. The effect of storage temperature on the chemical and sensorial quality of hot smoked atlantic bonito () packed in aluminium foil[J]. Turkish Journal of Fisheries and Aquatic Sciences, 2010, 10: 439-443.
[5] Gómez-Guillén M C, Gómez-Estaca J, Giménez B, et al. Alternative fish species for cold-smoking process[J]. International Journal of Food Science and Technology, 2009, 44: 1525-1535.
[6] Fellows P J. Food Processing Technology (Fourth Edition), 15-Smoking[M]. Sawston Cambridge: Woodhead Publishing Series in Food Science, Technology and Nutrition, 2017: 717-732.
[7] Myhrvold N. Modernist cuisine: The art and science of cooking[J]. Cooking Lab, 2011, 471(7340): 574-575.
[8] Zhang W, Xiao S, Ahn D U. Protein oxidation: Basic principles and implications for meat quality[J]. Critical Reviews in Food Science & Nutrition, 2013, 53(11): 1191-1201.
[9] Soottawat Benjakul, Wonnop Visessanguan, Jiravadee Tueksuban. Changes in physico-chemical properties and gel-forming ability of lizardfish () during postmortem storage in ice, Food Chemistry, 2003, 80(4): 535-544.
[10] 中华人民共和国国家卫生和计划生育委员会. 食品中水分的测定: GB 5009.3-2016[S]. 北京:中国标准出版社.
[11] 中华人民共和国国家卫生和计划生育委员会. 食品中挥发性盐基氮的测定: GB 5009.228-2016[S]. 北京:中国标准出版社.
[12] You J, Pan J, Shen H, et al. Changes in physicochemical properties of bighead carp () actomyosin by thermal treatment[J]. International Journal of Food Properties, 2012, 15(6): 1276-1285.
[13] Wang L, Xiong G, Peng Y B, et al. The cryoprotective effect of different konjac glucomannan (KGM) hydrolysates on the glass carp () myofibrillar during frozen storage[J]. Food and Bioprocess Technology, 2014, 7(12): 3398-3406.
[14] Espinoza Rodezno L A, Sundararajan S, Solval K M, et al. Cryogenic and air blast freezing techniques and their effect on the quality of catfish fillets[J]. LWT-Food Science and Technology, 2013, 54: 377-382.
[15] Snežana Škaljac, Marija Jokanović, Vladimir Tomović, et al. Influence of smoking in traditional and industrial conditions on colour and content of polycyclic aromatic hydrocarbons in dry fermented sausage “Petrovská klobása”[J]. LWT-Food Science and Technology, 2018, 87: 158-162.
[16] Li C B, Li J, Li X, et al. Effect of low-voltage electrical stimulation after dressing on color stability and water holding capacity of bovine longissimus muscle[J]. Meat Science, 2011, 88(3): 559-565.
[17] Liu Q, Chen Q, Kong B H, et al. The influence of superchilling and cryoprotectants on protein oxidation and structural changes in the myofibrillar proteins of common carp () surimi[J]. Food Science and Technology, 2015, 57(2): 603-611.
[18] Marit Bjørnevik, Mireille Cardinal, Jean-LucVallet, et al. Effect of salting and cold-smoking procedures on Atlantic salmon originating from pre-or post rigor filleted raw material. Based on the measurement of physiochemical characteristics[J]. LWT- Food Science and Technology, 2018, 91: 431-438.
[19] Estefanía Ledesma,Amanda Laca,Manuel Rendueles, et al. Texture, colour and optical characteristics of a meat product depending on smoking time and casing type[J]. LWT-Food Science and Technology, 2016, 65: 164-172.
[20] Zhou Jiaojiao, Wu Xiaoyang, Chen Zhou, et al. Evaluation of freshness in freshwater fish based on near infrared reflectance spectroscopy and chemometrics[J]. LWT- Food Science and Technology, 2019, 106: 145-150.
[21] 中华人民共和国国家卫生和计划生育委员会. 鲜、冻动物性水产品: GB 2733-2015[S]. 北京: 中国标准出版社.
[22] 葛黎红. 内源蛋白酶在低温保鲜草鱼质构劣化中的作用[D]. 无锡:江南大学,2017.
Ge Lihong. Study on Correlation of Endogenous Proteases with Texture Deterioration of Grass Carp () During Chilled Storage and Quality Control[D]. Wuxi: Jiangnan University, 2017.
[23] Huang L, Liu Q, Xia X F, et al. Oxidative changes and weakened gelling ability of salt-extracted protein are responsible for textural losses in dumpling meat fillings during frozen storage[J]. Food Chemistry, 2015, 185: 459-469.
[24] Xiong Y L, Park D, Ooizumi T. Variation in the cross-linking pattern of porcine myofibrillar protein exposed to three oxidative environments[J]. Journal of Agricultural and Food Chemistry, 2009, 57: 153-159.
[25] Tong Lv, YingWang, Daodong Pan, et al. Effect of trypsin treatments on the structure and binding capacity of volatile compounds of myosin[J]. Food Chemistry, 2017, 214: 710-716.
[26] Ooizumi T, Xiong Y L. Biochemical susceptibility of myosin in chicken myofibrils subjected to hydroxyl radical oxidizing systems[J]. Journal of Agricultural and Food Chemistry, 2004, 52: 4303-4307.
[27] Chamba M V M, Hua Y, Katiyo W. Oxidation and structural modification of full-fat and defatted[J]. Food Biophysics, 2014, 9(3): 193-202.
[28] Cao L, Su S, Regenstein J M, et al. Ca2+-induced conformational changes of myosin from silver carp () in gelation[J]. Food Biophysics, 2015, 10(4): 447-455.
[29] Yin M C, Faustman C. Influence of temperature, pH, and phospholipid composition upon the stability of myoglobin and phospholipid: A liposome model[J]. Journal of Agricultural and Food Chemistry, 1993, 41(6): 853-857.
Effects of cold smoking on physicochemical properties and myosin conformations of
Li Xin, Wang Lan, Shi Liu, Wu Wenjin, Ding Anzi, Xiong Guangquan※
(430064,)
The effect of cold smoking treatment on the physicochemical properties and myosin conformations offrom Sayram Lake (Xinjiang, China) were studied. The parameters of cold smoking machine were set as (20±2)℃ of environment temperature and 140 ℃ of smoke temperature, respectively. Pre-treatedwas subjected to different cold smoking duration (0, 6, 12, 18 and 24 h, respectively), and then the changes of its physicochemical properties (moisture content, water activity (), color, texture and TVB-N content) were investigated; then myosin was extracted from treated fish muscle, and its conformation change (myosin content, total sulfhydryl content, Ca2+-ATPase activity and surface hydrophobicity) was studied as well. During the 24 h of cold smoking treatment, the moisture content of fish muscle was significantly decreased from 75.75% to 53.03% (<0.05), and thewas significantly decreased from 0.988 to 0.952. The value of lightness (*), redness (*) and yellowness (*) of fresh fish flesh was 58.64, -0.80 and 3.00, respectively. With the extension of smoking time,*was significantly decreased (<0.05),* was slowly increased (<0.05) and* was significantly increased (<0.05), and finally thecolor of fish flesh was transferred from gloss white to yellowish-brown. Both the shear force and toughness of fish meat subjected to cold smoking treatment were obviously increased (<0.05) with the prolongation of smoking time. Meanwhile, the TVB-N content of fish product was gradually increased from 9.81 to 14.43 mg/100 g after the cold smoking treatment (24 h), which met the country’s national safety standards.On the other hand, the content of extracted myosin frommuscle was significantly decreased (<0.05) with the extension of smoking time, along with the decrease (<0.05) of total sulfhydryl content and Ca2+-ATPase activity. The surface hydrophobicity of extracted myosin was continually increased during smokingtreatment (<0.05). The results suggested that cold smoking treatment could lead to the protein denaturation of fish, and the degree of protein denaturation was getting severer when the treated time was longer. Therefore, comprehensively considering the results of sensory evaluation, freshness, protein denaturation of cold-smokedand economic cost and production period of fish processing, 12 h of cold smoking treatment could effectively obtain the superior quality of cold smokedThis paper could provide a theoretical basis and technical guidance for the development of cold smoked special freshwater products and for the control of the protein oxidation of fish product during cold smoking processing.
fish; physicochemical properties; protein;; cold smoking; myosin
李新,汪兰,石柳,等. 冷熏对高白鲑理化性质及肌球蛋白构象的影响[J]. 农业工程学报,2020,36(8):254-259.doi:10.11975/j.issn.1002-6819.2020.08.031 http://www.tcsae.org
Li Xin, Wang Lan, Shi Liu, et al. Effects of cold smoking on physicochemical properties and myosin conformations of[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(8): 254-259. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.08.031 http://www.tcsae.org
2019-10-22
2020-04-09
现代农业产业技术体系专项资金资助(CARS-46)
李新,副研究员,研究方向为水产品保鲜加工。Email:leexin117@163.com
熊光权,研究员,研究方面为水产品保鲜与贮运。Email:351609901@qq.com
10.11975/j.issn.1002-6819.2020.08.031
TS254.4
A
1002-6819(2020)-08-0254-06

