贯筋藤蛋白酶水解槟榔江水牛酪蛋白制备抗菌肽
赵琼,李素梅,陈昌航,段松,黄艾祥*
云南农业大学食品科学技术学院(昆明 650201)
槟榔江水牛是中国唯一的河流型水牛品种,主要分布在云南省保山市腾冲县的槟榔江流域,在当地称为“嘎拉牛”或“嘎拉水牛”[1]。水牛奶无膻腥味,清香可口,干物质、脂肪和蛋白质含量均高于荷斯坦牛乳[2]。乳蛋白营养丰富,其中酪蛋白含量约为80%,而且酪蛋白作为一种重要的营养物质,有着广泛用途,如焙烤食品中蛋白质的强化、人造奶油的增稠和酪蛋白源功能活性肽的制备等[3]。
近年来,抗生素滥用导致细菌的耐药性增加问题成为全球公共卫生难题,因此寻找传统抗生素的替代品迫在眉睫。抗菌肽(AMPs),是能清除体内突变细胞和抵御外界微生物侵害的一类小分子短肽,具有广谱抗菌活性、协同抗菌作用、抗病毒活性等功能[4]。不同于传统抗生素,抗菌肽是通过物理作用造成细胞膜的穿孔而达到广谱的抗菌效果,因此不易产生抗药性和交叉抗性[5]。由于酪蛋白是牛乳蛋白的主要成分,可利用酶解技术来制备抗菌活性肽。根据酶自身的特性,将酶解技术应用于外源性抗菌肽的制备是获得大量抗菌肽最有前途的方法,且该技术还具有低成本、高安全性、便于工业化生产等优点[6-7]。贯筋藤蛋白酶,一种新型、耐高温的植物凝乳酶,属于半氨酸蛋白酶家族[8],可用于奶酪[9]及乳饼[10]生产,将其应用于水牛奶酪蛋白的酶解上有望获得新型功能活性肽。Ripolles等[11]利用凝乳酶、胃蛋白酶水解牛乳乳铁蛋白制备抗菌肽并研究其对单增李斯特氏菌的抑菌效果。成希飞等[6]利用胰蛋白酶酶解南方水牛奶,以获得具有抗菌性的酶解产物,结果表明抗菌肽复合物对大肠杆菌的抑菌率81.34%。
试验利用贯筋藤蛋白酶水解槟榔江水牛酪蛋白来制备抗菌肽,在单因素试验基础上利用响应面试验优化酶解工艺,并应用SDS-PAGE检测贯筋藤蛋白酶是否能有效地水解酪蛋白。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
新鲜水牛乳(云南省保山市腾冲县);大肠埃希氏菌CICC 10003(中国工业微生物菌种保藏管理中心);柠檬酸(分析纯,天津市风船化学试剂科技有限公司);考马斯亮蓝(G-250,美仑生物有限公司);TRIS、SDS、Glycerol、ammonium persulphate、acrylamide、TEMED(北京索莱宝科技有限公司)。
1.1.2 仪器与设备
TLG20M台式高速冷冻离心机(长沙迈佳森仪器设备有限公司);HWS24电热恒温水浴锅(上海一恒科学仪器有限公司);FD-1A-50冷冻干燥机(上海比朗仪器制造有限公司);BIO-RAD Mini电泳仪(美国伯乐);MS-100金属浴(杭州奥盛仪器有限公司);ZQLY-180S立式全温振荡培养箱(上海知楚仪器有限公司);LDZM-60KCS立式压力蒸汽灭菌器(上海申安医疗器械厂)。
1.2 方法
1.2.1 酪蛋白的制备工艺
新鲜水牛奶→4 ℃预冷→低温离心脱脂(4 000 r/min,20 min)→调节至pH 4.6(0.2 mol/L柠檬酸)→搅拌→低温离心(4 000 r/min,20 min)→弃上清液→清洗沉淀3次→灭酶(沸水,10 min)→调至pH 7.0(1 mol/mL NaOH)→真空冷冻干燥→-20 ℃保存备用
1.2.2 单因素试验
1.2.2.1 酶解时间
配制20 mg/mL酪蛋白溶液(0.05 mol/L pH 8.5,Tris-HCl缓冲液),酶底比为1∶50(E/S,质量比),于50 ℃条件下分别酶解1,2,3,4,5和6 h,酶解结束后于沸水灭酶10 min,离心(10 000 r/min,15 min)弃沉淀,保留上清液,即为酶解液。分别测定酶解液的抑菌活性,从而筛选出最佳酶解时间。
1.2.2.2 酶解温度
固定最佳酶解时间,配制20 mg/mL酪蛋白溶液,按酶底比为1∶50(E/S,质量比),在不同酶解温度(40,45,50,55,60,65和70 ℃)下酶解。
1.2.2.3 酶底比
固定最佳酶解时间和酶解温度,配制20 mg/mL酪蛋白溶液,在不同酶底比(1∶25,1∶50,1∶75,1∶100和1∶125(E/S,质量比))条件下酶解。
1.2.3 抑菌活性测定
1.2.3.1 大肠杆菌的活化[12]
将-80 ℃冻存的大肠杆菌接种至LB肉汤培养基中,在37 ℃条件下摇床(120 r/min)培养24 h,连续活化2次,将活化后菌悬液于PCA琼脂培养基计数。
1.2.3.2 活性测定
采用滤纸片法测定抑菌活性[13]。将活化后的菌悬液用生理盐水梯度稀释至浓度106CFU/mL,LB琼脂培养基灭菌后每皿倒25 mL,待培养基凝固后,取200 μL菌液均匀地涂布在培养基上,待菌液晾干后,每皿贴上4片滤纸片(直径6 mm),取8 μL样液(经0.22 μm滤膜过滤器过滤)于滤纸片上,超纯水作空白对照。于4 ℃条件下放置2 h,待样液吸附完全后[14],转移至培养箱为37 ℃条件下培养12 h,测量其抑菌圈直径。每组试验重复3次。
1.2.3.3 抑菌圈直径的计算方法[15]

1.2.4 响应面设计
基于单因素试验结果,运用Box-Behnken中心组合试验设计原理,对显著影响酶解制备抗菌肽的3个因素酶解时间(A)、酶解温度(B)、酶底比(C)做三因素三水平响应面分析试验(表1)。
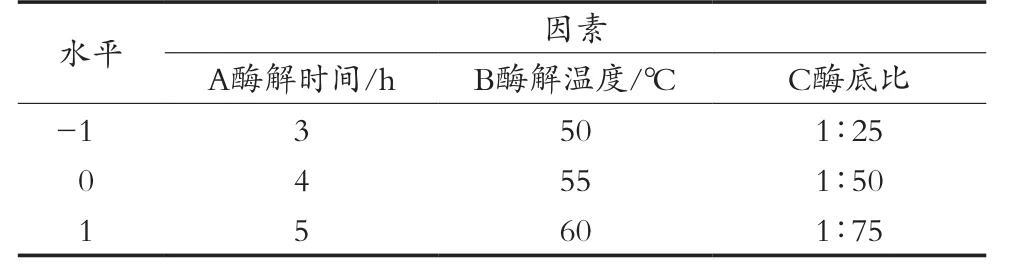
表1 响应面试验因素与水平设计表
1.2.5 SDS-PAGE电泳
利用SDS-PAGE反应贯筋藤蛋白酶对酪蛋白大分子的水解情况。参照文献[16]方法稍作修改:制胶(15%分离胶、4%浓缩胶)→样品处理(样品与上样缓冲液比例1∶1,混匀,金属浴95 ℃处理10 min,10 000 r/min离心2 min)→上样(每孔上样量10~20 μL)→电泳(50 V,30 min调至120 V,约90 min)→固定(30%甲醇,30 min)→过夜考染[17]→脱色(脱色至条带清晰)→拍照→Image Lab软件分析胶片。
1.3 数据统计分析
采用Excel 2010对试验数据进行处理,Design-Expert 8.0.6软件进行响应面优化分析,Image Lab软件分析电泳胶片。
2 结果与分析
2.1 单因素试验
2.1.1 酶解时间对抑菌效果的影响
由图1可知,酪蛋白酶解液对大肠杆菌的抑制效果随酶解时间的延长呈现先增后减的趋势,在酶解时间为4 h时其抑菌效果最佳。在酶解1~4 h过程中,酶解液的抑菌效果逐渐增强,原因可能是随着酶解进行,酪蛋白大分子逐渐释放出具有抑菌活性的小分子肽,故出现抑菌效果增强现象。而随着酶解时间的增长(>4 h),酶解液的抑菌活性出现下降趋势,可能是酶解液中具有抑菌活性的小分子肽被进一步水解,抑菌活性基团被破坏导致酶解液抑菌活性减弱[18]。因此为了防止水解过度,在制备酪蛋白抗菌肽时应严格控制水解时间。综上所述,选择4 h为最佳的酶解时间。
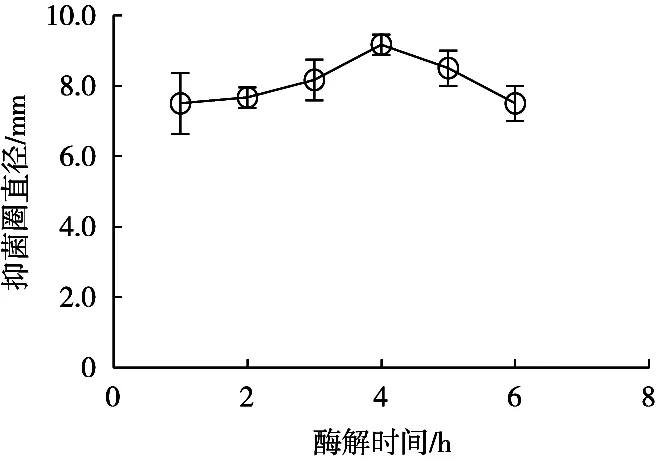
图1 酶解时间对抑菌效果的影响
2.1.2 酶解温度对抑菌效果的影响
根据酶的特性,在酶发挥其酶解催化作用时,酶的作用条件(如:温度)与酶的结构稳定性有着密不可分的联系[19]。蛋白酶分子的肽键具有特定的空间结构,如果反应温度超过某一极限,极易引起次级键解离,就会导致蛋白酶丧失或部分丧失催化活性;但如果反应温度过低,就会大大降低体系内分子运动激烈程度,从而降低蛋白酶与底物的碰撞几率[20]。试验将温度设在40~70 ℃范围内来筛选最佳酶解温度。由图2可知,随着温度的升高酶解液的抑菌效果呈现先增大后减小的趋势,在温度为55 ℃时,酶解液的抑菌效果最佳。综上所述,选择55 ℃为最佳的酶解温度。
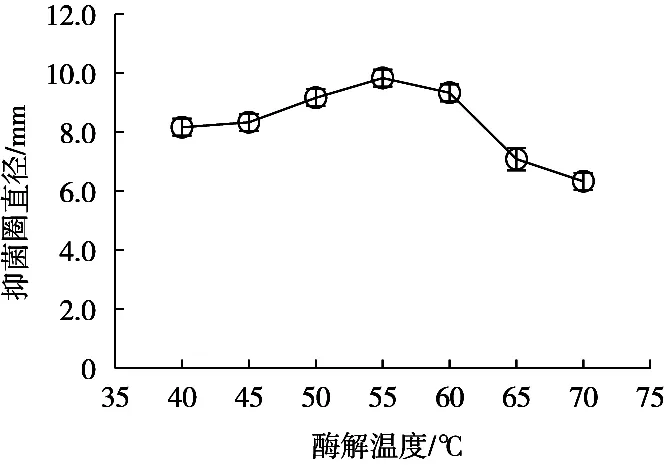
图2 酶解温度对抑菌效果的影响
2.1.3 酶底比对抑菌效果的影响
由图3可知,随着酶底比(E/S)减小酶解液的抑菌圈直径呈现先上升后下降的趋势,但当E/S<1/50之后,酶解液的抑菌活性就逐渐减小。因而选择1∶50为最佳酶底比。酶浓度与底物浓度之比,比酶浓度本身能更好地反应酶解过程中的反应速度特征[21]。当底物浓度一定,而增加的酶量又未使底物浓度饱和时,则E/S越大,反应速度也越快,蛋白质的水解率也越高;但E/S过大,水解率也随之过大,底物中的大分子蛋白迅速减少,小分子肽迅速增加,同时肽也会被过剩的酶进一步水解成分子量更低且没有生物活性的一些寡肽或氨基酸,也有可能导致酶自身相互水解,使酶活力降低[22-23]。
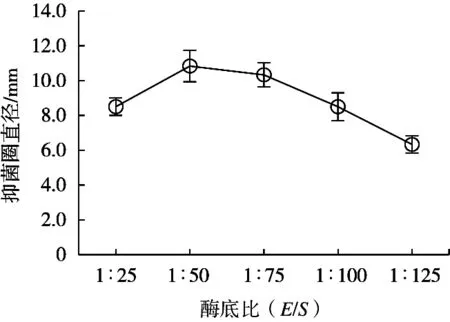
图3 酶底比对抑菌效果的影响
2.2 响应面分析
2.2.1 响应面分析方案及结果
目前,Box-Behnken响应面设计被广泛地应用于一些工艺条件筛选的研究中[24-25]。试验根据Box-Behnken响应面设计的中心组合试验设计原理,结合单因素试验结果,选择酶解时间(A)、酶解温度(B)、酶底比(C)3个影响因素,各取3个水平,采用三因素三水平的响应面分析方法对水解条件进行优化设计,共17个试验点,中心点试验重复5次。试验因素与水平设计见表2,回归方差分析见表3。
由表3方差分析表可知方差失拟项不显著(p=0.239 2>0.05),说明回归方程不失拟,表明所选模型合适,可以用此模型来拟合试验;方程模型极显著(p=0.003 5<0.01),说明多元回归方程能较好地拟合试验结果。综上所述,Box-Behnken试验设计可靠,模型可用于贯筋藤蛋白酶水解槟榔江水牛乳酪蛋白制备抗菌肽的理论预测。在此模型中,回归系数的显著性显示平方项C2的影响达到显著水平;交互项BC、平方项A2、B2的影响均达到极显著水平;各因素对酶解液抑菌圈直径影响的顺序为:酶解温度>酶底比>酶解时间。软件拟合出的二次多项回归方程为:抑菌圈直径(Y)=10.44+0.038A-0.47B-0.31C-0.10AB+0.48AC+1.25BC-1.53A2-1.81B2-0.88C2。
2.2.2 响应面分析结果
响应曲面图能直观反映各个因素与响应值之间的关系、两因素间交互作用的显著性,坡度的陡峭程度,表明响应值对于处理条件改变的敏锐性,等高线的形状则反映各因素交互是否显著,圆形等高线表示交互不显著[26-27]。图4~图6为3个因素对酶解酪蛋白制备抗菌肽抑菌效果的交互作用。由图4~图6可知,随着酶解时间延长、酶解温度升高,随着酶解时间延长、酶底比升高,随着酶解温度、酶底比升高,酶解液的抑菌圈直径呈现先上升后下降趋势,与单因素的试验结果一致。但图4和图5等高线呈圆形,说明酶解时间和酶解温度、酶解时间和酶底比的交互作用不显著,而图6等高线图呈圆形,说明酶解温度和酶底比的交互作用显著。
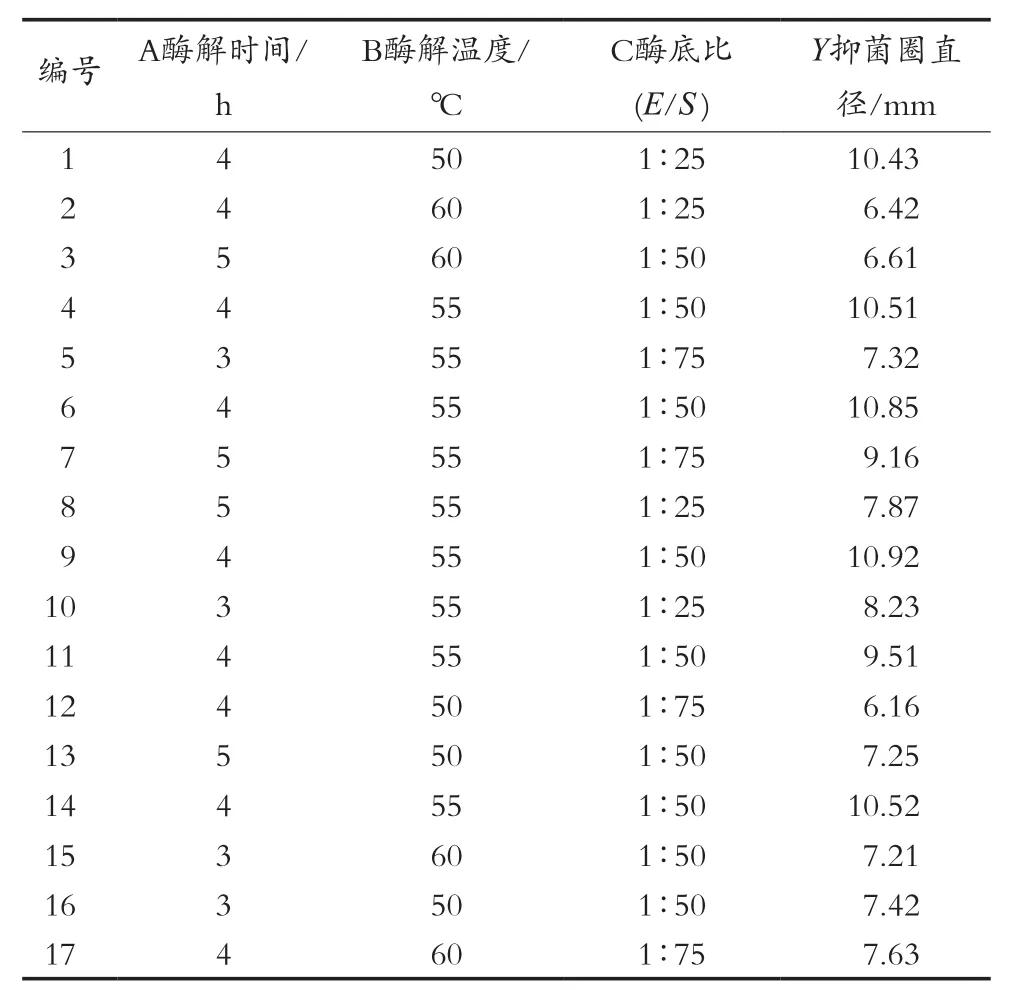
表2 响应面分析方案及结果
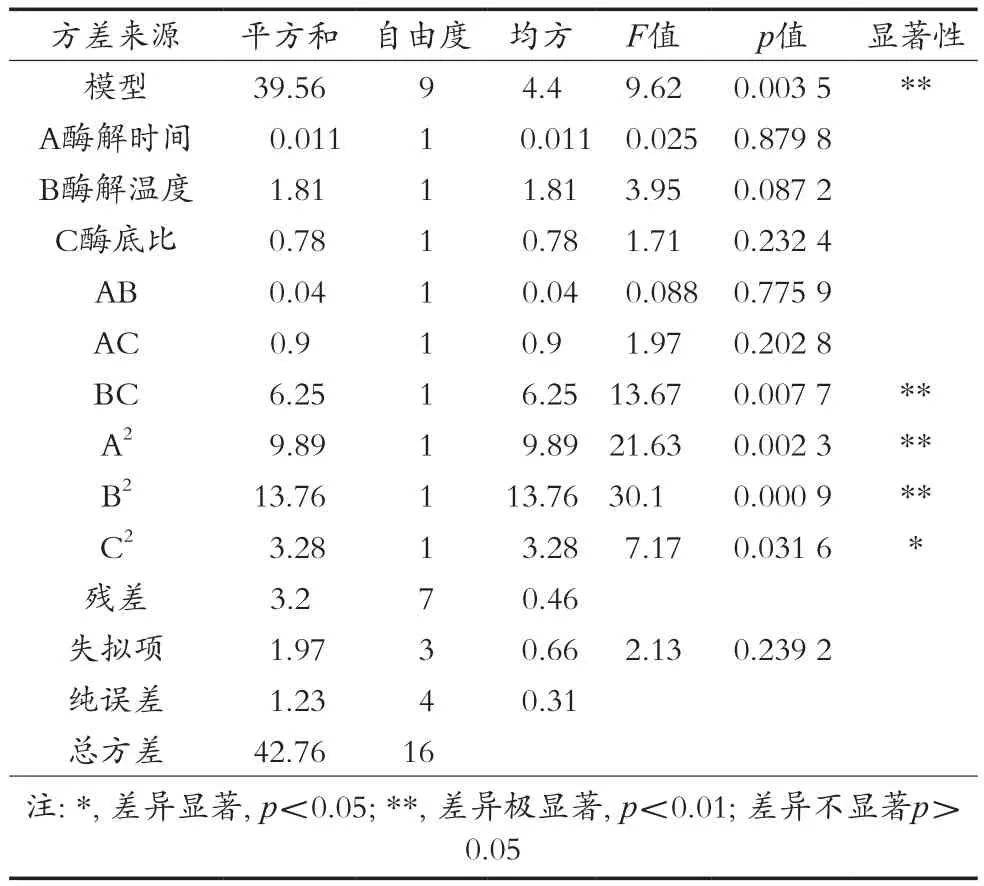
表3 酶解液抑菌圈直径回归模型方差分析表
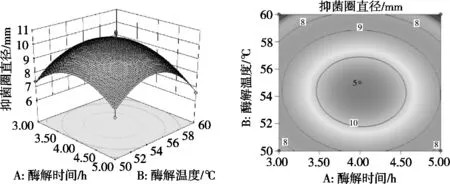
图4 酶解时间和温度交互作用对酶解液抑菌圈直径影响的3D响应面图和等高线图
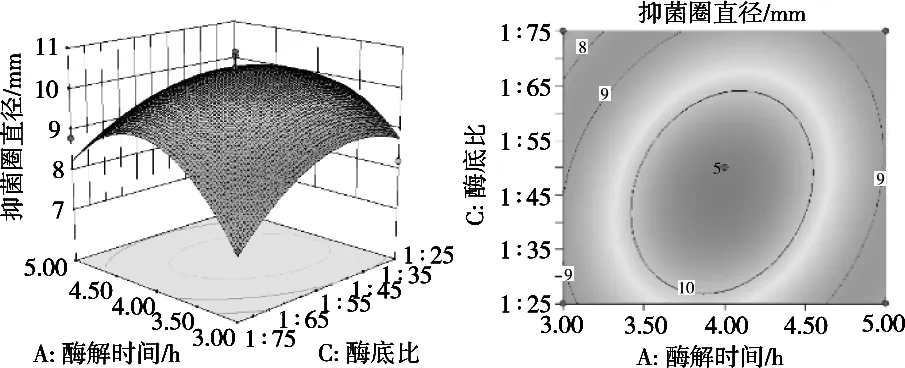
图5 酶解时间和酶底比交互作用对酶解液抑菌圈直径影响的3D响应面图和等高线图
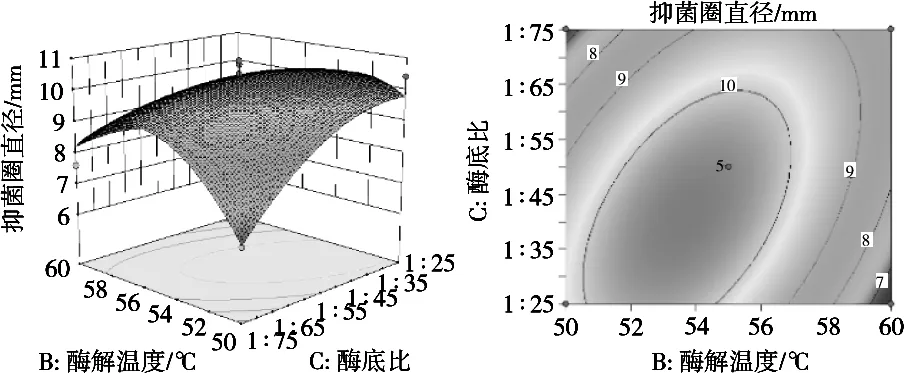
图6 酶解温度和酶底比交互作用对酶解液抑菌圈直径影响的3D响应面图和等高线图
2.2.3 最佳抗菌肽制备工艺验证试验
根据响应面法优化分析,贯筋藤蛋白酶水解槟榔江水牛酪蛋白制备抗菌肽最佳工艺条件为酶解时间4.67 h、酶解温度54.01 ℃、酶底比1∶46.61,抑菌圈预测值为9.83 mm。为了验证此模型预测的准确性,且考虑试验操作工作中的可操作性,固设定待验证的酶解工艺参数为:酶解时间4.5 h、酶解温度54 ℃、酶底比1∶45。在此条件下进行3次平行验证试验。结果表明,在此条件下酶解液对大肠杆菌抑菌圈直径为10.42±0.46 mm,与预测值相近(预测值为9.83 mm),说明此模型优化的工艺准确可靠,具有实际应用价值。
2.3 SDS-PAGE分析酪蛋白降解情况
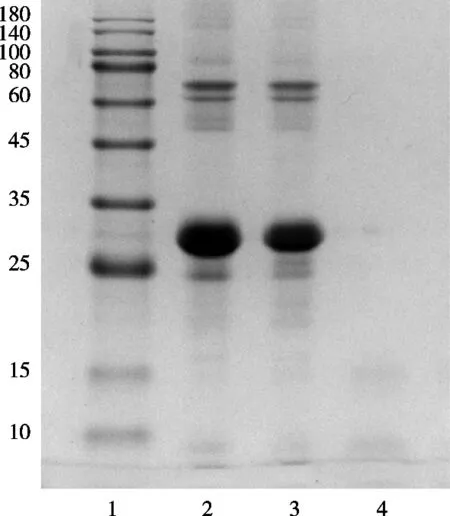
图7 SDS-PAGE分析酪蛋白降解情况
SDS-PAGE用于蛋白质纯度及分子量的检测,也可以根据蛋白质分子量大小变化观察其降解情况[28]。由图7可以看出,在最佳酶解条件下(温度54 ℃、时间4.5 h、酶比底1∶45)酪蛋白明显被降解,酶解液的分子量在15 kDa以下。Abdel-Hamid等[29]研究发现骆驼乳清蛋白经木瓜蛋白酶水解240 min后,电泳图谱显示所有乳清蛋白组分完全被水解,抑菌活性验证发现水解释放出了具有抑菌活性的肽。因此,试验的电泳图谱表明贯筋藤凝乳酶能有效水解槟榔江水牛酪蛋白,结合抑菌活性测定表明酶解产物中可能含有小分子抗菌活性肽。
3 结论
通过单因素和响应面优化槟榔江水牛酪蛋白源抗菌肽的酶解制备工艺,最佳工艺为:水解时间4.5 h、酶底比1∶45、酶解温度54 ℃。在此条件下酶解液对大肠杆菌的抑菌圈直径为10.42±0.46 mm,SDSPAGE可看出大分子酪蛋白已被完全水解成为小分子肽。此研究为槟榔江水牛奶进一步开发利用提供了参考,并为此抗菌肽的分离纯化及抑菌机制研究奠定了基础。

