甘薯块根贮藏期间细胞壁成分及降解酶活性变化
曹如霞 徐 舒 李 玲 陈玲玲 陆国权*
(1.浙江农林大学 农业与食品科学学院/浙江省农产品品质改良技术研究重点实验室,杭州 311300; 2.浙江农林大学 薯类作物研究所,杭州 311300)
甘薯(Ipomoeabatatas(L.) Lam),旋花科甘薯属植物,不仅是种植广泛的粮食作物,也是重要的饲料和工业原料[1]。甘薯的农业生产长期以来在我国国民经济中占据重要位置,是我国主要粮食作物之一,其栽培面积和总产量仅次于水稻、小麦和玉米,居第四位,且优质食用型品种种植面积在近几年逐步扩大[2]。甘薯具有较强的抗旱能力,耐贫瘠,但在贮藏过程中,易出现感病、发芽、失水萎蔫、营养流失和腐烂等情况,影响其营养价值和经济价值[3-5]。
甘薯块根对贮藏温度较敏感,其会在16~35 ℃萌芽,<9 ℃便易出现冷害现象,林婕等[6]研究结果显示,甘薯最适贮藏温度为10~15 ℃。甘薯块根收获后大多会在29~31 ℃,相对湿度63%~65%条件下放置4 d,促使其表皮伤口愈合,减少贮藏中的腐烂[7]。Thompson 等[8]调查了甘薯枯萎病和黑星病在南非的发病情况,发现甘薯黑星病是南非地区甘薯生产的一个潜在威胁。张有林等[9]发现甘薯贮藏前经愈伤和低温处理,噻苯咪唑(TBZ)熏蒸结合塑料袋包装,在适宜的温度下贮藏,能用效抑制黑斑病的病原菌孢子繁殖,保鲜效果理想,食用安全卫生。甘薯块根贮藏过程中也会使用气态二氧化氯(ClO2),减少其被真菌污染的概率,延长贮藏期[10]。
甘薯块根在收获后生长已经停止,但生命活动仍在继续,已从合成为主转变成将体内高分子化合物分解成简单分子[11]。细胞壁的降解会影响果实质地,纤维素酶、果胶酶和β-半乳糖苷酶不仅在成熟期分解相应的底物,降解细胞壁,使果实成熟,对采后果实软化也有很大影响[12-14]。果实成熟过程中,原果胶不断降解为可溶性果胶,细胞结构也随之受损,并且随着微纤丝间果胶和纤维素物质的溶解,微纤丝结构变得松弛而软化,细胞壁变薄,果肉硬度随之下降。新鲜的甘薯块根组织鲜嫩,含水量高,呼吸旺盛[15],在贮藏过程中发生着一系列复杂变化,细胞壁在细胞壁酶作用下发生降解,导致软化,进而腐烂。不同品种甘薯块根的抗腐烂性不同,但有关甘薯耐贮机制的研究鲜有报道。本试验通过分析不同耐贮性甘薯块根在贮藏过程中细胞壁成分及酶活性的变化规律,旨在探明耐贮性的生理机制,以期为甘薯块根合理贮藏提供理论依据。
1 材料与方法
1.1 试验材料
试验品种为‘苏薯 8 号’、‘浙薯 13’和‘南薯 88’,由河北省邯郸市禾下土种业有限公司提供,种植于浙江农林大学薯类作物研究所板桥基地,生长期110 d。种植采用单行高垄,垄宽50 cm,垄高、沟深和株距均为30 cm,小区内各品种随机排列,每个品种40 株,3次区间重复。于2018年9月10日收获甘薯块根,挑选大小一致,无破损,无病虫害的块根存放于保鲜库中,温度为12 ℃,相对湿度为85%,贮藏至0、7、15、30、45、60、81和102 d,分别取样。
1.2 试验方法
1.2.1腐烂率测定
甘薯腐烂率的测定根据下式进行计算:腐烂率=(腐烂甘薯个数/甘薯总个数)×100%,求得平均值以及标准差[16]。
1.2.2失重率测定
甘薯失重率的测定根据下式进行计算:失重率=(甘薯贮前鲜重-贮后鲜重)/贮前鲜重×100%。求得平均值以及标准差[16]。
1.2.3果胶的测定
参照韩雅珊[17]的方法,用咔唑比色法进行测定。
1.2.4纤维素的测定
使用植物纤维素(cellulose)酶联免疫分析法。
1.2.5木质素的测定
参照熊素敏[18]的方法,用滴定法进行测定。
1.2.6纤维素酶(Cx)活性测定
参照Misoon[19]的方法,用分光比色法进行测定。
1.2.7半纤维素酶(HCL)活性测定
参照刘靖宇[20]的方法并加以改进,在试管中加入木聚糖溶液1.5 mL,加粗酶液0.5 mL,50 ℃ 水浴30 min,其后操作与纤维素酶活性测定相同。
1.2.8β-半乳糖苷酶(β-Gal)活性测定
1.3 数据处理
数据的录入和整理采用Microsoft Excel 2013软件,数据处理采用SPSS 20软件,采用ANOVA进行Tukey多重差异分析以及Pearson相关性分析。
2 结果与分析
2.1 甘薯块根贮藏期间腐烂率变化
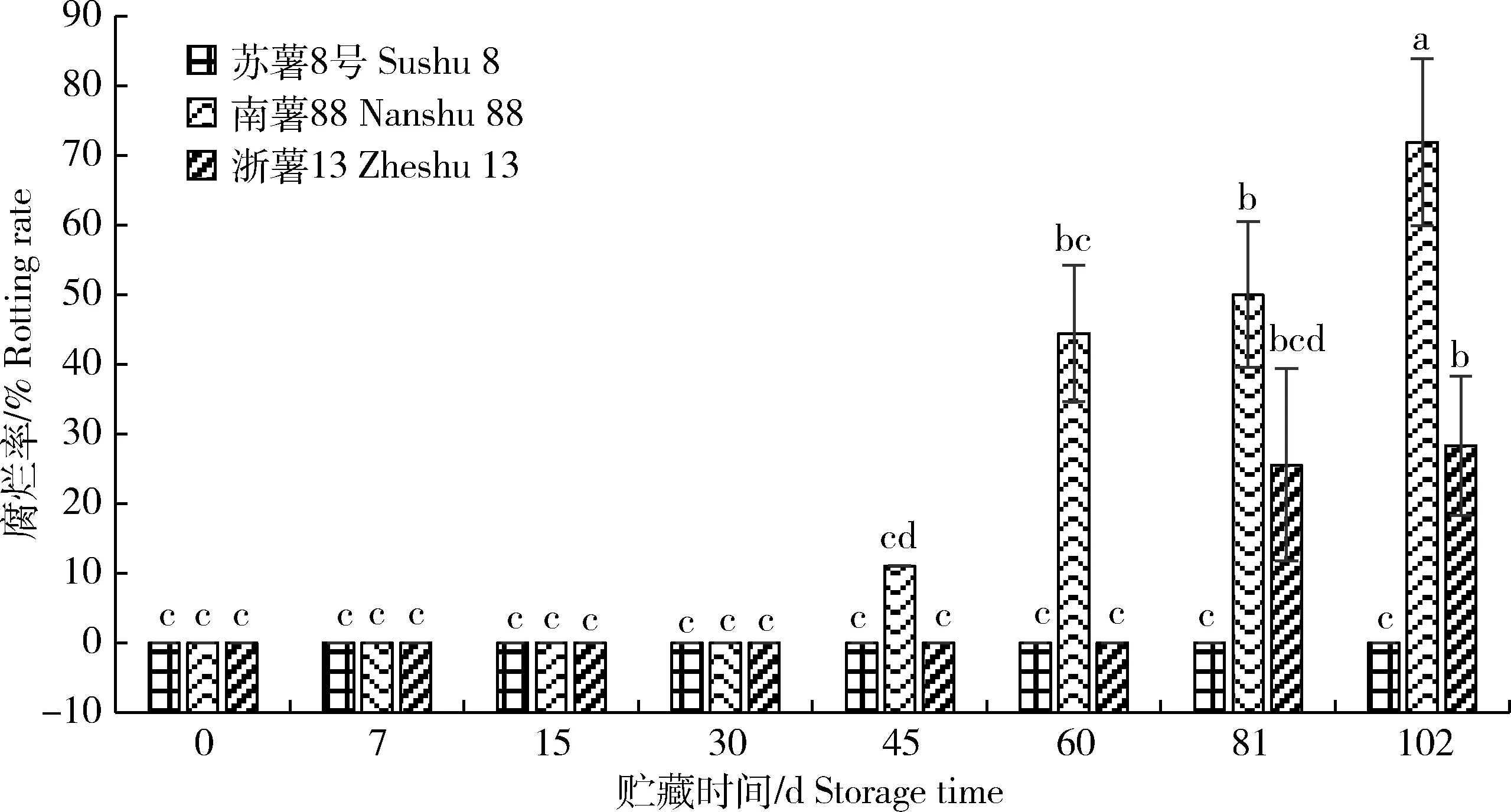
由图1可知,‘苏薯8号’在102 d贮藏期内没有出现腐烂情况,腐烂率为0。‘南薯88’在贮藏 45 d 后开始腐烂,腐烂率快速上升期出现在贮藏 60 d 后,贮藏102 d时腐烂率达到72%,显著高于贮藏至同时期的其他2个品种。‘浙薯13’贮藏 81 d 后开始腐烂,贮藏102 d时腐烂率达到28%,显著高于‘苏薯8号’,显著低于‘南薯88’。说明‘苏薯8号’耐贮性最好,‘浙薯13’次之,‘南薯88’最差。
柱形上用不同小写字母标识代表不同品种在不同贮藏时间差异显著,P<0.05。下同。 Different lowercase letters on the column indicate significant difference in storage time of different varieties atP<0.05. The same bellow.
图1 贮藏期间甘薯块根腐烂率变化
Fig.1 Change of rotting rate of sweetpotato storage roots during storage
2.2 甘薯块根贮藏期间失重率变化
由图2可知,甘薯块根贮藏期间失重率呈上升趋势。‘苏薯8号’0~102 d贮藏期内失重率变化幅度最小,贮藏102 d时失重率为14.71%。‘南薯88’和‘浙薯13’失重率在贮藏后期上升较快,贮藏102 d时失重率分别为21.1%和24.84%。‘苏薯8号’贮藏30、81和102 d时失重率显著低于‘浙薯13’,贮藏60 d时失重率显著低于‘南薯88’。耐贮性好的‘苏薯8号’失重率显著低于其他2个品种,能较好的保持贮藏前后的质量。
2.3 甘薯块根贮藏期间可溶性果胶含量变化
由图3可知,贮藏后甘薯块根干重的可溶性果胶含量上升。贮藏前期3个品种甘薯可溶性果胶含量差异不大,7~15 d是快速上升期,之后‘南薯88’和‘浙薯13’趋势平缓,而‘苏薯8号’贮藏45 d时上升至最大值19.3 mg/g,显著高于其他2个品种。‘南薯88’贮藏102 d时达到最大值8.5 mg/g,而‘浙薯13’贮藏60 d时达到最大值9.7 mg/g。耐贮性好的‘苏薯8号’贮藏中后期可溶性果胶含量高于耐贮性一般的品种。
2.4 甘薯块根贮藏期间原果胶含量变化
由图4可知,贮藏期间甘薯块根干重中原果胶含量下降。3个品种甘薯原果胶含量在贮藏期间的各取样时间点无显著差异,其含量在0~7 d快速下降,可能是由于甘薯刚收获,处于呼吸跃变期,体内生命活动较活跃,原果胶降解较快。‘苏薯8号’贮藏至7 d时降至最小值96.2 mg/g,‘南薯88’和‘浙薯13’贮藏至15 d时降至最小值,分别是97.0和 96.5 mg/g。

图2 贮藏期间甘薯块根失重率变化
Fig.2 Change of weight loss rate of sweetpotato storage roots during storage

图3 贮藏期间甘薯块根干重中可溶性果胶含量变化
Fig.3 Change of soluble pectin content in sweetpotato storage roots during storage
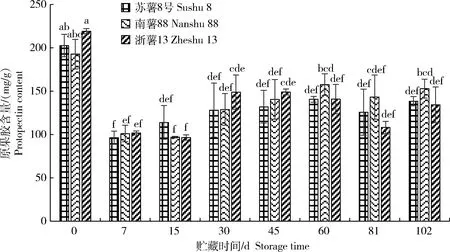
图4 贮藏期间甘薯块根干重中原果胶含量变化
Fig.4 Change of protopectin content in sweetpotato storage roots during storage
2.5 甘薯块根贮藏期间纤维素含量变化
由图5可知,贮藏期间甘薯块根干重中纤维素含量变化波动较大。‘苏薯8号’在贮藏当天纤维素含量显著高于‘南薯88’和‘浙薯13’,贮藏至7 d时纤维素含量上升至最大值95.93 mg/g,但其贮藏前后变化不大。‘南薯88’纤维素含量先升高再降低,贮藏至45 d时上升至最高值97.24 mg/g,此时的纤维素酶活性也达到最高值,之后纤维素可能在酶的作用下降解,含量显著降低。耐贮性好的‘苏薯8号’贮藏102 d后纤维素含量与贮藏前变化不大,其他2个品种甘薯有所增加。
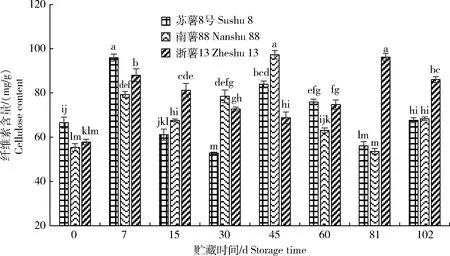
图5 贮藏期间甘薯块根干重中纤维素含量变化
Fig.5 Change of cellulose content in sweetpotato storage roots during storage
2.6 甘薯块根贮藏期间木质素含量变化
由图6可知,贮藏当天‘苏薯8号’干重中木质素含量显著高于‘南薯88’和‘浙薯13’,且在整个贮藏期间变化波动较小,45~102 d一直高于其他2个品种的水平。‘南薯88’和‘浙薯13’分别在贮藏45和30 d时达到最大值,之后变化波动较小。甘薯腐烂高峰期,木质素含量下降快,且耐贮性好的甘薯品种木质素含量高。
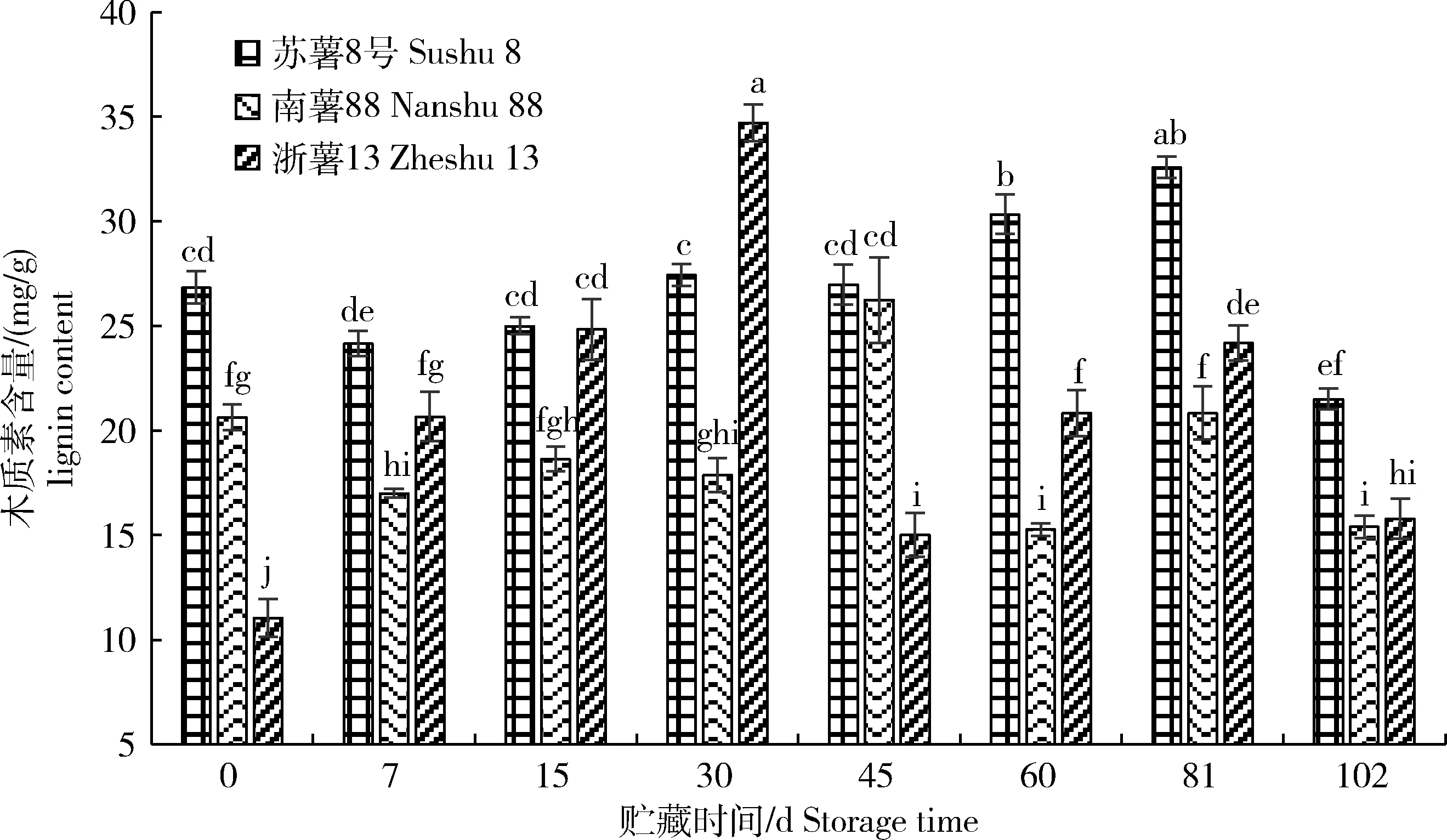
图6 贮藏期间甘薯块根干重中木质素含量变化
Fig.6 Change of lignin content of sweetpotato storage roots during storage
2.7 甘薯块根贮藏期间半纤维素酶(HCL)活性变化
由图7可知,‘苏薯8号’、‘南薯88’、‘浙薯13’贮藏7 d,HCL活性降至最小值,分别为6 816.29、6 835.31 和10 299.09 μg/(g·h),之后呈先上升后下降的波动趋势。‘苏薯8号’和‘浙薯13’在贮藏15 d,HCL活性达到高峰值,分别是15 736.22和19 039.37 μg/(g·h),之后变化平缓,无显著差异;‘南薯88’贮藏45 d,达到最大值18 486.91 μg/(g·h),峰值出现时间晚于其他2个品种,且该时期也是其开始腐烂的时间。但在贮藏过程中,各取样时间点的3个品种甘薯块根HCL活性差异不显著。

图7 贮藏期间甘薯块根鲜重中半纤维酶(HCL)活性变化
Fig.7 Change of hemicellulose enzyme (HCL) activity in sweetpotato storage roots during storage
2.8 甘薯块根贮藏期间纤维素酶(Cx)活性变化
由图8可知,‘苏薯8号’和‘浙薯13’Cx活性在贮藏15 d同时出现高峰值,分别为5 547.21和3 656.75 μg/(g·h),而‘南薯88’出现低峰值,酶活为1 576.67 μg/(g·h),显著低于‘苏薯8号’,贮藏45 d时出现高峰值,达到5 209.02 μg/(g·h),比‘浙薯13’显著高2.02倍。3个品种Cx活性高峰出现时间和HCL相同,且‘南薯88’Cx和HCL活性同时达到高峰的时间点,也是其腐烂的起始点。

图8 贮藏期间甘薯块根鲜重中纤维酶(Cx)活性变化
Fig.8 Change in cellulase (Cx) activity of sweetpotato storage roots during storage
2.9 甘薯块根贮藏期间β-半乳糖苷酶(β-Gal)活性变化
由图9可知,3个品种甘薯块根贮藏期间β-Gal酶活性总体呈上升趋势。‘苏薯8号’β-Gal酶活性在贮藏7 d时下降至最小值0.03 U/g,之后进入快速上升,贮藏30 d时达到最大值0.13 U/g,45 d后变化平缓,无显著差异。‘南薯88’贮藏15 d后 β-Gal 酶活性呈上升趋势,45 d后上升幅度变大,与此同时开始腐烂,贮藏102 d时显著高于‘苏薯8号’2.3倍。‘浙薯13’β-Gal活性变化趋势与‘苏薯8号’相似,但贮藏102 d时,活性显著高于‘苏薯8号’2.5倍。贮藏中后期耐贮性一般的甘薯块根腐烂时,β-Gal活性高,而耐贮性好的‘苏薯8号’β-Gal 活性低且稳定。经相关性分析,得到甘薯块根腐烂率与β-Gal活性呈极显著正相关关系(R=0.614),即β-Gal活性越高,块根越容易腐烂。
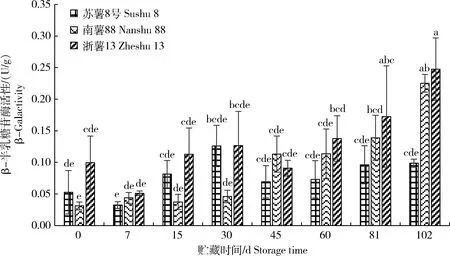
图9 贮藏期间甘薯块根鲜重中β-半乳糖苷酶(β-Gal)活性的变化
Fig.9 Change of β-galactosidase (β-Gal) activity in sweetpotato storage roots during storage
2.10 甘薯块根贮藏期间生理指标相关性分析
由表1可知,腐烂率与失重率、β-Gal活性呈极显著正相关(P<0.01),与木质素含量呈极显著负相关,与Cx酶呈显著正相关。
3 讨论与结论
成熟的植物细胞壁一般由中胶层、初生壁和次生壁3部分组成,具有提高植物机械强度、维持细胞形状等多种功能,其主要组分为果胶、纤维素、半纤维素和木质素[12,22]。果胶主要由2个共同延伸的同型半乳糖醛酸聚糖和鼠李糖聚半乳糖醛酸组成,其大量分支侧链(阿拉伯聚糖,半乳聚糖和阿拉伯糖聚糖)形成果胶的所谓“毛状区域”[23]。半纤维素含有许多杂分子多糖,主要由木聚糖和木葡聚糖组成;纤维素是以β-1,4 -糖苷键连接的葡萄糖多聚物,在细胞壁中形成微纤丝[24]。甘薯块根在贮藏过程中,果胶物质由一些高分子量的、高甲氧基化的果胶多糖转变为低分子的可溶于水的果胶多糖,导致细胞壁中胶层降解,胞壁结构破坏[25]。本研究中,原果胶含量下降,可溶性果胶含量上升,但是3个品种甘薯原果胶含量变化并无显著差异,可能果胶含量并不是影响甘薯耐贮性差异的主要因素。林婕等[6]研究发现,甘薯贮藏后纤维素含量高于贮藏前,纤维素的增加使甘薯感官品质出现变化。贮藏当天‘苏薯8号’的纤维素和木质素含量显著高于其他2个品种,且贮藏中后期木质素含量也高于‘南薯88’和‘浙薯13’,木质素对植物细胞壁起到刚性支撑的物理作用和抵抗疾病的侵袭作用[26]。木质素含量可能是影响甘薯块根耐贮性差异的因素之一,木质素含量高的‘苏薯8号’耐贮性好。
果实采后在贮藏过程中会出现软化腐烂的情况,如苹果果实,其细胞壁含量降低,细胞壁相关代谢酶活性升高[27]。本研究中,Cx活性与腐烂率呈显著正相关。‘苏薯8号’和‘浙薯13’贮藏15 d时Cx和HCL活性同时达到高峰值,而‘南薯88’贮藏 45 d 时Cx和HCL同时达到高峰值,且开始腐烂,失重率上升。Cx分解含1,4 -β-葡萄糖基链的半纤维素基质多糖,破坏果胶-纤维素-半纤维素的网络结构,使果实细胞壁遭到破坏,果实质地软化,进而影响贮藏效果[22, 28]。整个贮藏期内,HCL活性比Cx活性高,与王炜等[29]研究结果相似。嘎啦苹果果实软化过程中,水溶性细胞壁组分增加,细胞壁酶活性增加,且在不同的软化阶段发挥不同作用[30]。姜建中等[31]研究发现桑葚采后自溶,果实质地软化,是由于细胞壁降解酶活性变化,引起细胞壁结构变化,自溶指数高的‘大10’桑椹中的 PE、PG和β-Gal活性显著高于‘白玉王’桑椹。耐贮性差的‘南薯88’在甘薯贮藏中后期腐烂,Cx和HCL共同发挥重要作用,使细胞壁组分和结构发生较大变化,细胞壁遭到破坏,抗逆性降低,进而导致甘薯腐烂。

表1 甘薯块根贮藏期间生理指标相关性分析Table 1 Correlation analysis of physiological indexes of sweetpotato storage roots during storage
注:*和**分别表示在0.05和0.01水平(双尾)上显著相关。
Note: * and ** indicate significant correlations at 0.05 and 0.01 (two-tailed), respectively.
本研究中,β-Gal活性与腐烂率呈极显著正相关,‘南薯88’开始腐烂时,β-Gal活性也逐渐增强,而贮藏中没有腐烂的‘苏薯8号’β-Gal活性低于其他2个品种。β-Gal参与降解细胞壁的半乳糖苷键,既能降解果胶,也能降解半纤维素,同时也能降解糖蛋白和糖脂,使细胞壁中一些组分变得不稳定,促使细胞壁降解[32-33]。甘薯腐烂时,β-Gal活性高,这与柿果采后和苹果贮藏一样[34-35]。腐烂率与β-Gal活性强弱有关,耐贮性好的‘苏薯8号’β-半乳糖苷酶活性低且在贮藏期内稳定,而耐贮性差的‘南薯88’β-半乳糖苷酶活性升高时,易腐烂。
甘薯块根贮藏过程中,细胞壁成分在一系列酶的作用下降解。贮藏后期,未出现腐烂情况的‘苏薯8号’块根中3种酶活性比出现腐烂情况的‘南薯88’和‘浙薯13’低。甘薯贮藏中后期,耐贮性差的‘南薯88’β-Gal活性加强,Cx活性出现高峰,块根进入快速腐烂期,这2种酶对其腐烂影响较大,可能是由于其参与降解细胞壁和中胶层物质,同时β-Gal也可以通过增加细胞壁的孔隙率和增强其他细胞壁降解酶的进入促使甘薯块根组织加速软化,细胞壁结构发生变化,对病原菌等抗逆性降低,进而容易腐烂[36-37]。
总之,通过研究耐贮性不同的3个品种甘薯贮藏过程中细胞壁成分及细胞壁降解酶与腐烂率的关系,结果表明,耐贮性好的‘苏薯8号’有较高的木质素含量,较低的HCL、Cx活性,贮藏中后期β-Gal活性低且稳定。‘浙薯13’和‘南薯88’腐烂高峰期,木质素含量下降快,其贮藏中后期β-Gal活性升高;‘南薯88’开始腐烂时,Cx和HCL活性达到高峰值。甘薯细胞壁降解酶活性升高,加快细胞壁成分降解速度,促使其细胞壁结构改变,完整性下降,抵抗能力减弱,容易腐烂。

