阿托伐他汀通过激活转录因子EB对泡沫细胞自噬及胆固醇含量的影响
张 伟,陈雨露,黄维义,杜延飞,涂 婷,郑舒展
0 引 言
动脉粥样硬化(atherosclerosis,AS)是冠心病的潜在病理过程[1],也是目前导致人类死亡最主要的病因[2-3]。在体内当氧化低密度脂蛋白(oxidized lowdensity lipoprotein, oxLDL)被巨噬细胞大量摄取时,导致巨噬细胞内脂滴含量增加,形成AS特征性的巨噬源性泡沫细胞,最终导致AS形成[4]。减少泡沫细胞形成,抑制AS的进展,是现阶段国内外学者研究的重点。
自噬是指细胞的自我吞噬,在保持细胞稳态中起着重要作用。近年来,大量的研究已将自噬与心血管相关疾病联系起来,并且发现自噬功能障碍会促进AS的进展,上调自噬水平可以抑制AS[5-6]。目前研究最多的为PIK3/AKT/mTOR信号通路对自噬的调节作用。最新研究发现转录因子EB(transcription factor EB,TFEB)在调节自噬减少细胞内脂质,抑制AS上同样起着重要作用[7-8]。 他汀类药物通过抑制3-羟基-3甲基戊二酰辅酶A还原酶减少细胞内胆固醇合成,长期以来被作为AS及高胆固醇血症治疗的常规药物,在降低心血管事件发生率及胆固醇水平上有着良好的效果。有研究发现阿托伐他汀(atorvastatin,ATV)可以通过上调自噬,抑制巨噬细胞炎症反应,减少脂质沉积稳定AS斑块[9-10]。本研究拟探索ATV是否可以通过影响TFEB从而调节巨噬细胞自噬,为ATV在分子机制上治疗AS提供新的见解及策略。
1 材料与方法
1.1 材料
1.1.1 细胞、药物与试剂人单核细胞株THP-1细胞(武汉普诺赛生命科技有限公司,中国);ATV(北京嘉林药业赠,中国);氯喹( MedChemExpress,美国); oxLDL(广州奕源,中国);游离胆固醇/总胆固醇酶法测定试剂盒(北京普利莱基因技术有限公司,中国);荧光标记胆固醇外流试剂分析盒(BioVison,美国);一抗:LC3II/I抗体、P62抗体、LAMP 1抗体、TFEB抗体(CST,美国)、GAPDH内参抗体(BBI Life Sciences,中国);二抗:HRP羊抗兔二抗(BBI Life Sciences,中国);HRP羊抗鼠二抗(BBI Life Sciences,中国)。
1.1.2 仪器CO2恒温培养箱(Heracell 150i,Thermo scientific,美国);超净工作台(SW-CJ-2G,苏州净化,中国);可调微量移液器(Eppendorf公司;德国);超纯水仪(Elix3/Mini-Qbicel,Millipore,美国);低温高速离心机(Eppendorf公司,德国);垂直电泳系统(Mini-PROTEAN Tetra Cell,Bio-Rad,美国);全自动酶标仪(Infinite M200,TECAN,瑞士);凝胶成像系统(Universal-Hood II,Bio-Rad,美国);荧光显微镜(3K85017,Olympus,日本)。
1.2 方法
1.2.1 细胞的培养THP-1细胞生长于RPMI-1640(含有10%胎牛血清、1%青-链霉素)的培养瓶中,放置于5%CO2,37 ℃饱和湿度的培养箱中培养;3~4 d加液1次,当细胞密度>80%后进行传代。
1.2.2 巨噬细胞源性泡沫细胞模型建立THP-1细胞离心去上清液后,加入含100 ng/mL 佛波酯的无血清1640培养基,并将细胞种于6孔板中,放置于5%CO2,37 ℃饱和湿度的培养箱中培养48 h,使THP-1细胞诱导为巨噬细胞。吸净孔板中的含有佛波酯的培养基, PBS清洗2~3遍,加入含有终浓度为50 mg/L oxLDL的3%胎牛血清培养基,放置于培养箱中培养48 h,将巨噬细胞诱导为泡沫细胞。
1.2.3 CCK8法细胞毒性检测当细胞生长良好,密度>80%时,将THP-1细胞以5000个/孔接种于96孔板中,每孔加入200 μL含有佛波酯的无血清培养基,培养48 h,将THP-1细胞诱导为巨噬细胞。吸出培养基并PBS清洗,加入含有不同浓度梯度及50 mg/L oxLDL的药物,培养48 h后吸去培养基,以1∶9配置好CCK8溶液,每孔加入100 μL,培养4 h后于450 nm测量吸光度值。分为空白孔(不含细胞和待测物质的培养基)、实验孔(含有细胞的培养基、待测物质)、对照孔(含有细胞的培养基、无待测物质)、氯喹(0、1、5、10、25、50)μmol/L、ATV(0、1、5、10、25、50)μmol/L,每组设置4个复孔,细胞存活率计算公式如下:
细胞存活率=(实验孔-空白孔)/(对照孔-空白孔)
1.2.4 油红O染色判断细胞内脂滴含量经上一步实验确定氯喹及ATV的使用浓度,将细胞接种于6孔板中,细胞数约为1×107/孔,将其诱导为巨噬细胞后,分为空白组(培养基)、oxLDL组、oxLDL+氯喹组、oxLDL + ATV组、oxLDL+氯喹+ATV组。oxLDL、氯喹、ATV浓度分别为50 mg/L、25 μmol/L、10 μmol/L,每组细胞均先使用药物预处理0.5 h后,加入oxLDL培养48 h。用PBS清洗2~3遍,4%多聚甲醛,37 ℃固定15 min,油红O染色30 min,60%异丙醇漂洗5~10 s,镜下观察并拍照。
1.2.5 氧化酶法检查细胞内游离胆固醇(FC)、总胆固醇(TC)含量细胞接种于6孔板中,具体处理方法同上。之后PBS清洗3遍,每孔加入100 μL细胞裂解液,混匀,碾磨10 min,将裂解液转移至1.5 mL离心管中, 2000×g离心,离心半径10 cm,离心5 min。按照说明书配置工作液以及胆固醇标准品,将190 μL工作液加入96孔板中,并加入10 μL待测样品以及配置好的标准品,37 ℃反应20 min后,于550 nm的波长下测量孔板的A值,绘制标准曲线并计算其浓度,同时测量蛋白浓度以校正FC、TC;CE(胆固醇脂)为TC与FC之差。
1.2.6 胆固醇外流率测定将THP-1细胞接种于96孔板中,每孔加入约1×105个细胞,佛波酯诱导48 h分化为巨噬细胞,按照说明书加入标记试剂培养1 h,在加入配置好的缓冲液培养16 h后,使用不含酚红的1640培养基清洗3遍,各组分别加入药物处理后,荧光显微镜测量细胞上清液荧光强度,并裂解细胞测量细胞裂解物荧光强度,全程细胞处理均需避光,培养基使用不含酚红的1640培养基;胆固醇流出率计算公式如下:
胆固醇流出率=上清液荧光强度/(上清液荧光强度+细胞裂解物的荧光强度)×100%
1.2.7 Western blot法检测LC3II/I、P62、LAMP 1、TFEB的蛋白含量各组细胞培养干预结束后,PBS清洗3遍,采用BCA法测定蛋白浓度,校正蛋白浓度,加入上样缓冲液后混匀, 100 ℃沸水变性10 min, -20 ℃保存。取20 μg蛋白,SDS-PAGE电泳后,将蛋白转模值PVDF膜上,加入5%脱脂牛奶封闭,加入对应的一抗:LC3II/I、P62、LAMP 1、TFEB(1∶800稀释)、GAPDH(1∶8000稀释),4 ℃冰箱过夜,24 h取出并TBST清洗3次,每次约10 min,加入相应的二抗室温下水平脱色摇床孵育2 h,TBST清洗3次,每次约10 min。增强化学发光试剂显影。以quantity one 图像分析软件对图片进行分析,以目的蛋白与内参GAPDH的比值表示蛋白相对表达量。

2 结 果
2.1巨噬源性泡沫细胞模型鉴定THP-1细胞加入含100ng/mL的佛波酯诱导48 h后,镜下观察细胞呈现不规则形态或椭圆形并伸出伪足,且贴壁生长,证明巨噬细胞已诱导成功,见图1。加入50 mg/L oxLDL培养48 h后,油红O染色可见细胞内有大量红色脂滴存在, CE/TC>50%,证明巨噬源性泡沫细胞模型建立成功。
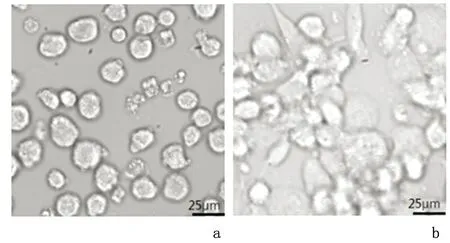
a:THP-1细胞;b:巨噬细胞
图1 THP 1细胞经佛波酯诱导48 h后的变化( ×400)
Figure 1 THP 1 cells were transformed into macrophages after 48 h of PMA induction ( ×400)
2.2 确定ATV及氯喹对细胞的合适处理剂量当氯喹浓度>25 μmol/L时,细胞存活率有所下降,ATV浓度>10 μmol/L,细胞存活率有所下降(P<0.01)。因此后续实验选择氯喹及ATV的浓度分别为25 μmol/L、10 μmol/L。见图2。
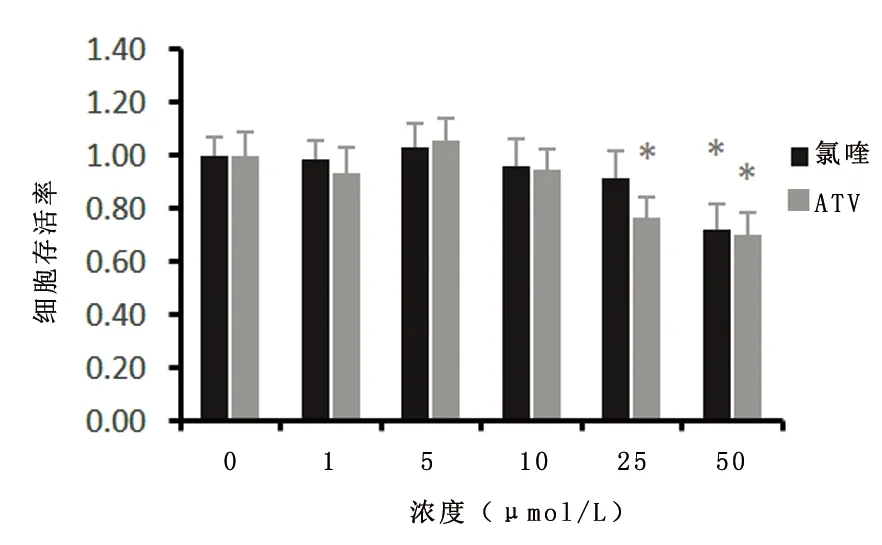
与 0 μmol/L 比较,*P<0.01
图2 CCK8测量氯喹及ATV的细胞毒性
Figure 2 CCK8 measures cytotoxicity of CQ and ATV
2.3 细胞油红O染色结果油红O染色后光镜下可见,空白组巨噬细胞内可见少量红色脂滴;oxLDL组细胞内含有大量红色脂滴,泡沫细胞形成;oxLDL+氯喹组细胞内脂滴较oxLDL组、oxLDL+氯喹+ATV组增加,而oxLDL+ATV组细胞内脂滴较oxLDL组降低。见图3。
2.4 各组细胞内FC、TC、CE/TC含量及细胞胆固醇外流率比较oxLDL+ATV组、空白组细胞内FC、TC、CE、CE/TC含量较oxLDL组明显降低(P<0.05);oxLDL+氯喹+ATV组细胞内FC、TC、CE、CE/TC含量较oxLDL+氯喹组明显降低(P<0.05);oxLDL+氯喹组FC、TC、CE、CE/TC含量较oxLDL组明显升高(P<0.05)。与oxLDL组细胞胆固醇外流率比较,oxLDL+氯喹组明显降低(P<0.05),空白组、oxLDL+ATV组明显升高(P<0.05);与oxLDL+氯喹组细胞胆固醇外流率比较,oxLDL+氯喹+ATV组明显增加(P<0.05)。见表1。
2.5 泡沫细胞LC3II/I、P62、LAMP 1、TFEB蛋白的表达与oxLDL组比较,oxLDL+氯喹组、空白组LC3II/I、P62、TFEB蛋白表达量明显升高(P<0.05),oxLDL+氯喹组LAMP1蛋白表达亦升高(P<0.05);oxLDL+ ATV组细胞LC3II/I、TFEB、LAMP1水平明显升高,P62水平明显降低(P<0.05)。与oxLDL+氯喹组比较,oxLDL+氯喹+ ATV组LC3II/I、P62蛋白表达水平明显降低,TFEB、LAMP1蛋白表达水平明显升高(P<0.05)。见图4,表2。

a:空白组;b: oxLDL组;c:oxLDL+氯喹组;d:oxLDL+ATV组;e:oxLDL+氯喹+ ATV组
图示oxLDL+氯喹组细胞内脂滴较oxLDL组、oxLDL+氯喹+ATV组增加,而oxLDL+ATV组较oxLDL组降低
图3 油红O染色观察各组细胞内红染脂滴含量变化( ×200)
Figure 3 Oil red O staining was used to observe the changes of red dye lipid droplets in each group ( ×200)
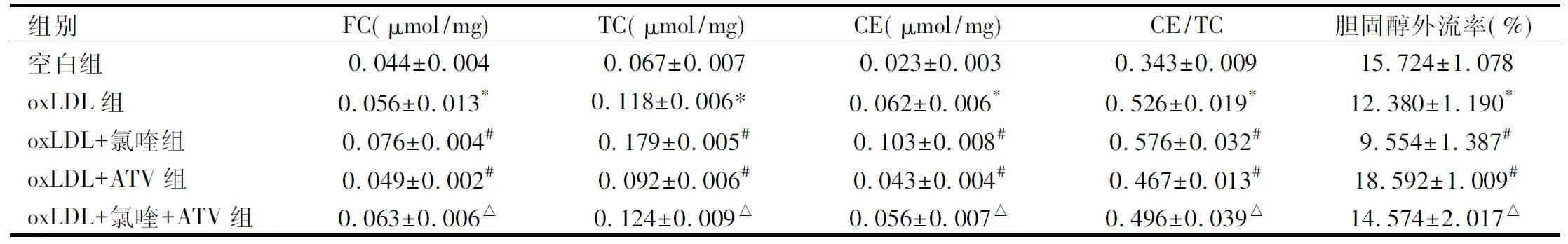
组别FC(μmol/mg)TC(μmol/mg)CE(μmol/mg)CE/TC胆固醇外流率(%)空白组0.044±0.0040.067±0.0070.023±0.0030.343±0.00915.724±1.078oxLDL组0.056±0.013*0.118±0.006*0.062±0.006*0.526±0.019*12.380±1.190*oxLDL+氯喹组0.076±0.004#0.179±0.005#0.103±0.008#0.576±0.032#9.554±1.387#oxLDL+ATV组0.049±0.002#0.092±0.006#0.043±0.004#0.467±0.013#18.592±1.009#oxLDL+氯喹+ATV组0.063±0.006△0.124±0.009△0.056±0.007△0.496±0.039△14.574±2.017△
与空白组比较,*P<0.05;与oxLDL组比较,#P<0.05;与oxLDL+氯喹组比较,△P<0.05

1:空白组;2:oxLDL组;3:oxLDL+氯喹组;4:oxLDL+ATV组;5:oxLDL+氯喹+ATV组
图4 各组泡沫细胞LC3II/I、P62、TFEB、LAMP 1蛋白表达量
Figure 4 Protein expression levels of LC3II/I, P62, TFEB, and LAMP 1 in each group



组别 LC3II/IP62 TFEB LAMP1空白组1.157±0.0440.242±0.0090.392±0.0100.821±0.029oxLDL组1.006±0.052*0.183±0.013* 0.333±0.020*0.835±0.022 oxLDL+氯喹组1.594±0.017#0.257±0.006#0.477±0.024#0.957±0.026#oxLDL+ATV组1.146±0.060#0.115±0.009#0.540±0.031#1.027±0.054#oxLDL+氯喹+ATV组 1.419±0.036△ 0.165±0.006△0.593±0.016△ 1.060±0.046△
与空白组比较,*P<0.05;与oxLDL组比较,#P<0.05;与oxLDL+氯喹组比较,△P<0.05
3 讨 论
AS是一种慢性的血管炎症疾病,涉及许多循环免疫细胞,包括单核细胞、淋巴细胞、血小板等[11-12],尤其是单核细胞及其诱导的巨噬源性泡沫细胞在这当中起着至关重要的作用[13],过度的脂质沉积致使巨噬细胞内胆固醇脂堆积,诱导泡沫细胞形成,并且胆固醇的摄取及外流在泡沫细胞的形成过程也中发挥着重要作用[14-15]。本研究中THP-1细胞使用佛波酯诱导为巨噬细胞,加入oxLDL处理48h后油红O染色观察巨噬细胞内可见大量红色脂滴,胆固醇外流率明显降低,CE/TC>50%,证明泡沫细胞模型构建成功。
自噬是一个高度进化保守的过程,是将细胞质成分运送到溶酶体中降解,在延长细胞寿命以及集聚脂质的降解和循环中发挥着关键作用[16-17]。微管相关蛋白1轻链3 (LC3)及P62/SQSTM1为自噬研究的重要蛋白,其中LC3是哺乳动物自噬发生的标志性蛋白,LC3通过自噬相关基因(autophagy related genes,ATG)裂解暴露甘氨酸残基生成LC3I,在复合物ATG5-ATG12-ATG16(L)的作用下,最终转变为LC3II,检测LC3I向LC3II转化的水平(LC3II/I)可反映自噬水平[18-20]。P62也称为SQSTM1,可与LC3泛素化的底物连接,整合到自噬体中,转运到自噬溶酶体中被降解[21]。而进一步对自噬研究发现自噬溶酶体的功能状态在减少AS的形成上有着至关重要的作用[7-8]。目前研究证实了TFEB是现阶段唯一已知的驱动自噬基因表达的转录因子,增强TFEB可以增加自噬与自噬溶酶体生发逆转巨噬细胞的自噬功能障碍,是抑制AS的重要过程,并且发现TFEB驱动的AS保护受LC3和P62依赖[7,22-24]。因此,本研究同时观察TFEB、LC3、P62以及自噬溶酶体的变化是研究AS所需。
ATV是目前临床上使用最广泛且研究最多的他汀类药物,在防治AS、稳定斑块等方面有着不可替代的作用。本研究采用oxLDL诱导巨噬细胞转变为泡沫细胞,既往研究认为oxLDL对自噬的影响存在争议,但本研究发现oxLDL使自噬相关蛋白LC3II/I、P62及TFEB均为下降,认为oxLDL做为一种自噬抑制剂在发挥作用,致使细胞内脂滴及胆固醇含量升高、胆固醇外流率降低,泡沫细胞形成。本研究在加入ATV后,实验组LC3II/I增强,P62减弱,这表明ATV增强了泡沫细胞自噬,致使泡沫细胞胆固醇外流有所增加,细胞内胆固醇及脂滴含量减少,泡沫细胞的数量减少。同时发现ATV可增强TFEB及溶酶体相关膜蛋白1的表达,增强自噬溶酶体表达。
本研究为了进一步确定ATV可通过影响自噬来减少泡沫细胞形成,在实验中使用氯喹[25]来抑制自噬,在加入氯喹后,oxLDL+氯喹组LC3II/I及P62蛋白表达较oxLDL组明显升高,表明自噬受到抑制,加入ATV共同孵育后,我们观察到自噬相关蛋白LC3II/I及P62的表达有所降低,这表明ATV削弱了氯喹对泡沫细胞的自噬抑制作用,泡沫细胞受损的自噬功能得以修复,细胞内脂滴及胆固醇含量降低,胆固醇外流率增加,泡沫细胞形成减少。同时本研究也发现氯喹可以明显促进TFEB的表达,这是因为TFEB的表达受溶酶体功能及PH值的影响[26-27],这也提示我们TFEB的调控及自噬是复杂的,且自噬是一个变化的过程,动态的观察TFEB、自噬及自噬溶酶体的表达及功能状态是必要的。
综上所述,本研究发现自噬的下调可使巨噬细胞脂质代谢紊乱,泡沫细胞大量形成,而ATV可以增强巨噬细胞自噬及自噬溶酶体表达,减少巨噬细胞内脂滴及胆固醇含量,增加胆固醇外流,抑制泡沫细胞形成,其机制可能与ATV影响TFEB相关。本研究为ATV的分子机制及其在AS治疗中的新作用提供新见解,同时利用自噬治疗AS,可能是AS治疗的一个发展策略,但其具体机制还有待进一步研究。

