HBV激活转化生长因子β1/Nur77信号通路对肝纤维化的促进作用
李文庭,肖 珲, 杨 亮,音 铭,刘 齐
0 引 言
肝纤维化是肝对各种损伤因素的修复应答。这些损伤因素包括肝炎病毒、酒精、药物、免疫复合物、代谢物(脂肪)等。肝纤维化的特征是细胞外基质(extracellular matrix, ECM)的大量产生超过降解,从而沉积在肝导致肝结构和功能的改变。目前公认,肝星状细胞(Hepatic stellate cell,HSCs)是ECM的主要效应细胞,其活化是肝纤维化的关键因素。因此,抑制HSCs的活化可以延缓或逆转肝纤维化[1]。在促进肝纤维化进展的各种信号通路和细胞因子中,转化生长因子β1(transforming growth factor-β1,TGF-β1)被认为是最重要的细胞因子[2]。在肝损伤过程中,肝实质细胞释放TGF-β1,后者刺激HSCs活化,产生大量的胶原纤维,启动肝纤维化进程。经典的TGF-β1通路主要是通过Smads实现, 但是随着研究的深入,学者们发表越来越多的细胞因子在TGF-β1/Smads通路中发挥重要作用, 如Nur 77[3-4]。但是对于Nur 77在肝纤维化中的作用罕见报道。
乙型肝炎病毒(hepatitis B virus,HBV)感染是全球性的健康问题,全世界仍有将近4亿携带者[5]。慢性HBV感染易启动肝纤维化进展并发展为肝硬化甚至肝癌。关于HBV相关肝纤维化的机制研究较少。本研究拟探讨TGF-β1/Nur 77信号通路在乙肝肝纤维化中的作用。
1 材料与方法
1.1 主要试剂与材料0.4 μmol/L Transwells 购自美国Costar公司,实验用胎牛血清购于Gibco公司(美国), 含糖DMEM培养基购于Hyclone公司(美国), 质粒抽提试剂盒、RNA及DNA抽提试剂盒均购自Qiagen公司(美国)。RT试剂盒(高效cDNA逆转录试剂盒) 购自Applied Biosystems公司(美国)。pCMV6-NTCP,Nur77 gRNA及对照质粒(neo)均购于Origene公司(美国,RC210241)。鼠抗α-SMA购于Abcam公司(ab5694),兔抗Col1A1购于Thermo Fisher Scientific公司(MAI-141),兔抗TIMP-1购于Cell signaling公司 (D10E6),兔抗NTCP 购于SANTA CRUZ公司(sc-98484,美国), 兔抗Nur 77抗体分别购于美国和中国(NB100-56745, Novus,美国; BS3260, 巴傲德,南京), 鼠抗β-actin购于Abcam公司(ab8227),二抗购于GE Healthcare公司(英国)。实验中所用的Huh 7.5.1细胞,HepAD38细胞及人肝星状细胞LX-2细胞均由本实验室保存。重组人TGF-β1蛋白购自R&D System公司(240-B/CF)。
1.2方法
1.2.1 组织标本来源选取在中国科学技术大学附属第一医院(安徽省立医院) 感染病院的8例住院慢性乙型肝炎患者的肝组织标本。纳入标准:既往未接受过抗病毒治疗;诊断标准符合慢性乙肝防治指南[6]。排除标准:合并其他嗜肝病毒感染,如丙肝病毒、戊肝病毒及艾滋病毒等;肿瘤;合并其他器官严重损害。入组患者行生化、HBV DNA 定量、HBV血清学及病毒学检查,肝穿刺术。所取肝组织行进一步病理检查。
1.2.2组织病理学及免疫组化使用巴德活检枪针(18 G, 910 cm,美国),通过肝穿刺采集患者肝组织。将患者肝组织固定于10%甲醇中,石蜡包埋切片。行HE和Masson′S染色。患者肝纤维化分期采用Metavir标准:S0:无纤维化; S1:少量纤维;S2:纤维组织向小叶外延伸;S3:桥形纤维化;S4:假小叶形成,肝硬化[7]。同时,将组织切片用内源性过氧化物酶和牛血清白蛋白封闭后,使用Nur77抗体4 ℃孵育过夜,次日,将切片用PBS洗净,在37 ℃下复温30 min;然后将切片与HRP标记的羊抗兔二抗(稀释至1∶200)在37 ℃中孵育30 min[8],PBS洗净后苏木精复染,最后将切片再次洗净,显微镜下观察。
1.2.3细胞培养与病毒制备Huh 7.5.1、 Hep AD38及LX-2 细胞均在含10%胎牛血清的DMEM培养基中培养。培养箱温度设为37 ℃,CO2的浓度为5%(v/v)。本研究使用的乙肝病毒来源于Hep AD38 细胞上清液。Hep AD38 常规培养时加G418, 终浓度为200 μg/mL。收集病毒时,停用G418,培养3 d后收集上清,4 ℃保存备用。
1.2.4质粒的抽提与转染pCMV6-NTCP、Nur 77 gRNA及对照质粒(neo)的抽提使用质粒抽提试剂盒(Qiagen公司),操作步骤按照说明书进行,实验结束,测质粒浓度,双蒸水稀释至1 μg/μL,-20 ℃保存备用。pCMV6-NTCP、Nur 77 gRNA及对照质粒(neo)的转染使用Lipofectamine LTX reagent(Life Technologies, USA)。先将1 μg质粒(pCMV6-NTCP、Nur 77 gRNA及neo)与0.5 μL PLUSTMReagent混匀,溶于培养基中,静置5 min;同时,将LTX Reagent 2 μL溶于培养基中,静置5 min;然后将两者混匀,加入到细胞中。比例如下:质粒(μg)∶PLUSTMReagent (μL)∶LTX Reagent (μL)=1∶0.5∶2, 具体操作见说明书。细胞转染质粒如下:NTCP-Huh 7.5.1细胞(转染pCMV6-NTCP的Huh 7.5.1细胞),LX-2-neo (LX-2转染对照质粒neo),LX-2-Nur77gRNA(LX-2转染Nur77gRNA)。
1.2.5NTCP-Huh7.5.1细胞的鉴定及HBV感染模型的建立将Huh 7.5.1按照5×104细胞/mL接种于12孔版,24 h后转染pCMV6-NTCP,72 h后收集细胞蛋白,检测NTCP蛋白的表达。将收集的HBV病毒液加入NTCP-Huh 7.5.1细胞中,72 h后,收集细胞上清液总的DNA及细胞RNA。
1.2.6TGF-β1刺激LX-2细胞将LX-2细胞按照5×104细胞/mL接种于12孔版,24 h后换液,加用TGF-β1刺激72 h (终浓度为10 ng/mL)。换液后再分别转染Nur77gRNA及对照质粒 (neo),24 h后换液,加用TGF-β1刺激72 h (终浓度为10 ng/mL)。分为LX-2-neo组(LX-2转染neo)、LX-2-neo+TGF-β1组(LX-2转染neo后TGF-β1刺激)、LX-2-Nur 77 gRNA+TGF-β1组(LX-2转染Nur 77 gRNA后TGF-β1刺激)。实验结束后收集各组细胞RNA及蛋白质,检测细胞Nur 77、α-SMA、TIMP-1及CoL1A1 mRNA及蛋白表达。
1.2.7细胞共培养体系的建立NTCP-Huh 7.5.1与LX-2 细胞共培养采用Transwell系统。将HBV感染的NTCP-Huh 7.5.1细胞按照2×104细胞/1 mL接种于Transwell的下室,将转染NR4A1 gRNA后的LX-2 细胞按照1×104细胞/0.5 mL接种于Transwell的上室,孵育72 h后,收集细胞进行RNA及蛋白质提取。根据转染方式不同分为:LX-2-neo组(LX-2转染对照质粒)、LX-2-neo+ HBV组(LX-2转染对照质粒与HBV感染的NTCP-Huh 7.5.1细胞共培养)、LX-2-Nur77gRNA+ HBV组(LX-2转染Nur 77 gRNA与HBV感染的NTCP-Huh 7.5.1细胞共培养)。
1.2.8逆转录PCR(RT-PCR)及定量PCR(qPCR)细胞RNA的提取使用RNA抽提试剂盒(Qiagen公司, 美国),具体操作步骤参照说明书。RT按照说明书操作进行。qPCR在ABI QuantStudio©3 system (Applied Biosystems Inc)中完成。使用SYBR Green Master Mix (Thermo Fisher Scientific, Waltham, USA)标记。通过△△Ct与作为内部对照的GAPDH进行比较,测算目标基因表达 相对量。引物序列如下:α-SMA,F(5′-3′)AAAAGACAGCTACGTGGGTGA,R(5′-3′)GCCATGTTCTATCGGGTACTTC;TIMP-1,F(5′-3′) ACTTCCACAGGTCCCACAAC,R(5′-3′) GCTAAGCTCAGGCTGTTCCA;Col1A1,F(5′-3′) CAGCCGCTTCACCTACAGC,R(5′-3′) TCAATCACTGTCTTGCCCCA;TGF-β1,F(5′-3′) CTCTCCGACCTGCCACAGA,R(5′-3′) AACCTAGATGGGCGCGATCT;NR4A1,F(5′-3′) GGCATGGTGAAGGAAGTTGT,R(5′-3′)CAGGGAAGTGAGGAGATTGG;HBV,F(5′-3′)GGAAAGAAGTCAGAAGGCAA, R(5′-3′)CACCTCTGCCTAATCATC;GAPDH, F(5′-3′) TCACCACCATGGAGAAGGC, R(5′-3′) GCTAAGCAGTTGGTGGTGCA。
1.2.9Western-blot细胞蛋白质的提取使用试剂盒。提取的蛋白质通过在10%SDSPAGE凝胶上运行,并在聚偏氟乙烯膜(PVDF)上电转移。用5%牛血清清蛋白孵育后,用一抗在4 ℃孵育过夜。用TBST溶液(Tris 10 mm,NaCl 150 mm,Tween-20 0.05%(v/v))洗涤后,用HRP标记的山羊抗兔二级抗体孵育1 h。然后用TBST再次清洗斑点,然后用ECL染色。通过与β-actin条带的比较,对相关表达进行定量。

2 结 果
2.1肝纤维化分期及免疫组织化学染色检测肝组织Nur77表达S1期肝组织可见大致正常肝组织及少量纤维形成。S2期肝组织可见肝小叶结构破坏,纤维组织向小业内延伸; S3期肝组织结构紊乱,可见桥形纤维化; S4期肝组织可见肝小叶结构破坏和假小叶形成。见图1。免疫组化结果显示,随着纤维化分级的增加,肝组织Nur77表达增强。见图1。

a-d:肝结构(HE ×100);e-h:胶原(Masson ×100); i-l:肝组织Nur 77的表达(免疫组化染色 ×200)
图示随着肝纤维化分期的增加,肝组织Nur77表达增强
图 1 肝组织学变化及免疫组织化学染色检测不同分期肝组织Nur77的表达
Figure 1 Liver pathologyand Nur 77 expressionin liver tissue with different fibrosis score
2.2NTCP-Huh 7.5.1 细胞的构建以及HBV感染测定Western blot检测显示,正常Huh 7.5.1细胞不表达NTCP,转染pCMV6-NTCP后,Huh7.5.1 细胞高表达NTCP,见图2。
qPCR结果显示,HBV感染后72 h,NTCP-Huh 7.5.1上清中HBV DNA水平(×103copies/mL)明显升高[(5.39±0.96)vs(0.00±0.00),P<0.05],同时细胞中TGF-β1mRNA水平明显升高[(1.94±0.37)vs(1.00±0.00),P<0.05]。
2.3TGF-β1/Nur77 信号通路对LX-2活化的影响qPCR结果显示,TGF-β1刺激LX-2 细胞72h后, Nur 77,α-SMA, TIMP-1及CoL1A1mRNA表达明显高于无TGF-β1刺激的LX-2细胞(P<0.05)。见表1。此外,与LX-2-neo组Nur 77、 α-SMA、TIMP-1、CoL1A1表达比较,LX-2-neo+ TGF-β1组明显升高(P<0.01)。LX-2-Nur 77 gRNA+ TGF-β1组Nur 77、α-SMA、TIMP-1、CoL1A1表达较LX-2-neo+ TGF-β1组明显降低(P<0.01)。见表2。Western-blot结果表明,敲除LX-2细胞Nur 77后,TGF-β1刺激无法增强LX-2细胞α-SMA,、TIMP-1及CoL1A1 mRNA和蛋白表达。见图3。

1:Huh 7.5.1; 2:NTCP-Huh 7.5.1
图 2 Western-blot 检测NTCP 表达
Figure 2 Expression of NTCP in Huh 7.5.1 and NTCP-Huh 7.5.1 cells by Western-blot


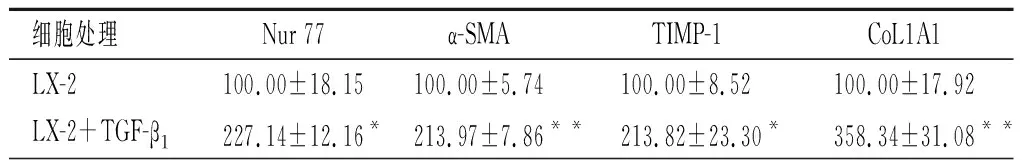
细胞处理Nur 77α-SMATIMP-1CoL1A1LX-2100.00±18.15100.00±5.74100.00±8.52100.00±17.92LX-2+TGF-β1227.14±12.16*213.97±7.86**213.82±23.30*358.34±31.08**
与LX-2比较,*P<0.01、**P<0.001

图 3 Western-blot检测LX-2 细胞蛋白表达
Figure 3 Protein expression in LX-2 cells by Western-blot
2.4敲除LX-2细胞的Nur 77对HBV活化LX-2的影响qPCR表明,与LX-2-对照质粒组 Nur 77、α-SMA、 TIMP-1及CoL1A1表达比较,LX-2-neo+ HBV组均明显升高(P<0.01);与LX-2-neo+ HBV组Nur 77、α-SMA、TIMP-1及CoL1A1表达比较,LX-2-Nur77gRNA+ HBV组明显降低(P<0.01)。见表2。Western-blot结果表明,敲除LX-2细胞的Nur 77后,与HBV感染的NTCP-Huh 7.5.1共培养无法增强LX-2细胞Nur 77、α-SMA、TIMP-1及CoL1A1蛋白表达。见图4。

图 4 Western-blot检测LX-2 细胞蛋白表达
Figure 4 Protein expression in LX-2 cells by Western-blot



组别Nur 77α-SMATIMP-1CoL1A1LX-2-neo组100.00±27.27100.00+10.81100.00±8.55100.00±22.31LX-2-neo+ TGF-β1组204.63±38.24**227.72±13.23*216.00±13.20**330.07±71.63**LX-2-Nur 77 gRNA+ TGF-β1组44.77±5.94*##102.93±15.12#110.15±6.22##110.29±14.84##LX-2-对照质粒组100.00±26.14100.00±22.18100.00±3.55100.00±2.76LX-2-neo+ HBV组199.10±12.84▲▲205.60±49.53▲213.16±14.93▲▲271.77±31.05▲▲LX-2-Nur77gRNA+ HBV组42.07±3.53▲☆96.63±15.20☆☆95.58±11.27☆108.97±12.41☆
与LX-2-neo组比较,*P<0.01、**P<0.001;与LX-2-neo+TGF-β1组比较,#P<0.01、##P<0.001; 与LX-2-对照质粒组比较,▲P<0.01、▲▲P<0.001;与LX-2-neo+ HBV组比较,☆P<0.01、☆☆P<0.001
3 讨 论
肝纤维化是肝对慢性损伤的愈合反应。在我国,慢性仍是肝纤维化的主要诱因。尽管疫苗的广泛接种显著降低了HBV的感染率,慢性HBV感染仍不可避免地会发展为肝纤维化甚至肝硬化。大量研究证实,TGF-β1对星状细胞的活化是肝纤维化的核心。随着研究的深入,发现,众多因子在TGF-β1信号的信号传导中发挥重要作用[4,9], 如Nur 77。 Nur 77,又被称为 TR3, NR4A1或者NGF-IB,属于类固醇激素受体超家族[10]。Nur 77参与了一系列生物学进程,包括糖及脂肪代谢,细胞凋亡,血管内平衡及纤维化等[4, 11-12]。因此,本研究探索了TGF-β1/Nur 77在HBV诱导的星状细胞活化中的作用,为乙肝肝纤维化的治疗提供新的靶点。
本研究初步观察了8例在我院行肝穿的慢乙肝初治患者,评估了肝纤维化程度与Nur77 表达的关系,发现Nur77在肝脏的表达随着肝纤维化程度的增加而增强,提示Nur 77在乙肝肝纤维化进程中可能发挥一定的作用。为了深入研究HBV及其相关疾病,科学家们建立了多种细胞模型,如Hep AD38, 这是一种通过基因手段改造后的细胞,可分泌D型HBV,其缺点是不能模拟HBV的自然感染过程。钠离子牛磺胆酸共转运蛋白(sodium taurocholate cotransporting polypeptide,NTCP)是HBV的功能性受体,HBV可借此感染肝细胞[13]。科学工作者也尝试在肝细胞中过表达NTCP以建立HBV体外感染模型,并取得了丰硕的成果[14]。本研究显示,感染72小时,NTCP- Huh 7.5.1上清中 HBV DNA水平为5.39±0.96×103copies/ml,明显高于对照 (P<0.01),说明NTCP-Huh 7.5.1细胞能支持HBV复制,这与课题组前期结果相符[15]。qPCR结果显示,HBV 感染后的NTCP-Huh 7.5.1高表达TGF-β1,明显高于正常培养的NTCP-Huh 7.5.1(P<0.01),而TGF-β1被认为是肝纤维化的重要促进因子[16]。
本研究使用TGF-β1刺激人肝星状细胞(LX-2)后,LX-2细胞高表达Nur 77,同时,肝纤维化指标α-SMA, TIMP-1及CoL1A1 mRNA表达明显升高。使用gRNA敲除LX-2细胞Nur 77后,即使再使用TGF-β1刺激,肝纤维化指标仍无明显升高,这说明TGF-β1通过Nur 77启动肝纤维化进程。
为深入探索细胞间相互作用在肝纤维化进程中的作用,学者们开发出了细胞共培养系统。在这个系统中,可以将肝细胞与肝星状细胞共培养,两种细胞由0.4um的膜隔开,但可以发生物质交换和信号传导[17]。本研究结果显示, 与感染HBV的Huh 7.5.1细胞共培养后, LX-2细胞明显活化, α-SMA, TIMP-1及CoL1A1 mRNA表达明显升高, 敲除LX-2细胞Nur77后, 肝纤维化指标表达明显下降, 说明HBV启动TGF-β1/ Nur77信号通路促进肝纤维化进展。
综上所述,本文从细胞水平以及组织学两个层面初步证实了HBV感染可能对TGF-β1/ Nur77信号通路的促进作用,并通过活化肝星状细胞促进肝纤维化进展。但仍需要扩大样本量并进行动物实验进一步明确TGF-β1/ Nur77信号通路在乙肝肝纤维化中的作用及机制,以期为将来为乙肝肝纤维化的药物开发提供理论依据。

