基于磁共振表观扩散系数图的影像组学模型
对前列腺癌Gleason分级的诊断价值
许 晴1 陆大军2* 袁为标2 李海峰2 许明明2 高 辉2
前列腺癌是最常见的恶性肿瘤之一,死亡率在欧美国家男性恶性肿瘤的第2位[1]。准确预测前列腺癌侵袭性对制定个体化治疗方案并评估其预后十分重要。前列腺癌Gleason评分是国际公认参考评分系统[2]。目前术前常规影像学方法能对大多数前列腺癌做出准确诊断,但对术前分级有一定限度。表观扩散系数(apparent diffusion coefficient,ADC)可以对病灶进行定量分析,在前列腺癌方面的诊断尤其重要,且有助于诊断肿瘤的侵袭性[3]。影像组学利用大量自动化数据特征化算法将图像转化为可以进行进一步处理的特征空间数据,能够对肿瘤病变内在的异质性进行定量分析并与病理分级进行关联[4]。本文应用影像组学方法,提取大量特征,旨在探讨基于ADC图像的影像组学模型对诊断前列腺癌侵袭性的价值。
方 法
1.临床资料
收集2018年1月-2019年5月在建湖人民医院符合以下标准的患者。纳入标准:①行前列腺MRI检查,且检查前未经过穿刺,放疗或内分泌治疗;②MRI检查后1个月内经穿刺活检确诊为前列腺癌,并经Gleason评分者。排除标准:图像质量不能满足诊断要求。共42例男性患者最终纳入本次研究,年龄57~87岁,中位年龄70岁。
2.MRI检查方法
采用美国GE Discovery MR 750 1.5 T 磁共振仪,患者均行常规磁共振成像(T1WI、T2WI)和DWI扫描检查。常规扫描中行前列腺局部薄层轴位和冠状位扫描,T1WI扫描参数为TR/TE450/12、层厚5mm、层距0.5mm、FOV24cm、NEX4、 矩 阵 192×256;T2WI扫 描 参 数 为 TR/TE3800/85、ETL19、 层 厚 5mm、 层 距 0.5mm、FOV24cm、NEX4、矩阵 320×256。DWI扫描采用轴位单次激发平面回波序列扫描,扫描参数为TR2500,TE70.2ms,矩阵 128×64,激励次数1~10,FOV24cm,层厚4mm,间隔0mm,b值取2000s/mm2。扫描完成后自动重建出表观弥散系数(ADC)图。
3.图像分析
在本院PACS系统中以DICOM格式导出所有纳入病人的前列腺ADC影像资料。由2名具有10年泌尿系统影像诊断经验的影像科医生共同阅片,将 ADC 图 导 入 ITK—Snap 软 件 (version3.8.0,www.itksnap.org)进行 ROI勾画。勾画以手动的方式在轴位图像上进行,选择肿瘤面积最大层面进行勾画。勾画过程中避开尿道、精囊根部、血管、钙化或出血区,具体见图1。将勾画完成的图像和原始图像分别导入A.K.软件(Artificial Intelligent Kit,GE Health)提取病灶纹理特征,共396个特征,其中包括6类特征:直方图特征(Histogram Features)、形态学特征(Form Factor Features)、灰度共生矩阵特征(GLCM Features)、基于灰度共生矩阵的Haralick特征、游程矩阵特征(RLM Features)、灰度连通区域矩阵特征(GLSAZM Features)。
4.统计方法
使用R语言软件进行统计学分析。采用用LASSO(least absolute shrinkage and selection operator)回归模型进行降维获取影像组学特征[5],通过LASSO选取的特征与对应加权系数乘积的线性组合建立鉴别中低危、高危前列腺癌的模型,并建立相应的模型,运用ROC下面积、敏感度、特异度、准确率、阳性预测值和阴性预测值对分类器性能进行评估。
5、临床效能评价
对影像组学模型构造决策曲线以分析在不同风险阈值下的净获益情况[6]。
结 果
1、病理分级
根据前列腺癌穿刺术标本Gleason评分,其中6分10例、7分11例、8分6例、9分13例、10分2例,将病灶分为高危组(Gleason评分≤7)和中低危组(Gleason评分≥8)。本组中前列腺癌高危组病灶21个,中低危组病灶21个。
2、纹理特征分析
应用AI-Kit软件于ADC图像上提取396个定量影像特征参数,应用LASSO回归对ADC图像进行特征参数的筛选,logistic回归对筛选好的参数建立影像生物学标志,并建立相应的模型。LASSO回归选择了7个纹理参数(图2),包含一个基于灰度共生矩阵的Haralick特征(Inverse Difference Moment_AllDirection_offset4),两个游程矩阵特征(Long Run Emphasis_angle45_offset4、Long Run High Grey Level Emphasis_ angle 45_offset1),两个纹理特征(ClusterShade_AllDirection_offset7_SD、Cluster Shade_AllDirection_offset4_SD),两个灰度共生矩阵特征(GLCM Energyangle 135_of fset 7、GLCM Entropy_angle1 35_of fset 7),具体特征参数及其对应的相应系数值见(图3),常数项系数为-0.0265。训练组中,中低危组患者影像组学标签为 -0.881±0.769,高危组标签为0.893±0.822,高危组影像组学标签值大于中低危组,差异有统计学意义(P<0.01);验证组中,中低危组和高危患者影像组学标签值分别为为 -0.548±0.326 和 0.463±0.696,差异也具有统计学意义(图4);通过LASSO选取的特征与对应加权系数乘积的线性组合建立鉴别中低危、高危前列腺癌的模型,并建立相应的模型,训练组ROC下面积为0.97(95%可信区间为0.93~1.00),敏感度为93.3%,特异度为93.3%,模型准确率为93.3%,阳性预测值为0.93,阴性预测值为0.93;在验证组ROC下面积为0.97(95%可信区间为0.90~1.00),敏感度为83.3%,特异度为100.0%,模型准确率为91.7%,阳性预测值为1,阴性预测值为0.86。模型预测结果的ROC见图5。
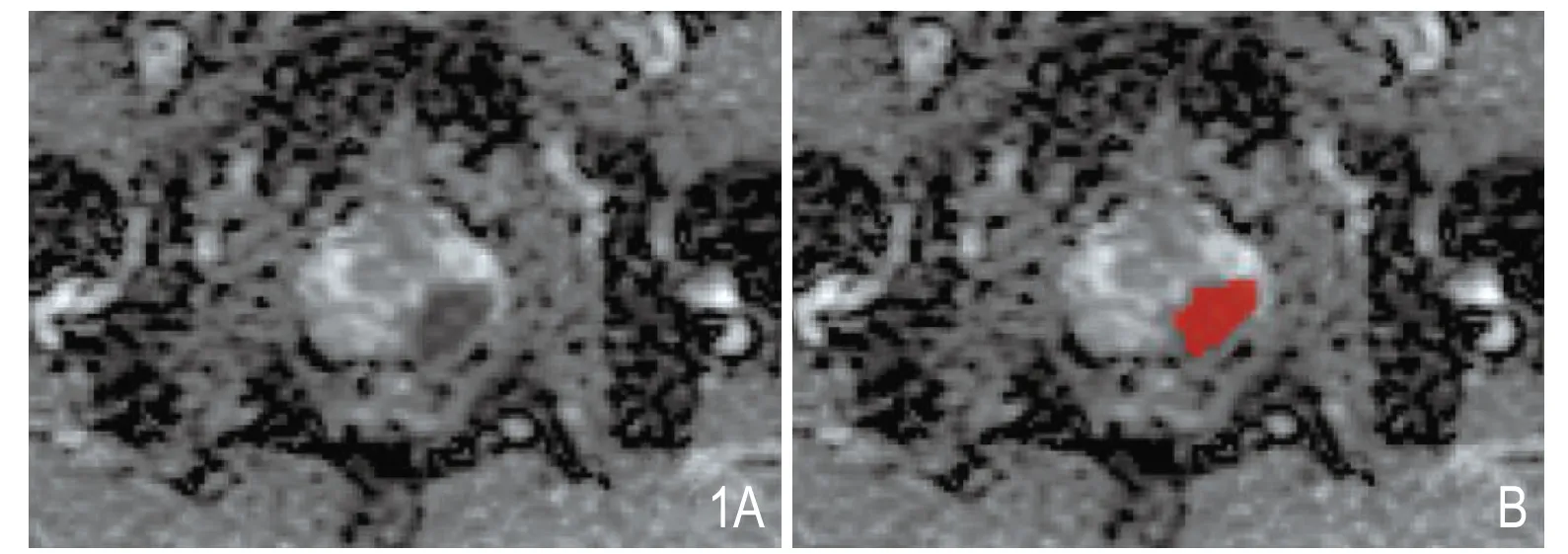
图1 前列腺癌ROI勾画示意图。A.ADC示前列腺左侧外周带低信号结节;B.沿肿块边缘手动勾画ROI。
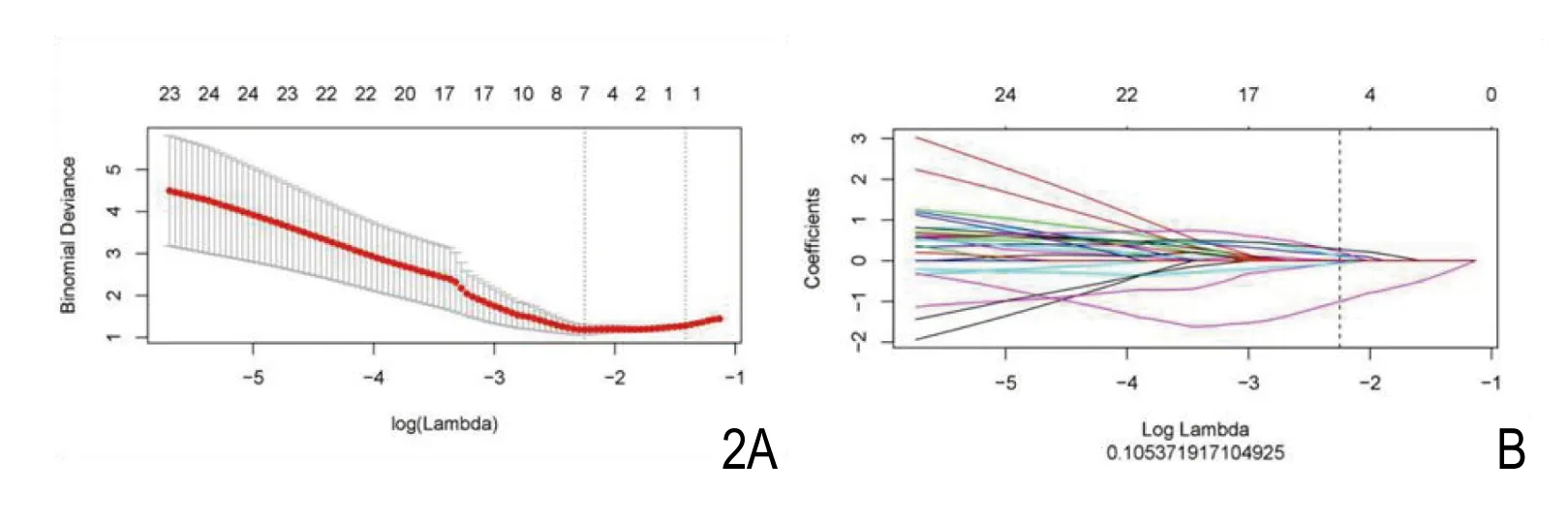
图2 使用LASSO回归对影像组学特征进行筛选。A. 超参数;B. 396个组学特征系数随lambda变化曲线图。
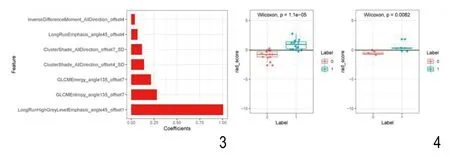
图3 筛选出的7个纹理特征的特征系数图。图4 训练组(左)和验证组(右)中低危组和高危组前列腺癌影像组学标签值,橙色为中低危组,蓝色为高危组。

图5 训练组和验证组中基于ADC图像纹理特征预测模型的ROC曲线图。A.训练组;B.验证组。图6 在独立验证组中的决策曲线,表示不同风险阈值下的净获益,Y轴代表净收益。X轴表示阈值概率。None表示没有患者有长期总体生存(OS)的假设。蓝线代表所有患者都有长期OS的假设。ALL表示在不同阈值概率下,放射组学的净获益。
3、决策曲线
决策曲线显示,在我们的研究中,影像组学鉴别中低危、高危前列腺癌在所有阈值概率下都是有益的(图6)。
讨 论
Gleason评分是通过前列腺癌的组织分化程度进行分级,是国际公认的重要参考指标[2]。前列腺癌的侵袭性个体差异很大,高危肿瘤病情进展快,需要尽早采取前列腺癌根治术或放、化疗等,而中低危肿瘤则进展缓慢或者长期无进展,需要进行主动监测[3],因此准确判断前列腺癌的侵袭性十分重要。目前临床上诊断前列腺癌主要依靠由超声引导下的穿刺活检,然而这种手段有一定的漏诊率,且因其有创性会使患者产生心理负担并存在诸多并发症,因此寻找一种可行的无创评估前列腺癌侵袭性的手段十分重要。
很多研究表明ADC值与Gleason分级呈负相关,并有助于判断其侵袭性[3]。然而由于各等级之间ADC值存在一定的重叠,用ADC来判断Gleason评分仍然有一定难度。因此,临床上需要更精确的影像指标。影像组学可以将医学图像转换为可使用的高维数据,以发现肉眼难以发现的肿瘤特点,从而进一步分析肿瘤的异质性,已经在肿瘤的早期诊断、恶性度、疗效评估中取得了良好的突破,对个性化精准医疗具有重要实用价值[7]。
前列腺癌具有高度异质性,病灶大小、形态、亮度及纹理分析特征值不同,其影像表征存在差异。Mark等[8]将支持向量机(SVM)和随机森林(LR)结合对基于ADC图像的移行带前列腺增生结节和前列腺癌进行分析,显示出较高的诊断价值。David等[9]对前列腺良恶性病变的MRI图像进行影像组学进行预测,显示出良好的诊断价值,但与单纯表观扩展系数(ADC)的诊断效能相比没有显著差异。但目前影像组学对前列腺癌Gleason分级的研究报道较少,本研究根据Gleason评分结果,将癌灶分为高危组(Gleason评分≤7)和中低危组(Gleason评分≥8),基于ADC图像建立影像组学模型对前列腺癌侵袭度进行诊断。
以往有许多研究表明b=2000s/mm2对前列腺癌的诊断以及Gleason分级鉴别效能更好[3],因此本研究采用b值为2000s/mm2对前列腺癌患者ADC图像进行影像组学特征分析,共获取42例患者396个定量纹理参数,通过LASSO回归算法筛选降维后得到7个特征纹理参数,其中相关性最强的属于游程矩阵参数,游程矩阵参数反映了在既定方向上具有某灰度值的像素连续出现的频数,其中,图像纹理的复杂性决定了长游程数值的大小,图像纹理均匀,数值越大[10]。随后建立预测模型用以鉴别中低危和高危前列腺癌,并在训练组和验证组中均得到了较好的结果,预测模型在训练组和验证组鉴别效能的ROC曲线下面积分别0.97、0.97,表明模型具有较高的诊断能力,可以有效地诊断前列腺癌侵袭度。Li等[11]采用前列腺T2WI和ADC图像的影像组学模型鉴别高、低级别前列腺癌,得到的AUC值(0.9~0.99)高于本研究,其原因可能是其应用支持向量机(SVM)来构建预测模型,本研究则是应用所筛选的特征和相应加权系数乘积的线性组合来构建预测模型,而SVM基于统计学习理论与结构化最小准则,对于小样本数据具有优秀的分类性能[12]。Ahmad等[13]基于MRI的影像组学对前列腺癌Gleason等级进行预测,筛选出41个特征参数,并建立随机森林模型用于前列腺癌检测和Gleason分级的评估,得到的AUC值为72.71%~83.40%,其AUC值低于本研究,可能是由于该研究对Gleason评分的过度分类,导致了其诊断效能的降低。决策分析结果显示,放射组学特征和临床预测因子的结合在训练和验证队列中显示出增强的分层有效性。
本研究的局限性在于:①由于前列腺癌病灶较小,本研究ROI只选取基于ADC图像肿瘤最大层面的二维特征,理想状况下是对整个肿瘤进行3D的勾画,从而更完善地分析整个肿瘤的影像组学特征;②本研究没有与预后相关性较大的AFP、肿瘤大小级部位等联合来建立模型;③由于前列腺癌病灶较小,无法进行预处理,之后将进一步优化。
总之,基于影像组学特征构建的分类器模型可以有效的评估前列腺癌Gleason分级,即为临床治疗方法的选择提供一定的参考。

