卵巢高级别神经内分泌癌合并高分化黏液性癌1例
赵小晓,倪海春,刘立红,谢永辉,章宏峰
部分为恶性Brenner瘤,部分为黏液性上皮性肿瘤伴上皮增生。行经腹全子宫切除+双侧附件切除+盆腔淋巴结清扫+部分大网膜切除术。
病理检查眼观:右侧附件,输卵管长7 cm,管径0.5 cm,伞端可见,与之相连一已破囊实性包块,大小11 cm×8.5 cm×6.5 cm,外壁光滑,囊性区域壁厚0.2 cm,内壁见少许囊泡样小突起,实性区灰红、灰黄色,乳头状,局部含淡黄色胶冻样液体。镜检:卵巢肿瘤细胞85%呈片状、岛状、器官样排列,伴有坏死(图1),细胞异型性较大,见较多核分裂(图2);15%区域腺体密集伴间质减少(图3),腺上皮细胞轻~中度异型,核分裂可见,呈膨胀性浸润性生长模式(图4)。免疫表型:神经内分泌肿瘤成分EMA、CK7、CgA、CD56和Syn均(+),p53、PAX8均部分(+),vimentin、ER、PR、p16、WT-1、PTH、TTF-1、p63、S-100和GATA-3均(-),Ki-67增殖指数约60%;黏液性肿瘤成分PAX8和CK7均(+),CDX-2和CK20均部分(+),ER和PR均(-),Ki-67增殖指数约15%。
病理诊断:右侧卵巢高级别神经内分泌癌(neuroendocrine carcinoma, NEC)合并高分化黏液性癌(highly differentiated ovarian mucinous carcinoma, HDOMC);右侧输卵管示未查及明确肿瘤累及。
讨论卵巢神经内分泌肿瘤(neuroendocrine neoplasm, NEN)并不常见,卵巢NEC更少见。临床表现与其他卵巢肿瘤无明显差异[1],诊断主要依靠肿瘤的镜下形态特点和免疫表型。镜下肿瘤细胞呈明显的器官样、实性巢状或梁状结构,可伴有肿瘤细胞点灶或融合片状坏死,核分裂象>20个/10 HPF[2]。免疫表型:NEN现在应用的主要是Syn、CgA和CD56,在不同分化程度的NEN中阳性率不同,分化好的NEN可以全套神经内分泌标记阳性,分化差的NEC若形态学典型,可以仅有一个阳性,也可以全部为阴性[3]。
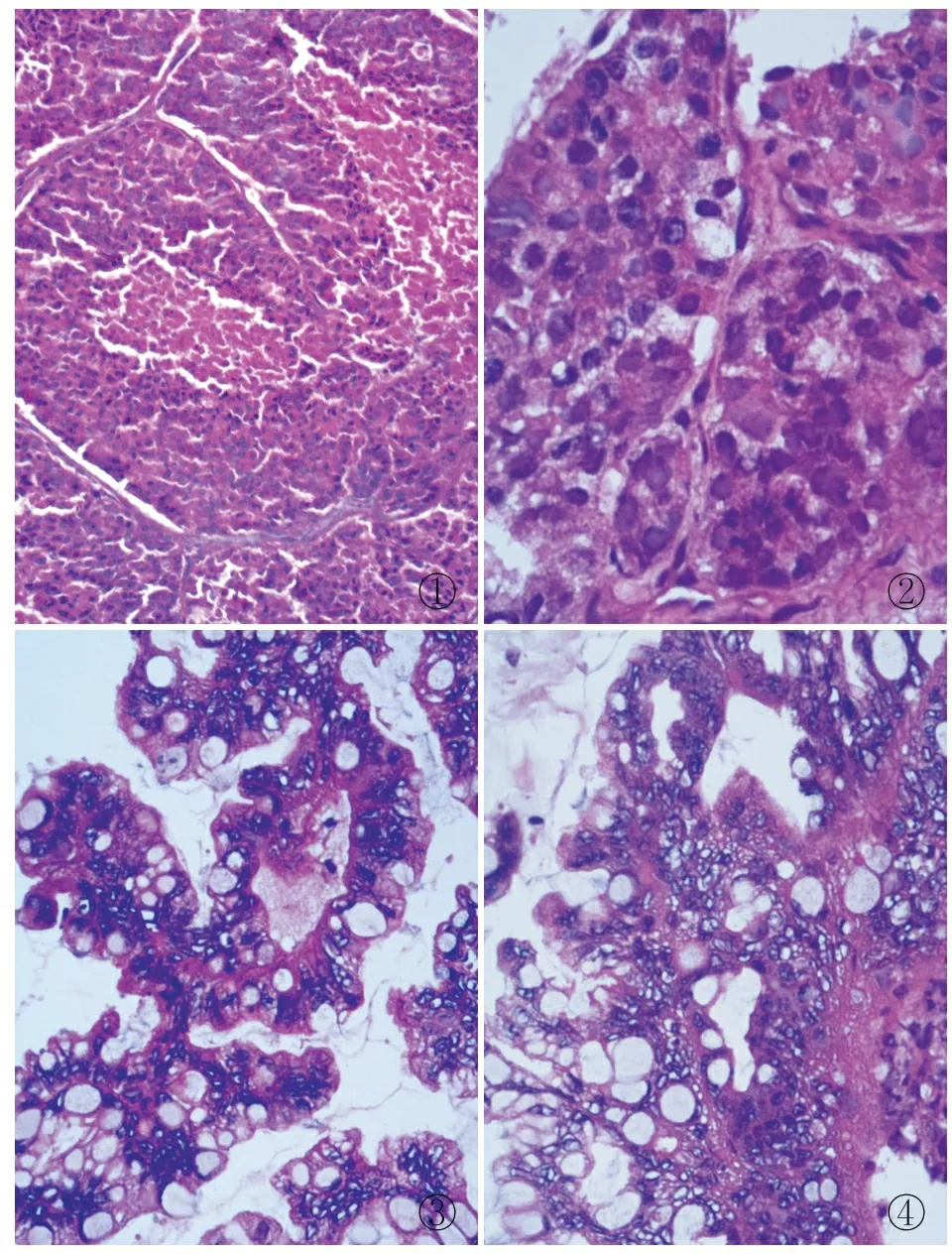
①②③④
图1肿瘤细胞85%呈片状、岛状、器官样排列,伴坏死图2细胞异型性较大,见较多核分裂图315%区域腺体密集伴间质减少图4腺上皮细胞轻~中度异型,核分裂可见,膨胀性浸润性生长模式
鉴别诊断:(1)卵巢未分化癌:其肉眼观察肿瘤多数呈实性,体积较大,伴出血、坏死;镜下肿瘤细胞呈实性片块状分布,细胞异型明显,分化极低,以致无法确定是何种上皮源性癌。免疫组化标记上皮性标志物阳性,但神经内分泌标志物阴性[4]。(2)低分化浆液性腺癌:镜下肿瘤细胞乳头结构减少或消失,呈片、巢状,病理性核分裂象多。免疫组化标记神经内分泌标志物阴性。本例NEC伴HDOMC,需要鉴别的主要是转移性结直肠腺癌。卵巢原发性MC以CK7+/CK20-常见,卵巢转移性结直肠腺癌以CK7-/CK20+常见,且SATB2是鉴别卵巢原发性MC和转移性结直肠腺癌高度特异的免疫组化标志物[5]。有研究发现MTA2可能作为一个癌基因参与卵巢上皮性癌的发展、转移,MTA2过表达提示患者预后不良[6]。
卵巢NEC是一类高度侵袭性肿瘤,当合并HDOMC时,预后更差[7],但合并HDOMC成分时对卵巢NEC预后的影响程度的文献报道极少。目前对于卵巢NEC治疗主要方法仍以手术为主,辅助化学药物治疗以及生物治疗。Natalie等[8]首次在1例卵巢非小细胞神经内分泌癌的75岁女性患者身上发现了BRCA基因突变,该研究指出卵巢癌除了高级别浆液性癌外,其它组织学类型的卵巢癌也均应该检测BRCA1/2基因是否有突变,有BRCA1/2基因突变的患者均可使用PARP抑制剂靶向治疗。本例患者术后行紫杉醇脂质体针+卡铂针+卡铂针方案化疗,至今无瘤生存15个月,无其它不适、转移或复发。

