CRIM1通过激活ERK1/2-VEGF信号通路促进子宫颈鳞状细胞癌微血管生成
张雨婷,汪亦君,夏 沛,张文辉,宋恩霖
富含半胱氨酸运动神经元蛋白1(cysteine-rich motor neuron 1, CRIM1)属于腱蛋白样富含半胱氨酸重复序列蛋白家族成员之一,其生理功能主要通过影响VEGFA的活性[1]调节器官发育过程中血管生成。目前已发现CRIM1与多种肿瘤发生、发展有关,如在肺癌[2]和胶质母细胞瘤[3]中均存在CRIM1的高表达,在前列腺癌PC细胞中CRIM1的高表达促进其浸润侵袭能力[4],但CRIM1与肿瘤微血管生成的关系目前尚未见报道。本文通过检测子宫颈鳞状细胞癌组织中CRIM1蛋白表达,分析其与肿瘤微血管密度(microvascular density, MVD)的关系,并进一步观察CRIM1对子宫颈鳞状细胞癌细胞VEGF表达的影响,探讨CRIM1与子宫颈癌微血管生成的关系及其分子机制。
1 材料与方法
1.1 临床资料收集中山大学附属第一医院确诊的浸润性子宫颈鳞状细胞癌石蜡包埋标本50例,患者平均年龄42岁;其中14例肿瘤直径大于4 cm,29例伴淋巴结转移,18例伴子宫旁浸润,高分化16例,中分化22例,低分化12例。所有患者术前均未行放、化疗。另取10例慢性子宫颈炎上皮标本作为对照组。
1.2 方法
1.2.1免疫组化 采用免疫组化MaxVision法染色,3~5 μm厚切片,65 ℃烘箱烤片2 h,常规二甲苯脱蜡,梯度乙醇水化,自来水冲洗,柠檬酸钠抗原热修复,3%H2O2处理,PBS漂洗。一抗CRIM1工作液50 μL,4 ℃过夜,PBS洗涤后,50 μL MaxVision二抗工作液(KIT-5010,福州迈新公司)室温下孵育30 min,洗涤后DAB显色,苏木精复染,中性树胶封固。以PBS代替一抗作阴性对照。测量累积光密度(integral optic density, IOD)进行蛋白表达半定量结果判定。在光镜下(×400)选取肿瘤组织中阳性最强的3个高倍视野,数码拍照,应用图像分析软件Image Pro Plus 6.0准确分割阳性区域,测量IOD值。相同条件下,每张图片测量3次,每张切片选取3张视野测量,以9次测量的IOD均值作为该视野中蛋白的表达强度。
1.2.2MVD检测 采用Weinner计数法检测子宫颈鳞状细胞癌组织中MVD。CD34免疫组化染色后(鼠抗人CD34单克隆抗体:Kit-004,福州迈新公司)以黄色颗粒状标记的血管内皮为标准。MVD计数采用Weinner等[5]计数法:切片在光镜下(×100)挑选MVD分布最高区域,在光镜下(×200)计数5个不同视野中被CD34染成阳性的微血管数量,取其平均值作为MVD值。每个与邻近微血管分离明显的阳性染色单个血管内皮细胞或血管内皮细胞簇均视为1个独立的微血管,结构不相连的分支血管结构也计为1个微血管。直径≥8个红细胞的血管,带有厚的平滑肌血管或者硬化坏死区血管不在计数范围内。
1.2.3子宫颈鳞状细胞癌SiHa细胞CRIM1基因瞬时转染 子宫颈鳞状细胞癌细胞SiHa(TCHu113,中国科学院上海细胞库),应用含10%胎牛血清及双抗的DMEM培养基常规培养于37 ℃、5%CO2的细胞培养箱中。按每毫升3×105个细胞接种2 mL细胞悬液于6孔板,24 h后更换为无血清、无双抗的基础培养基。实验分为3组:Control、Vector(空载质粒)、pCMV3-CRIM1组,分别用无血清、无双抗的DMEM 500 μL稀释6 μg的pCMV3-CRIM1过表达质粒(HG11666-UT,北京义翘神州生物公司)、6 μg的pCMV/hygro-Negative空载质粒(CV001,北京义翘神州生物公司)和两支10 μL脂质体Sinofection(STFO2,北京义翘神州生物公司),室温孵育5 min,各自将质粒和转染试剂混合形成转染复合物,室温孵育20~25 min,加入对应孔板中。Control组加入正常培养细胞的完全培养基,转染后培养6 h,更换培养基为新鲜含10%血清不含双抗的培养基,继续培养至48 h,通过Western blot检测转染效果及相关蛋白变化。
1.2.4Western blot法 RIPA裂解液加入蛋白酶和磷酸酶抑制剂配成细胞裂解液提取细胞总蛋白,用以检测CRIM1(兔抗人多克隆抗体:H00051232-M01,台湾Abnova公司)、p-ERK(兔抗人多克隆抗体:AF1015,美国Affinity公司)、total-ERK(兔抗人多克隆抗体:16443-1-AP,美国Proteintech公司)和VEGF(兔抗人多克隆抗体:19003-1-AP,美国Proteintech公司)蛋白表达;蛋白浓度测定后,按每孔20 μL上样量用Loading Buffer和RIPA液配平,沸水加热后冷却离心上样,行十二烷基磺酸钠聚丙烯酰胺(SDS-PAGE)凝胶电泳,转至PVDF膜上。5%脱脂奶粉封闭,加入一抗(工作浓度1 ∶500,内参β-actin为1 ∶4 000)4 ℃过夜;TBST洗涤后加入二抗(工作浓度1 ∶5 000)常温摇床孵育;洗涤膜后,利用ECL化学发光试剂盒孵育发光,显影。利用Image Pro Plus 6.0软件测量目的蛋白条带和内参条带的灰度值,以目的条带灰度值与内参灰度值的比值作为蛋白的相对表达水平。
1.2.5细胞上清液中VEGF含量ELISA检测 收集各组癌细胞的上清液,离心后去沉淀取上清备用。按照ELISA试剂盒(EHC108.96.2,深圳欣博盛公司)说明书进行操作,检测标准品及各组待测样品的OD值,根据标准曲线计算各组待测样品中VEGF的含量。
1.2.6CCK-8实验 留取上述两组的癌细胞上清液,取对数生长期的HUVEC(HF1121,上海富衡生物公司)制成细胞悬液,按每孔100 μL含2 000个细胞的浓度接种于96孔板,分为Control、Vector、pCMV3-CRIM1和DMEM组,每组5个复孔。细胞贴壁后将留取的癌细胞上清液分别作用于2组的HUVEC,Control组HUVEC加入完全培养基,培养24 h后弃去上清,加入10%的CCK-8工作液(CK04,北京沃比森科技公司),在培养箱继续培养3 h,于酶标仪450 nm处测OD值,计算各组细胞增殖活力值。
1.2.7Matrigel胶管腔形成实验 实验根据In Vitro Angiogenesis Assay内管腔形成试剂盒(ECM625,美国Merck Millipore公司)说明书进行,枪头、EP管、96孔板置于-20 ℃预冷过夜,Matrigel胶置于4 ℃预冷过夜;次日,吸取Matrigel胶每孔50 μL加入96孔板,放入4 ℃冰箱10 min(可使Matrigel胶铺板更加均匀没有气泡),放入37 ℃培养箱,放置1 h待Matrigel胶聚合成凝胶。PBS清洗3次,胰蛋白酶消化HUVEC,1 000 r/min离心5 min。HUVEC细胞用DMEM培养基制备成细胞悬液(每孔约1×105个细胞),取上述转染后的癌细胞上清100 μL和HUVEC细胞悬液100 μL以1 ∶1混合,合计200 μL加入96孔板中,记作0 h,放入5%CO2、37 ℃细胞培养箱中培养,培养10 h后取出,倒置显微镜下观察并计数拍照小管形成情况。
1.2.8人重组蛋白作用SiHa 将SiHa细胞消化离心制成细胞悬液,调整浓度接种于6孔板中,实验分为5组:0、12.5、25、50、100 ng/mL,24 h后将人重组CRIM1蛋白(H00051232-Q01,台湾Abnova公司)稀释加入肿瘤细胞继续培养24 h,提取细胞蛋白及细胞上清,分别用Western blot法和ELISA法检测细胞蛋白中VEGF表达和上清中VEGF的含量变化。

2 结果
2.1 子宫颈鳞状细胞癌中CRIM1的表达CRIM1在正常子宫颈上皮中呈弱阳性甚至阴性;而在子宫颈鳞状细胞癌组织中均呈弥漫阳性,且主要表达于子宫颈鳞状细胞癌的细胞质和(或)细胞核(图1)。光密度检测分析:CRIM1在子宫颈鳞状细胞癌中的表达显著高于其在正常子宫颈上皮中的表达(P<0.001,表1)。
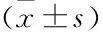
表1 子宫颈鳞状细胞癌和正常子宫颈组织中CIRM1的表达
2.2 子宫颈鳞状细胞癌中CRIM1的表达与MVD的关系子宫颈鳞状细胞癌中CD34标记的微血管分布于癌巢之间和癌巢内瘤细胞之间(图2),平均MVD值为31。相关性分析显示:在子宫颈鳞状细胞癌中,CRIM1的表达与MVD呈正相关(r=0.546,P<0.01)。

①②
图1子宫颈鳞状细胞癌组织中CRIM1的表达,胞质和(或)胞核阳性,MaxVision法图2子宫颈鳞状细胞癌组织中CD34内皮标记的微血管,MaxVision法
2.3 CRIM1与SiHa细胞血管诱生能力的关系
2.3.1过表达CRIM1的SiHa细胞上清液促进内皮细胞增殖 CCK-8细胞增殖实验结果显示,pCMV3-CRIM1质粒转染组癌细胞上清液刺激下的内皮增殖活力(1.02±0.024)显著高于Control组(0.93±0.030,P<0.01)和Vector组(0.93±0.028,P<0.01)。
2.3.2SiHa细胞中CRIM1过表达增强内皮细胞管腔形成能力 管腔形成实验结果显示,pCMV3-CRIM1质粒转染组癌细胞上清液作用下内皮细胞的管腔形成能力(1.20±0.137)显著高于Control组(1.0±0.088)和Vector转染组(0.89±0.120)(P均<0.05)。
2.4 CRIM1活化ERK信号上调VEGF表达促进SiHa细胞血管诱生能力
2.4.1CRIM1的高表达上调SiHa细胞中VEGF蛋白表达 CRIM1基因转染组SiHa细胞中CRIM1和VEGF的表达水平分别为0.819±0.086和0.404±0.039,显著高于Control组(0.092±0.021,P<0.001;0.059±0.008,P<0.001)和Vector转染组(0.122±0.019,P<0.001;0.056±0.008,P<0.001);Vector转染组和Control组蛋白表达差异无显著性(图3),且ELISA检测结果显示,阳性转染组细胞上清液中VEGF含量为(763.751±25.816) pg,显著高于Control组[(653.501±25.487) pg,P<0.01]和Vector转染组[(649.006±36.539) pg,P<0.01)],提示CRIM1基因转染成功,且CRIM1高表达可上调SiHa细胞VEGF的表达水平。

图3 CRIM1基因转染上调SiHa细胞中VEGF的表达:Control.空白对照组;Vector.阴性转染组;pCMV3-CRIM1.阳性转染组
2.4.2CRIM1上调VEGF表达依赖于ERK信号的活化 pCMV3-CRIM1质粒转染组SiHa细胞中p-ERK和VEGF的表达水平(0.417±0.016,0.244±0.014)显著高于Control组(0.134±0.007,P<0.001;0.066±0.004,P=0.01)。ERK抑制剂U0126与pCMV3-CRIM1转染质粒联合处理的SiHa细胞中p-ERK的表达水平(0.218±0.008)显著低于pCMV3-CRIM1质粒转染组(P<0.001),且该组细胞中VEGF的表达水平(0.061±0.009)也显著低于pCMV3-CRIM1质粒转染组(0.244±0.014,P<0.001),SiHa细胞中CRIM1的表达在两组间差异无显著性(图4)。

图4 ERK信号的活化对CRIM1上调SiHa细胞VEGF表达的影响:Control.空白对照组;pCMV3-CRIM1.质粒阳性转染组;CRIM1+U0126.ERK抑制与pCMV3-CRIM1表达质粒联合处理组
2.5 外源性CRIM1对SiHa细胞中VEGF蛋白表达的影响不同浓度的外源性CRIM1对SiHa细胞中VEGF蛋白表达水平无明显影响(P>0.05),且ELISA检测结果亦显示,不同浓度外源性CRIM1蛋白刺激下的各组SiHa细胞上清中VEGF的表达水平差异无显著性(P>0.05)。
3 讨论
实体肿瘤新形成的微血管在结构上缺乏完整性[5],易于肿瘤细胞浸润转移。有文献报道许多促血管生成因子提高子宫颈癌的浸润转移能力,与子宫颈癌预后不良显著相关[6-8]。故研究新的微血管生成调节因子对子宫颈癌血管生成的机制和生物治疗具有重大意义。
CRIM1属于腱蛋白样富含半胱氨酸重复序列蛋白家族成员之一。Pennisi等[9]通过构建CRIM1等位基因敲除的小鼠模型,发现CRIM1非正常表达使小鼠出现诸如死亡、并指、大脑血肿、眼睛缺陷和皮肤血泡等表现,提示CRIM1属于重要的器官发育调节因子。在肾小球血管发生过程中CRIM1调节VEGFA的活性及其细胞表面的递呈[1],且通过促进内皮VEGFR2的磷酸化调节VEGFA自分泌以维持血管稳定性[10]。CRIM1可高表达于有复发潜能的胃肠间质瘤[11]、胶质母细胞瘤[3],影响肺癌A549细胞黏附和迁移行为[2],且与髓性白血病及卵巢癌耐药有关[12-13],提示CRIM1是潜在血管生成调节因子,且与多种肿瘤的发生、发展有关,但关于它与肿瘤血管生成的研究却鲜有报道。CD34内皮标记对肿瘤组织中新生的微血管和不完整的血管较为敏感[14]。本实验通过内皮CD34标记检测子宫颈鳞状细胞癌 MVD,免疫组化检测子宫颈鳞状细胞癌组织中CRIM1的表达,分析CRIM1与子宫颈鳞状细胞癌细胞血管诱生能力的关系。
CRIM1在子宫颈鳞状细胞癌组织中的表达显著高于正常子宫颈上皮组织,且与MVD呈正相关,提示CRIM1可能参与子宫颈鳞状细胞癌的发生、发展,且与子宫颈鳞状细胞癌微血管生成有关。对子宫颈鳞状细胞癌SiHa细胞进行CRIM1基因瞬时转染后癌细胞上清液刺激下的内皮细胞的增殖能力和管腔形成能力显著升高,表明CRIM1能增强子宫颈鳞状细胞癌细胞的血管诱生能力。肿瘤微血管生成是一个复杂的多因素参与的过程,包括肿瘤组织中的瘤细胞、内皮细胞和其他一些基质细胞之间的相互作用。目前较为熟知的调节途径是瘤细胞通过表达分泌某些血管生成因子诱导内皮细胞的血管生成,称之为旁分泌调节途径[15]。本实验结果显示CRIM1可能通过某种信号途径上调血管生成因子的表达,从而旁分泌性促进内皮的血管生成。本课题组发现CRIM1转染后癌细胞中VEGF的表达明显上调,且此时癌细胞上清液中VEGF含量的升高;该结果与有关CRIM1调节器官生长发育过程中的血管新生的实验结果基本一致,说明CRIM1调节肿瘤的血管生成机制是通过介导VEGF表达变化而实现的。据报道,CRIM1对VEGF的调节作用与其分子结构上RGD模序结合integrin β1从而活化ERK信号有关[16]。本课题利用ERK特异性抑制剂U0126预处理癌细胞后再进行CRIM1基因转染,发现正常转染的癌细胞中VEGF表达升高的同时,p-ERK表达水平也显著高于正常转染组,当U0126抑制ERK信号的活化时,癌细胞中VEGF的水平显著低于正常转染组,但两组间CRIM1的表达差异无显著性,表明CRIM1通过活化下游ERK信号上调子宫颈鳞状细胞癌VEGF的表达。ERK信号的活化与多种肿瘤微血管生成有关[17-18],其受多种上游调节因子的激活。CRIM1激活子宫颈鳞状细胞癌细胞ERK信号是否也与CRIM1和integrin β1的相互作用尚需进一步分析。利用人工重组CRIM1蛋白直接刺激子宫颈癌细胞,其癌细胞及上清液中VEGF的表达水平均无显著变化,说明CRIM1自身并不能作为一种分泌性蛋白发挥作用。此外,本课题组织学研究发现CRIM1表达于子宫颈鳞状细胞癌的细胞质和(或)细胞核,CRIM1促进子宫颈鳞状细胞癌微血管生成的功能是否与它在癌细胞中的表达定位有关,值得我们深入探讨。
综上所述,本实验首次证实CRIM1在子宫颈鳞状细胞癌中高表达,CRIM1能通过活化ERK信号上调癌细胞VEGF的表达,促进子宫颈癌微血管生成。

