胃底腺型腺癌2例并文献复习
傅 静,杨旭丹,李 娟,王 雷,胡 晓,刘 翔,朱 鸿,徐 钢
胃底腺型腺癌(gastric adenocarcinoma of the fundic gland type, GA-FG)最早于2007年由Tsukamoto等[1]报道。2010年Ueyama等[2]提出将GA-FG(主细胞为主型)作为一种新的胃腺癌亚型。目前文献多为个案报道,病理医师对GA-FG缺乏深入认识。本文回顾性分析2例GA-FG的临床病理学特征、诊断及鉴别诊断,旨在提高对其认识水平。
1 材料与方法
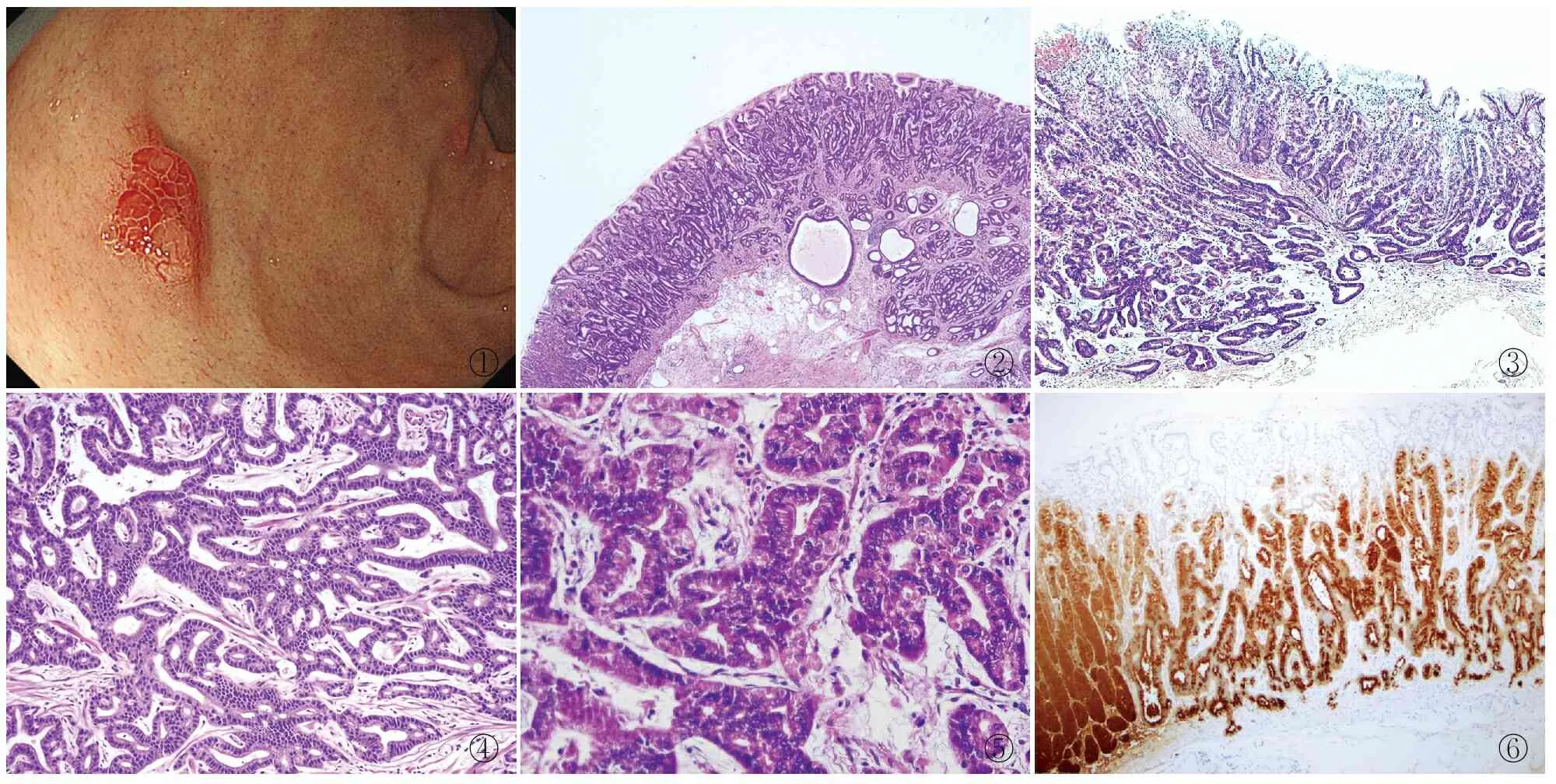
1.1 材料回顾性分析2016年10月~2019年4月四川省人民医院病理科存档的1 845例胃癌标本,其中2例确诊为GA-FG。例1男性,68岁,因上腹不适行胃镜检查,发现胃底部有一直径约1.5 cm的浅表隆起型病变,边界清楚,血管密度增高,考虑累及黏膜下浅层的肿瘤性病变(图1)。患者行胃镜黏膜下剥除术(endoscopic submucosal dissection, ESD)。例2女性,55岁,因上腹胀行胃镜检查,发现胃底部新生物,活检提示腺癌,遂转入我院进一步治疗。患者行近端胃大部切除+D2淋巴结清扫术。
1.2 方法标本均经10%中性福尔马林固定,石蜡包埋,常规脱水、切片,行HE及免疫组化EnVision两步法染色。所用一抗包括CK、MUC6、MUC5AC、MUC2、CD10、desmin、CD34、D2-40、p53、β-catenin、HP、Ki-67,均购自福州迈新公司。一抗Pepsinogen-Ⅰ、H+/K+-ATPase均购自Abcam公司。
2 结果
2.1 眼观例1:送检ESD标本,黏膜中央见一浅表隆起型(0~Ⅱa型)病变,边界清楚,大小0.5 cm×0.5 cm×0.2 cm,切面质中。例2:送检近端胃大部切除标本,胃底部部分胃壁稍增厚隆起(0~Ⅱa+b型),黏膜颜色较周围略浅,病变大小1.0 cm×1.0 cm×0.2 cm,切面质中。
2.2 镜检低倍镜下肿瘤呈浸润性生长,与周围组织分界欠清,表面覆盖正常的小凹上皮细胞(图2、3)。肿瘤由不规则分枝状腺体构成,腺体间相互融合,迷路状,呈一种连续不断的形态,即所谓的“无尽的腺体”模式,局灶见筛状结构,部分腺体扩张(图4)。高倍镜下见肿瘤细胞有两种类型,一种类似主细胞,细胞柱状,胞质稍嗜碱性,核位于基底。另一种类似壁细胞,细胞三角形或卵圆形,胞质嗜酸性,核位于中央。例1两种细胞混合存在,壁细胞约占肿瘤细胞的40%(图5)。例2以主细胞为主,见少量壁细胞,约占10%。瘤细胞轻度异型,核稍增大,偶见小核仁,未见确切核分裂象。2例肿瘤均穿透黏膜肌层,浸润至黏膜下层。2例均可见间质少量淋巴细胞浸润及轻度纤维间质反应。未见淋巴管及血管侵犯,未见肿瘤性坏死。周围胃黏膜未见萎缩性胃炎改变。例2淋巴结无癌转移。
2.3 免疫表型2例瘤细胞MUC6均呈弥漫强阳性,例1 Pepsinogen-Ⅰ和H+/K+-ATPase可见不同瘤细胞阳性,例2 Pepsinogen-Ⅰ呈强阳性(图6),H+/K+-ATPase呈灶性弱阳性。免疫表型均支持肿瘤胃底腺来源。2例MUC2、MUC5AC和CD10均阴性,p53呈野生型,β-catenin呈细胞核阴性。Ki-67增殖指数分别约为15%和10%。2例幽门螺杆菌染色均未查见幽门螺杆菌。
2.4 病理诊断2例均确诊为胃底腺型腺癌。
2.5 随访2例患者术后分别随访12个月和2个月,均无瘤生存。
3 讨论
胃癌的发生与多因素相关,其中慢性幽门螺杆菌感染、黏膜萎缩及腺体肠化与胃癌的发生密切相关[3]。本组2例均未检测到幽门螺杆菌感染及周围黏膜萎缩性改变,与大多数文献报道一致[2,4],提示幽门螺杆菌感染与GA-FG的发生无明显相关性。
①②③④⑤⑥
图1例1普通白光内镜下局部放大,见黏膜下肿瘤样隆起病变,周围黏膜无萎缩改变图2例2肿瘤表面被覆正常小凹上皮,灶性腺体扩张图3例1肿瘤与周围组织分界欠清,浸润黏膜下层图4例2 肿瘤腺体不规则分枝,相互吻合,形成筛状结构图5例1见较多胞质嗜酸性的壁细胞图6例2 大部分瘤细胞Pepsinogen-Ⅰ呈强阳性,提示其主细胞分化
GA-FG的大多数报道来自日本,偶尔有其他人群的报道[5-7]。原因尚不清楚,可能与胃癌发病率高及大范围的对人群进行胃癌筛查有关[8]。
Benedict等[4]回顾性分析文献报道的111例GA-FG,发现患者多为老年人,平均年龄66岁。男性多于女性,男 ∶女约为2.2 ∶1。GA-FG绝大多数发生于胃的中上部,以胃上1/3居多。通常情况下,肿瘤体积小,平均约1 cm。内镜下可呈类似黏膜下肿瘤隆起,也可呈平坦或凹陷改变。黏膜褪色或发白,表面伴随分枝状血管影。周围黏膜无萎缩或肠化改变[9]。
GA-FG组织学表现为分化好的腺癌,表面被覆正常的小凹上皮细胞。肿瘤腺体不规则分枝状,相互吻合呈迷路样,呈“无尽的腺体”模式,偶尔可见腺体内折和筛状结构[4]。肿瘤坏死罕见。瘤细胞类似正常胃底腺细胞,包括主细胞和壁细胞,偶尔可见卷入或化生的颈黏液细胞。通常按细胞类型和比例不同将GA-FG分为主细胞为主型,壁细胞为主型及混合型[2]。在HE染色下,根据形态特征可以识别主细胞和壁细胞。本组例1为混合型,例2为主细胞为主型。例1壁细胞丰富,约占瘤细胞的40%。文献报道的病例多为主细胞为主型,与例2类似。免疫组化标记Pepsinogen-Ⅰ和H+/K+-ATPase分别在主细胞和壁细胞表达。GA-FG中肿瘤细胞MUC6呈弥漫强阳性,小凹上皮标记MUC5AC,肠型上皮标记MUC2及CD10均阴性。Ki-67增殖指数通常较低。本组2例Ki-67指数分别约为15%和10%,高于多数文献所报道的5%[4]。
GA-FG需与胃底腺息肉、幽门腺腺瘤、神经内分泌瘤1级及某些高分化胃腺癌鉴别。GA-FG细胞类似正常胃底腺细胞,异型性不显著,但腺体有明显结构异型性,浸润性生长方式以及胃底腺分化标记的表达,可与其他良性和恶性病变鉴别。
有关GA-FG的分子改变研究较少,可能与WNT-β-catenin信号通路或ERK1/2 MAPK通路的激活相关[10]。Nomura等[11]的一项研究发现26例GA-FG中22例存在β-catenin核阳性。Kushima等[12]发现GA-FG和幽门腺腺瘤出现频繁的GNAS突变。本组2例未行基因检测,免疫组化标记p53为野生型,β-catenin呈细胞核阴性。
文献报道的GA-FG绝大多数为早期病变,肿瘤位于黏膜固有层或浸润黏膜下层,脉管侵犯少见,进展及转移罕见[4]。本组2例病变均浸润黏膜下层,无脉管侵犯。基于GA-FG侵袭性较低的生物学行为,Singhi等[5]提出将其归为良性,命名为泌酸腺息肉/腺瘤。文献报道有病例在肿瘤进展期间转变为高度恶性肿瘤[13]。1例未经治疗的GA-FG在10年后转变为高侵袭性胃型腺癌,并出现淋巴结转移[14]。这2例肿瘤均累及黏膜小凹上皮,提示可能与侵袭性增加有相关性。WHO(2019)消化系统肿瘤分类中正式将GA-FG纳入胃腺癌亚型之一。对于未浸润黏膜下层的前驱病变,则定义为泌酸腺腺瘤(oxyntic gland adenoma, OGA)[15]。
对于浸润不超过浅表黏膜下层的GA-FG,可以通过局部胃切除或ESD进行治疗,当出现更深部浸润或怀疑淋巴结有转移时可采用胃大部切除+淋巴结清扫术[4]。本组例1行ESD治疗,例2行近端胃大部切除+D2淋巴结清扫术。2例术后均无瘤生存。
本组例1可见较多壁细胞,为主细胞-壁细胞混合型,文献报道的病例几乎均为主细胞为主型[4],这类亚型的临床病理及预后等是否有特殊性尚需深入探讨。
(本文承蒙山东大学第二医院周成军教授的指导,特此致谢!)。

