他汀类药物在非心血管领域的应用进展
付梦璐,罗莉曼,李园园,凃玲,徐西振
(华中科技大学同济医学院附属同济医院1.老年医学科;2.心血管内科,武汉 430030)
他汀类药物主要通过抑制肝脏中胆固醇生物合成的限速酶即3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)的活性及增加低密度脂蛋白(low density lipoprotein,LDL)受体基因表达发挥降脂效应,可以抑制HMG-CoA转化成甲羟戊酸,减少其下游胆固醇的合成,肝细胞内胆固醇水平的下降使细胞表面LDL受体表达增加,促进肝细胞对血液中LDL的摄取[1],从而降低血浆中胆固醇、LDL和三酰甘油水平、增加高密度脂蛋白(high density lipoprotein,HDL)水平,并能有效地降低伴或不伴动脉粥样硬化性疾病患者心血管病的发病率和病死率[2]。然而,随着研究的进展,发现除影响脂类水平以外,他汀类药物还具有其他多种重要作用,即多效性[3],包括抗炎、抗氧化应激、改善内皮功能及血管重构、保护神经功能和调节免疫反应。他汀类药物多效性的作用机制主要是其在有效阻断HMG-CoA还原酶的同时,也抑制了胆固醇合成途径中间代谢产物的合成,使许多蛋白质活性降低,影响信号转导通路,导致细胞的增殖、分化、凋亡、分泌等功能产生改变[4]。
1 他汀类药物在炎症抑制方面的作用
脓毒症是感染引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),其基本的病理机制是机体在感染和(或)非感染因素的作用下产生失控的自我持续放大和自我破坏的炎症,从而引起全身性炎症和组织器官的损伤,甚至发生多器官功能障碍综合征。一项前瞻性队列研究表明,入院早期即使用他汀类药物可以减少严重脓毒血症的发生率和重症监护室(intensive care unit,ICU)的住院率[5]。脓毒症时单核-巨噬细胞释放大量炎症因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(IL)-6等,通过激活凝血、纤溶、补体系统,诱发弥散性血管内凝血(disseminated intravascular coagulation,DIC),促进肾上腺儿茶酚胺分泌,导致微循环障碍、血浆外渗,最终导致微循环障碍和多器官功能衰竭。ANDO等[6]研究发现他汀类药物预处理的大鼠,其TNF-α和IL-1的表达量明显降低,进而减弱大鼠的免疫炎症反应。一项随机对照试验证明瑞舒伐他汀可以有效减低慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患者外周血 IL-6和超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)水平,显著减轻全身炎症[7]。同样,一项临床研究证实辛伐他汀可以逆转COPD患者气道IL-17A/IL-10失衡,即降低气道IL-17A、IL-6等炎症因子水平,并升高炎症抑制因子 IL-10的 水平,同时减少痰液巨噬细胞数量,表明辛伐他汀也可以改善COPD患者的气道慢性炎症[8]。
2 他汀类药物在骨质疏松方面的作用
近年有临床研究发现,阿托伐他汀还可通过增加成骨细胞骨形成和阻断破骨细胞生成来影响骨周转率,其主要作用机制是:①抑制 Rho 相关激酶与羟甲基戊二酰辅酶A 还原酶,促进骨形成蛋白;②骨钙素及α 1 核结合因子表达,从而促使骨细胞分化,并能抑制成骨细胞释放生物性活素,防止破骨细胞生成及分化。然而,他汀类药物治疗骨质疏松症的疗效在以往的研究和荟萃分析中一直存在争议。SHAHREZAEE等[9]对卵巢切除(ovariectomized,OVX)的雌性SD大鼠进行他汀类药物口服60 d的研究,表明洛伐他汀和辛伐他汀能有效改善OVX诱导的骨质疏松症。LIN等[10]研究发现他汀类药物的使用降低了卒中后患者不良结局的风险,包括骨质疏松症(aHR=0.68;P<0.001),髋部骨折(aHR=0.59,P<0.001),椎体骨折(aHR=0.73;P=0.003)。一项回顾性队列研究,接受他汀类药物治疗的45 342例受试者为试验组,115 594例未接受他汀类药物治疗的患者被纳入对照组,最终结果表明他汀类药物治疗组较未接受降脂治疗组骨折风险下降了48%[11]。他汀类药物可以减少各种骨折的发生,尤其是髓骨骨折,随他汀类药物使用剂量的增加而降低[12]。
但也有研究持不同观点,认为他汀类药物的使用可以降低新发骨质疏松性骨折(new-onset osteoporotic fractures,NOFs)的风险,但并非所有的他汀类药物。在该研究的10年随访中,服用阿托伐他汀或瑞舒伐他汀的患者发生NOFs的风险低于服用辛伐他汀的患者。其他他汀类药物如普伐他汀、氟伐他汀、洛伐他汀和匹他汀与NOFs无关。研究还强调,高效他汀类药物在降低NOFs风险具有剂量反应效应[13]。
3 他汀类药物在神经系统疾病中的作用
多项研究显示,脂质通路的失调与神经退行性疾病有关,近年来,他汀类药物在脑卒中、多发性硬化和帕金森病治疗方面的潜在应用价值受到越来越多学者的关注[14]。氟伐他汀通过增加降解淀粉样前体蛋白C端片段(amyloid precursor protein C-terminal fragments,APP-CTFs)以降低脑Aβ蛋白,从而可以降低患阿尔茨海默病的风险[15]。他汀抑制促炎因子及小胶质激活,刺激内皮一氧化氮合酶,抑制氧化应激,降低α-突触核蛋白聚合,调节适应性免疫,并增加神经营养因子的表达,能够减轻帕金森病的运动症状如肢体僵直、震颤等[16]。文献[17]报道一项随机、对照的2期试验,将140例参与者随机分配接受辛伐他汀(n=70)或安慰药(n=70),研究大剂量辛伐他汀对继发性进行性多发性硬化症的脑萎缩的影响,发现辛伐他汀组的平均脑萎缩率明显低于安慰药组。
4 他汀类药物在肿瘤防治中的作用
许多临床前和流行病学证据支持HMG-CoA还原酶抑制剂(他汀类药物)的抗癌作用。最近的一项研究表明,由于他汀类药物对细胞周期调控因子P21和P27的影响,它可能具有抗乳腺癌细胞增殖的特性[18]。诊断前使用他汀类药物与降低乳腺癌特异性死亡率有关。研究表明,他汀类药物靶点3-羟基-3-甲基谷胱甘肽辅酶a还原酶,在乳腺肿瘤中高表达,在诊断前暴露于他汀类药物的患者中,乳腺癌特异性死亡率显著降低,这在雌激素受体(estrogen receptor,ER)阳性的肿瘤患者中更为明显[19]。
但也有学者持不同观点,LIM等[20]对行原发性肾输尿管切除术的277例患者的医疗记录进行了回顾性分析,探讨他汀类药物对上尿路上皮癌(upper urothelial carcinoma,UTUC)行根治性肾输尿管切除术预后的影响,评估了他汀类药物对无复发生存率(recurrence-free survival,RFS)、癌症特异性生存率(cancer-specific survival,CSS)和总生存率(overall survival,OS)的作用。277例患者中62例(22.4%)正在服用他汀类药物,与不使用他汀类药物的患者相比,使用他汀类药物的患者年龄较大,体质量指数较高,心血管疾病和糖尿病发病率较高。他汀类药物使用者和非使用者5年RFS分别为78.5%和72.5%(P=0.528);5年CSS分别为85.6%和77.7%(P=0.516)。最终发现,在UTUC患者中,他汀类药物的使用与改善的RFS、CSS或OS无关。甚至,ALSHEIKH-ALI等[21]研究发现,他汀类药物的降脂幅度越大,患肿瘤的风险也越大 。由此可见,他汀类药物与癌症风险的关系并未得到确切的依据,不同的研究结论存在差异,缺乏有力的数据支持,这可能与应用的他汀类药物的种类及剂量,肿瘤类型及分化程度等有关,也有待更多的研究进一步明确。
5 他汀类药物在自身免疫性疾病中的作用
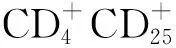
6 他汀类药物在凝血系统中的作用
辛伐他汀可以降低血浆组织因子(tissue factor,TF)水平,提高组织因子途径抑制物(tissue factor pathway inhibitor,TFPI)表达水平,改善患者凝血功能紊乱。另外,服用他汀类药物可以降低65 岁以上老人深静脉血栓再发的风险[28]。分化簇36(cluster of differentiation 36,CD36)是表达于多种细胞表面的单链糖蛋白,ox-LDL 与血小板膜CD36 结合后生成内源性活性氧,可以促进血小板活化和血栓形成[29]。他汀类药物可以通过直接与 CD36 作用或者通过影响 CD36 胞内信号转导通路等途径,发挥抑制血小板激活和聚集的作用。此外,阿托伐他汀可以抑制内皮细胞对纤溶酶原激活物抑制物-1 和凝血酶敏感蛋白-1的分泌,促进细胞分泌组织型纤溶酶原激活物,发挥抑制血栓形成功能。
综上所述,他汀类药物作为临床上常用的调脂药,因其在降脂外还具有抗炎、抗氧化应激、免疫调节、抗血栓、抑制细胞增殖、诱导凋亡等效应,提示他汀类药物也许可以用于自身免疫性疾病、骨关节病、血栓性疾病、肿瘤等疾病的治疗。当然,他汀类药物的多效性还需要更加深入的研究来明确其作用机制及临床意义,同时,他汀类药物引起的肌痛、肌炎、横纹肌溶解及肝毒性等不良反应也应考虑,以将其更为安全、有效地应用于临床实践中。

