运动处方对老年大鼠和老年肥胖大鼠Resistin和Visfatin mRNA表达及血浆浓度的影响
林伟其, 柏友萍, 孙 林
(安徽师范大学 体育学院,安徽 芜湖 241003)
随着第四次工业革命兴起,人们的生活方式发生了根本性改变,现代社会老龄化状态日益严重,老年肥胖人群的比例在不断攀升。老年肥胖人群比一般老年人群更容易发生糖代谢紊乱、胰岛素抵抗(Insulin resistance,IR)和血脂代谢异常等相关疾病,老龄化和老年肥胖已成为重要的公共卫生问题[1]。近年大量研究证明脂肪组织可分泌多种脂肪因子,其中内脏脂肪组织分泌的脂肪因子在老年和老年肥胖人群上述相关疾病中发挥重要的病理生理作用。Resistin[2]和Visfatin[3]是近年发现的脂肪因子,最初被认为促进肥胖和肥胖相关疾病发生发展,但随着研究深入,很多研究发现Resistin和Visfatin存在有益影响,与促进肥胖的观点相悖[4,5]。运动对老年及老年肥胖人群Resistin和Visfatin的影响目前尚不清楚。因此,本研究通过建立老年大鼠及老年肥胖大鼠模型,探讨运动处方在老年肥胖大鼠的减肥中对Resistin和Visfatin影响,为运动预防老年及老年肥胖相关疾病提供理论参考。
1 材料与方法
1.1 动物与分组
清洁级3周龄雄性SD大鼠50只,普通饲料喂养至大鼠55周龄。大鼠在18℃-20℃,相对湿度50%-70%的环境下分笼饲养,自由饮食饮水。采用体重无差异原则(P>0.05)分为对照组与肥胖组,对照组12只喂普通饲料(脂肪含量比为6.0%),肥胖组38只喂高脂饲料(脂肪含量比为40.0%),喂养5周。建模成功标准为:老年大鼠的标准为鼠龄60周,老年肥胖大鼠的标准为肥胖大鼠体重>120%对照组平均体重[6]。建模成功后,选取11只老年大鼠随机分为对照组(W)5只、运动组(WE)6只,随机选取老年肥胖大鼠12只分为对照组(F)6只、运动组(FE)6只。在建模和干预中各死亡1只大鼠。本次实验大鼠购于上海斯莱克实验动物有限责任公司(合格证号:2007000546402,许可证号:SCXK(沪)2012—0002),获得安徽师范大学动物伦理学会同意(20150225),符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》要求。
1.2 试剂与仪器
Resistin和Visfatin ELISA试剂盒(美国TSZ公司生产,上海研域生物科技有限公司代理,上海)。M-MLV反转录酶(M1705,Promega),Trizol(SN114,SunShineBioTM),GoTaq qPCR Master Mix(A600,Promega),Oligo dT15(SunShineBioTM),Random prime(SunShineBioTM),RNase Inhibitor(SunShineBioTM,R0004),100bp DNA Ladder(SN124,SunShineBioTM)。
大鼠跑台(Wi32812,北京),电子秤(JM-A20001,中国),电子分析天平(BS223S,北京),冷冻高速离心机(Centrifuge5417,Eppendorf),qRT-PCR仪(line-gene KFQD-48A,博日),酶标仪(Tecan Sunrise,瑞士),洗板机(Tecan Columbus Washer,瑞士)。
1.3 运动处方
此次实验的运动处方在本实验室前期的运动方案基础上进行改良[7]。干预前,大鼠适应跑台运动训练5天,每天3-5次。运动处方为跑台的坡度为0°,速度为15m/min,15min/组,4组/次,组间休息5min,总运动时间60min,1次/天,5次/周,持续运动8周。
1.4 样本采集
干预8周后,安静笼养2天,禁食12h,禁水6h,测大鼠体重。用10%的水合氯醛溶液(3.0mg/kg)经腹腔注射麻醉,麻醉成功后剖腹,取腹主动脉血,分离血浆,用ELISA测定血浆Resistin和Visfatin浓度。取睾周及肾周的内脏脂肪组织,先用滤纸吸干表面组织液,然后称其脂肪重量,取含血管少的一部分脂肪立即置于Trizol中,用qRT-PCR技术测Resistin和Visfatin的mRNA表达。
1.5 荧光定量PCR检测Resistin和Visfatin的mRNA表达及Visfatin Tm值
根据GenBank公布的SD大鼠Resistin和Visfatin基因和β-actin基因序列设计相应的引物,委托上海生工技术有限公司合成。

表1 Resistin and Visfatin的引物序列设计
用Trizol提取总RNA,以总RNA为模板逆转录合成cDNA。PCR扩增:在95℃反应条件下预变性2min,95℃变性10s→60℃退火60s→60℃延伸60s,40次循环;熔解曲线:60℃→95℃,每5s升温0.3℃,Resistin Tm值为87℃,Visf-atin Tm值为82℃。台阶检测,数据阈值与Ct值由软件自动得出。采用2-△Ct法来进行相对定量,△Ct=Ct(目的基因)-Ct(β-actin)。得出的Resistin和Visfatin数值均扩大1000倍。
1.6 ELISA检测Resistin和Visfatin的血浆浓度
血浆Resistin和Visfatin采用酶联免疫吸附试验(ELISA)测试,所有操作均按照试剂盒使用说明书严格执行。血浆Resistin和Visfatin浓度值均以标准品浓度作横坐标,对应OD值作纵坐标绘制标准品的线性回归方程。Resistin浓度的回归方程为y=0.087x+0.052,r=0.997,Visfatin浓度的回归方程为y=0.002x+0.008,r=0.998。代入Excel中得出数值乘以5即为样本实际浓度。
1.7 统计学方法
所有数据采用SPSS 17.0软件进行整理分析,正态分布数据以均数±标准差(M±SD)表示,组间差异比较均以单因素方差分析(one-way ANOVA)的LSD进行。P>0.05表示无显著性差异,P<0.05表示有显著性差异,P<0.01表示有非常显著性差异。
2 结果
2.1 运动后大鼠体重、内脏脂肪量及内脏脂肪率的比较
由表2知,(1)大鼠体重的表现为WE低于W,无显著性差异(P>0.05)。FE明显低于F,有非常显著性差异(P<0.01)。(2)大鼠内脏脂肪量的表现为F明显高于W,有非常显著性差异(P<0.01),WE低于W,有显著性差异(P<0.05),FE明显低于F,有非常显著性差异(P<0.01)。(3)大鼠内脏脂肪率的表现为F高于W,无显著性差异(P>0.05),WE明显低于W,有非常显著性差异(P<0.01),FE明显低于F,有非常显著性差异(P<0.01)。

表2 各组大鼠的体重、内脏脂肪量和内脏脂肪率的比较(X±SD)
注:elderly rats(W:control group,WE:exercise group);elderly obese rats(F:control group,FE:exercise group);内脏脂肪率=内脏脂肪量/体重×100%。与W组比较:△为P<0.05,△△为P<0.01;与F组比,▲为P<0.05,▲▲为P<0.01。
2.2 运动后大鼠Resistin的变化
2.2.1 运动后大鼠内脏脂肪Resistin mRNA比较 由表3可知,运动后大鼠内脏脂肪组织Resistin的mRNA表现为F高于W,无显著性差异(P>0.05),WE高于W,有显著性差异(P<0.05),FE高于F,无显著性差异(P>0.05)。
2.2.2 运动后大鼠血浆Resistin浓度比较 由表4可知,运动后大鼠血浆Resistin浓度的表现为F低于W,无显著性差异(P>0.05),WE低于W,无显著性差异(P>0.05),FE低于F,无显著性差异(P>0.05)。
表3 运动后各组大鼠Resistin的mRNA比较(X±SD)
Table 3 Comparison of resistin mRNA in rats after exercise

组别NResistin mRNA95%CIW523.286±10.16810.661-35.912WE650.491±23.242△26.100-74.881F523.897±6.63615.657-32.137FE639.881±18.59220.370-59.393
表4 干预后大鼠Resistin血浆浓度的比较(X±SD)(单位:pg/ml)
Table 4 Comparison of plasma concentrations of resistin in rats after intervention

组别NResistin95%CIW54.644±0.7793.676-5.611WE62.845±1.0211.774-3.916F54.299±1.9261.908-6.690FE63.669±2.2371.321-6.016
2.3 运动后大鼠Visfatin的变化
2.3.1 运动后大鼠内脏脂肪Visfatin mRNA比较 由表5可知,运动后大鼠内脏脂肪组织Visfatin mRNA的表现为F高于W,无显著性差异(P>0.05),WE高于W,无显著性差异(P>0.05),FE高于F,无显著性差异(P>0.05)。
2.3.2 运动后大鼠血浆Visfatin浓度比较 由表6可知,运动后大鼠血浆Visfatin浓度的表现为F低于W,无显著性差异(P>0.05),WE高于W,无显著性差异(P>0.05),FE高于F,无显著性差异(P>0.05)。

表5 运动后各组大鼠Visfatin的mRNA比较(X±SD)
表6 运动后大鼠Visfatin血浆浓度的比较(X±SD)(单位:pg/ml)
Table 6 Comparison of plasma concentrations of visfatin in rats after exercise
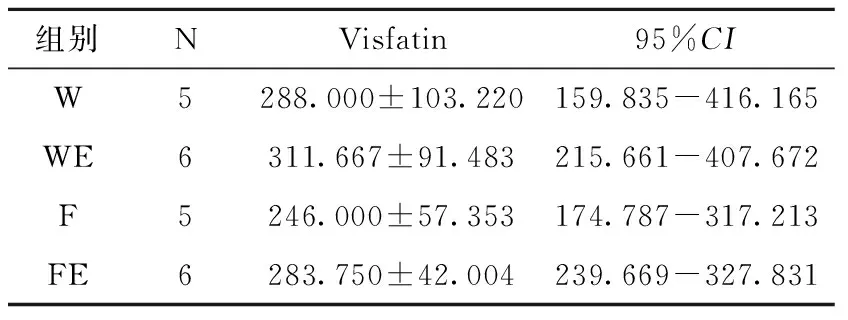
组别NVisfatin95%CIW5288.000±103.220159.835-416.165WE6311.667±91.483215.661-407.672F5246.000±57.353174.787-317.213FE6283.750±42.004239.669-327.831
3 讨论
3.1 运动对老年大鼠和老年肥胖大鼠减肥效果的影响
Matsuzawa[8]等人研究发现,内脏脂肪组织在IR和心血管疾病的病理生理学中的重要性高于皮下脂肪。Preis[9]等人研究发现,内脏脂肪与BMI之间相互作用,内脏脂肪与IR的相关性高于皮下脂肪,且肥胖患者的内脏脂肪与IR关系更密切。Fernández[10]等人研究表明,超重和肥胖会增加个体IR的风险,内脏脂肪的增加会导致慢性炎症增加,从而加重IR,随着内脏脂肪的增加,疾病易感性上升。有一项研究报告指出了内脏肥胖与年龄、空腹血糖水平、血脂、血压和性别之间存在相关性,其中年龄的增加与内脏脂肪增量密切相关[11]。衰老和肥胖是大多数心血管疾病的危险因素,会增加个体患2型糖尿病、脂肪肝、血脂异常、高血压等疾病的风险[12],伴随老年肥胖人群成为了上述疾病的易感群体,有的老年肥胖患者可能同时患有上述几种疾病。运动作为一种科学有效的减肥方法,已经广泛应用于肥胖患者的治疗处方中。Keating[13]等人的研究表明,不同运动量和运动强度都能有效降低内脏脂肪,虽然有些运动方式对体重影响不明显,但是内脏脂肪都会随着运动时间的延续而明显下降。本实验室前期研究证实,运动处方能显著降低超重肥胖男女大学生BMI、体脂及腰臀比,改善身体形态[14],8周运动可以导致大鼠的内脏脂肪量显著下降[7]。本研究发现,高脂饮食诱导的老年肥胖大鼠体重、内脏脂肪明显增多,在接受运动处方干预后,老年肥胖大鼠的体重和内脏脂肪量均下降明显,且运动后的内脏脂肪量与对照组老年大鼠相似,而老年大鼠减重效果不明显,但内脏脂肪量显著下降,可能是老年大鼠本身不肥胖,运动仅仅减去了老年大鼠的内脏脂肪。运动对老年肥胖大鼠的体重减轻和内脏脂肪的消除有很好的影响,对老年大鼠内脏脂肪的消除也有很好的影响,说明运动对老年和老年肥胖人群的健康十分有益。
3.2 运动对老年大鼠和老年肥胖大鼠Resistin的影响
Resistin在2001年由Steppan[2]等人首次描述,它首先在脂肪组织中被发现,因为其直接参与IR作用而命名。随后Moon[15]等人重组了老鼠Resistin,发现饮食诱导的小鼠和基因肥胖小鼠会糖耐量受损,阻断Resistin会改善肥胖小鼠的血糖浓度和葡萄糖耐受量,证实了Resistin过量表达会增加肥胖和IR的患病风险。Shuldiner[16]等人研究认为Resistin对胰岛素敏感性和葡萄糖转运影响较大,是肥胖导致IR的直接原因。但随着研究的深入,人们对Resistin与IR的关系产生质疑。本实验室前期研究发现,8周运动处方减肥效果明显,但Resistin水平变化不明显,Resistin与女大学生的体重、体脂和BMI无相关性,与男女大学生的血糖也无相关性[17]。Koebnick[4]对肥胖受试者进行4个月的减肥干预后,发现人的Resistin是不可缺少的,Resistin参与调节胰岛素敏感性,是脂代谢的调节因子,维持脂肪组织的储存,诱导脂肪酸再酯化,随着受试者的体重与肥胖指标得到改善,血浆Resistin浓度上升。De Luis[18]等人通过对重度肥胖患者减肥手术后随访一年发现,患者的体重、腰围、体脂率、血压、总胆固醇均明显下降,但甾醇、低密度脂蛋白、胆固醇、甘油三酯水平无明显变化,且Resistin水平在术后小幅度上升。Olszanecka[19]等人对比了19名肥胖受试者与22名正常受试者后发现,Resistin在肥胖和正常受试者中没有相关性,提示Resistin与肥胖没有直接关系。Baris[20]等对3000多老年人进行10个月的调查,发现Resistin与代谢炎症标志物C反应蛋白(C-Reactive protein,CRP)、肿瘤坏死因子(Tumor necrosis factor,TNF-α)和IL-6关系不大,提示Resistin与炎症也没有直接关系。Hayashino[21]等人研究发现,运动使2型糖尿病(Type 2 diabetes,T2D)患者的IL-6和CRP降低,且随着运动持续时间延长,IL-6和CRP水平下降更明显,但Resistin、瘦素等脂肪因子的水平没有发生变化。本研究显示,老年大鼠与老年肥胖大鼠Resistin的mRNA表达和血浆浓度没有差异,提示Resistin作为一个脂肪因子可能并不参与老年肥胖进程,Resistin的生理功能有待进一步研究。运动处方能明显升高老年大鼠Resistin的mRNA表达,对老年大鼠及老年肥胖大鼠血浆浓度影响不明显,运动对Resistin的影响结果存在不一致性,具体原因有待进一步研究。
3.3 运动对老年大鼠和老年肥胖大鼠Visfatin的影响
Visfatin是一种脂肪细胞因子,在脂肪细胞和免疫细胞中表达。先前的一些研究认为Visfatin与肥胖关系密切,血浆Visfatin在肥胖和T2D患者中表达增加,被认为是有害的,但是具体的生理作用机制还不完全清楚[3]。尽管大多数实验研究都指向Visfatin的有害作用,但近年来,有些研究表明Visfatin可能是正常生理活动中必不可少的蛋白。Kim[5]等人切除糖尿病大鼠部分胰腺后,血浆Visfatin没有发生变化,而中枢Visfatin增多改善了糖尿病大鼠下丘脑的胰岛素分泌和胰岛素敏感性,维持血糖稳态,证实中枢Visfatin是一种调节血糖稳态的正向调节剂。Hallschmid[22]等人对38名受试者进行分析,发现脑脊液中存在Visfatin,且脑脊液的Visfatin水平随着体重增加而降低。Ingelsson[23]等人调查了374名社区居民,发现Visfatin水平与年龄和甘油三酯水平无关,与临床用于检测内脏脂肪的指标也没有显著相关性,同时与血脂异常、肥胖以及糖尿病也无明显关系。Ersoy[24]等人研究发现女性的Visfatin与脂肪分布没有关系,Visfatin与肥胖参数BMI、腰臀比和IR没有相关性,与血脂参数之间也没有相关性。Dimitriadis[25]等人重组了小鼠的Visfatin后发现,Visfatin增加了分化的T37i细胞的表达,上调末端结合蛋白1,末端结合蛋白2和骨形态发生蛋白7,通过激活IL-6/STAT3通路阻止巨噬细胞的凋亡。Lim[26]等人通过诱导小鼠心肌缺血,再给该小鼠心肌注射Visfatin发现能明显减少心肌梗死面积,可能机制为Visfatin在心肌再灌注时是通过激活PI3K/Akt和MEK1/2和抑制MPTP开放而介导的直接细胞效应来保护心肌的。Veer[27,28]等人发现Visfatin是一种调节辅酶I生物合成、辅酶I依赖性蛋白去乙酰化、血管平滑肌细胞生存能力的细胞内蛋白,能够防止小鼠神经元突变,Visfatin的增多能够促进血管平滑肌细胞的存活,激活SIRT2;他的另一项研究将Visfatin基因导入衰老的人平滑肌细胞内,发现Visfatin可以延缓衰老,延长细胞寿命,增加细胞抵抗氧化应激的能力,Visfatin通过降低p53在SIRT1的靶标赖氨酸382上乙酰化的比例,抑制了细胞衰老,说明Visfatin可通过优化SIRT1介导的p53降解来增加人血管平滑肌细胞的寿命。Plinta[29]等人对50名青年职业篮球和手球运动员在集训期的研究发现,3个月的密集速度训练会使Visfatin水平上升。本研究显示,老年大鼠与老年肥胖大鼠Visfatin mRNA表达和血浆Visfatin浓度差异不明显,没有发现Visfatin可以促进肥胖;本运动处方对老年大鼠与老年肥胖大鼠内脏脂肪组织Visfatin mRNA表达和血浆Visfatin浓度影响甚微,可能是由于Visfatin在老年大鼠和老年肥胖内脏脂肪组织和血浆中含量过低导致的,具体原因有待进一步研究。
综上所述,本运动处方能够降低老年大鼠和老年肥胖大鼠内脏脂肪量以及内脏脂肪率,具有显著减肥效果。老年大鼠和老年肥胖大鼠的Resistin和Visfatin mRNA表达及血浆Resistin和Visfatin浓度差异不明显,Resistin和Visfatin对老年肥胖的发生发展影响较小,运动仅对老年大鼠内脏脂肪组织Resistin mRNA表达有影响。运动对老年肥胖大鼠内脏脂肪组织Resistin和Visfatin mRNA表达及血浆浓度影响甚微,可能是Resistin和Visfatin本身在老年肥胖大鼠中含量较少,Resistin和Visfatin在老年肥胖的发生发展中影响较小导致的,具体机制有待进一步研究。

