p62/SQSTM1与自噬在胃癌组织中表达及临床意义
林海凤,陈智伟,刘芳芳
(1.莆田学院附属医院 消化内科,福建 莆田 351100;2.莆田学院附属医院 病理科,福建 莆田 351100)
0 引言
自噬广泛存在于真核细胞中,泛指将受损的细胞器和大分子物质(包括蛋白聚集体或异常折叠蛋白、病原体)转运至溶酶体降解,分解后小分子物质在细胞质中循环回收的高度保守多步骤过程。自噬几乎发生在所有的细胞内,是细胞内物质分解代谢的重要途径,具有维持蛋白代谢平衡和内环境稳定的功能[1]。自噬和胃癌的关系近年来成为研究热点。p62/SQSTM1(以下简称p62)是细胞内多功能衔接蛋白,在多条细胞信号中起重要作用,是参与自噬调控、凋亡和肿瘤发生的关键蛋白[2]。微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)位于自噬体双层膜上,是自噬体的标志分子,通过检测LC3蛋白量可判断细胞自噬功能的变化[3]。先前研究已证明,LC3与胃癌的发生、发展相关[4],本研究探讨p62在胃癌组织中与自噬的关系及作用。
1 资料与方法
1.1 一般资料
一方面,收集2012年8月至2013年9月190例胃癌组织和90例癌旁正常组织石蜡标本行免疫组织化学检测,入选的标准包括:1)根治性切除手术;2)术前未行新辅助化疗;3)术后病理明确为腺癌;4)临床病理资料完整,随访可靠。排除标准:1)因梗阻、出血急诊行手术治疗;2)联合脏器切除;3)术后30 d内死亡;4)术后病理提示间质瘤、淋巴瘤等。另一方面,收集2018年1月至2018年4月新鲜胃癌标本40例,PT-PCT法检测胃癌和癌旁正常组织中p62 mRNA的表达水平。用免疫印迹法检测p62和LC3蛋白的表达量。随访截止时间为2018年9月。
1.2 主要试剂
p62单克隆抗体购自Abcam公司。免疫组化试剂盒和二胺基联苯胺显色试剂盒购自Thermo公司。蛋白裂解液、BCA蛋白定量试剂盒等均购自Promega公司。逆转录试剂盒、实时荧光定量PCR试剂盒等均购自TaKaRa公司。Trizol试剂购自Invitrogen公司。
1.3 实验方法
免疫组织化学(采用SP法)检测:常规石蜡切片,脱蜡、水化、微波热修复抗原,滴加正常山羊血清封闭液孵育20min,滴加一抗4℃过夜,漂洗后加二抗,37℃孵20min,二氨基联苯胺(DAB)显色后镜下控制染色,苏木精复染,脱水、透明、封片。
免疫组织化学评价是基于染色细胞比例及染色强度,以两者乘积得分评判p62染色结果。染色细胞比例分为:0(阴性)、1(<30%阳性)、2(≥30%阳性)。染色强度分为:0(阴性),1(淡黄色)、2(棕黄色)、3(棕褐色)。两者相乘得出总得分:0~3分为阴性,≥4分为阳性。
RT-PCR:用Trizol法提取总RNA,逆转录反应合成cDNA,以cDNA为模板,扩增p62基因。PCR反应条件:94℃预变性10min;94℃变性30s,60℃退火60s,72℃60s延伸,共40个循环;72℃延长10min。p62上游引物序列:5′-AGCTGCCCTCAGCCCTCTA-3′,下游引物序列:5′-GGCTTCTCTTCCCTCCATGTT-3′。看 家 基 因GAPDH上游引物序列:5′-ACCACAGTCCATGCCATCAC-3′,下游引物序列:5′-TCCACCACCCTGTrGCTGTA-3′。
免疫印迹方法:将组织研磨成细胞悬液,蛋白裂解液裂解,提取总蛋白,将样品在SDSPAGE胶上电泳、转膜、封闭,加p62抗体(1∶1000)孵育过夜,加二抗(1∶1 000)避光孵育2 h,ECL进行显影、定影。GAPDH作为内参。
1.4 统计学分析
计数资料采用卡方检验,计量资料符合正态分布采用t检验,符合偏态分布采用Wilcoxon秩和检验。采用Kaplan-Meier法绘制生存曲线,以Log-rank检验进行生存分析。先采用COX回归模型行预后单因素分析,将有意义的参数行多因素分析,并计算OR和95%可信区间,Pearson相关性分析比较p62和LC3两者的相关性,P<0.05为差异具有统计学意义。
2 结果
免疫组织化学检测结果:190例胃癌石蜡标本中,男133例,女57例,平均年龄59.4±12.1岁。p62位于细胞核和细胞质中,石蜡标本中p62阳性率为50.5%(96/190)高于癌旁正常组织的15.5%(14/90)(P<0.05),见图1、图2。胃癌组织中p62阳性率与病理分期、浸润深度、淋巴结转移有关(P<0.05),与性别、年龄、肿瘤部位、术前白蛋白水平、分化程度、肿瘤大小、手术方式、Borrmann分型无关(P>0.05),见表1。p62阳性的患者5年生存率为33.2%,低于p62阴性患者的55.3%(P <0.05),见图3。单因素分析表明,肿瘤大小、分化程度、病理分期、p62与预后有关(P<0.05);多因素分析表明分化程度、病理分期、p62是影响预后的独立危险因素(P<0.05),见表2。

图1 p62在胃癌组织中表达阳性(SP×400倍)
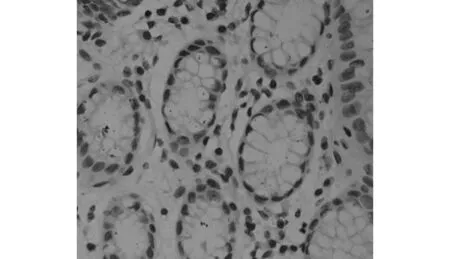
图2 p62在正常胃粘膜组织中表达阴性(SP×400倍)

表1 p62与临床病理特征的关系
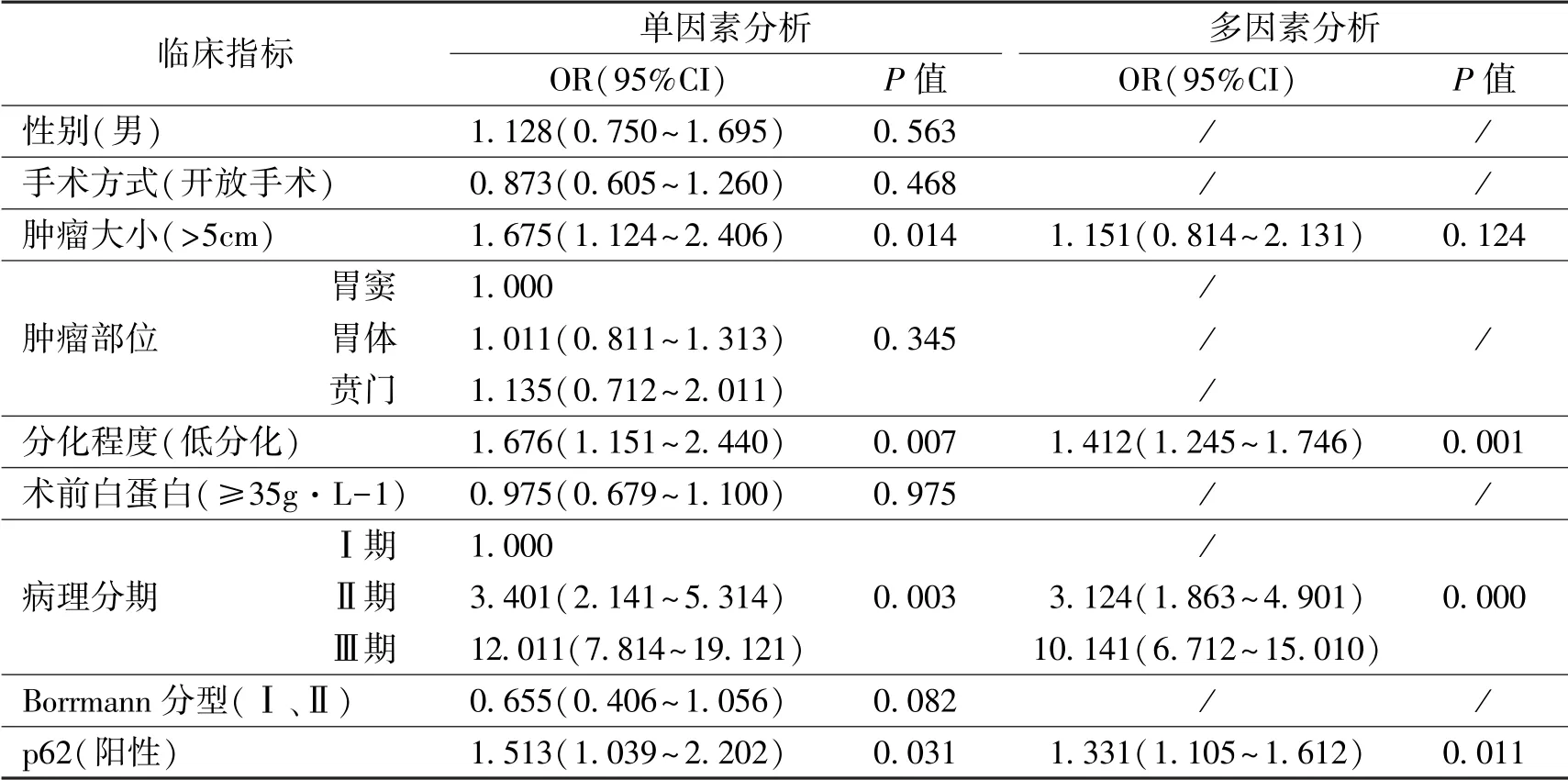
表2 临床病例特征与预后的关系
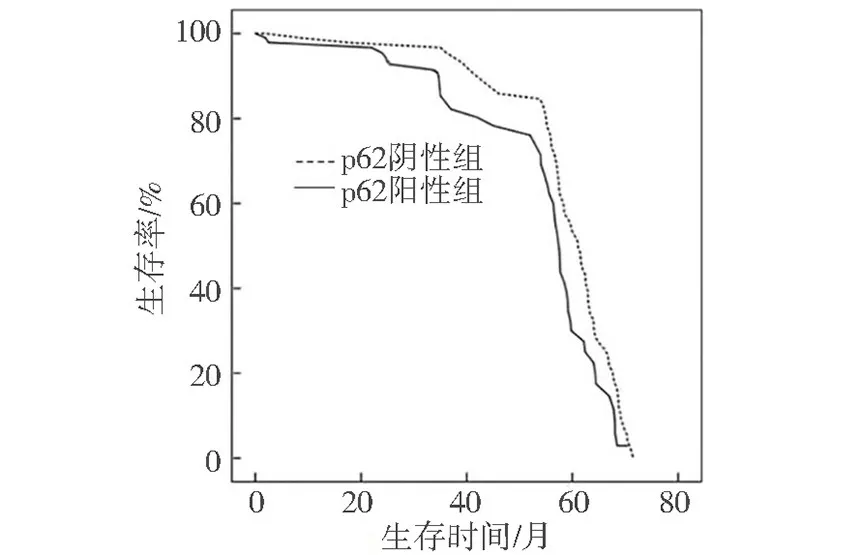
图3 p62阳性和阴性的生存曲线
RT-PCR结果扩增曲线呈S型,溶解曲线呈单峰。RT-PCR显示在40例新鲜胃癌组织中,胃癌的p62 mRNA表达水平为2.814±1.156,高于在癌旁正常组织中的1.632±1.061(P<0.05)。
免疫印迹检测结果表明,在40例胃癌组织和癌旁正常组织中,胃癌组织中p62蛋白和LC3的表达量分别为1.513±0.214和1.914±0.123,见图4、图5,两者表达量呈正相关(r=0.811,P<0.05),且明显高于癌旁正常组织的0.821±0.091和1.017±0.118(P<0.05)。
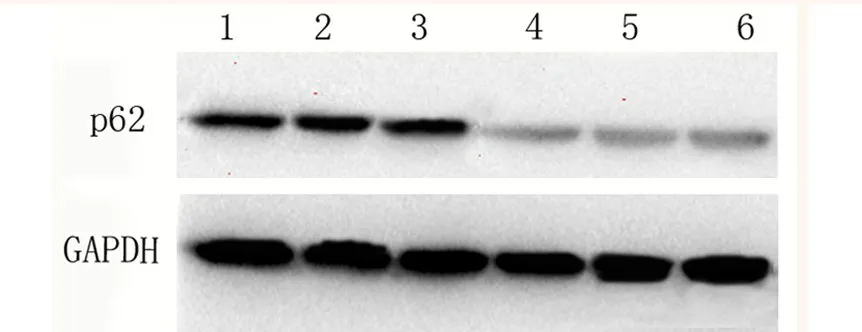
图4 p62蛋白表达水平
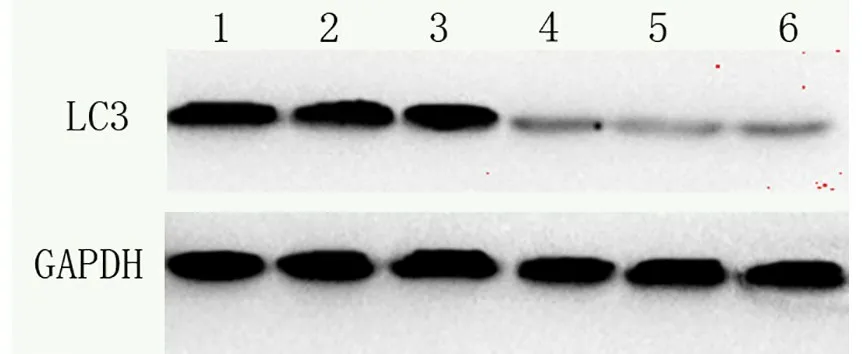
图5 LC3表达水平
3 讨论
自噬几乎存在于所有真核细胞中,是维持细胞生命活动所必需的。自噬是多步骤、复杂的过程,细胞内通过形成双层膜囊泡的自噬体,识别并包裹受损细胞器或错误折叠蛋白,并转运至溶酶体分解。正常情况下,自噬维持细胞内环境稳定和保持物质动态平衡。一方面,自噬功能受影响时,会导致异常蛋白质和细胞器的堆积,引起多种疾病的发生,比如肿瘤、神经退行性疾病;另一方面,当出现营养匮乏时,自噬分解大分子物质(比如DNA/RNA、碳水化合物、蛋白质和甘油三酯)形成核酸、葡萄糖、氨基酸和游离脂肪酸,有利于为细胞合成提供能量的ATP,通过三羧酸循环(TCA)维持细胞的功能[5]。自噬缺陷与基因组损害、代谢应激、肿瘤发生有关[6]。
p62是自噬体膜特异性识别底物至关重要的蛋白,在自噬的过程选择性地与底物(如细胞内垃圾蛋白)结合,通过直接与自噬泡膜的LC3蛋白链接,将底物转运至溶酶体中,进而与溶酶体结合,促使底物被降解[7]。本研究中胃癌组织中的p62表达水平比癌旁正常组织高,表明p62参与胃癌的发生。哺乳动物细胞中LC3是酵母菌自噬相关基因(autophagy-related gene,ATG)ATG8的同源物,牢固地固定在自噬泡膜表面,通过检测LC3的蛋白量可判断自噬功能强度。本文中p62与LC3呈正相关,说明p62在胃癌中的表达与自噬有关。肿瘤细胞快速生长、增殖需要足够的氧气、能量和营养物质。当实体瘤直径>2 mm时,由于血管生成不足无法输送充足的氧气及能量至整个肿瘤,导致肿瘤内存在局部缺氧和缺氧状态(氧饱和度分别为<3%和0.1%)[8]。因此,肿瘤细胞在面临缺血、缺氧及饥饿环境下进入休眠状态,需要新的代谢途径应对代谢压力。自噬通过降解自身物质合成氨基酸和核苷酸等,为肿瘤细胞生长、增殖提供额外的原料,能提升肿瘤细胞耐受营养缺乏。
p62与病理分期、肿瘤浸润深度、淋巴结转移有关,说明p62参与了肿瘤的转移。当肿瘤细胞侵袭和转移的过程开始时,肿瘤细胞与邻近细胞、细胞外基质脱落,经过上皮细胞-间充质细胞获得迁移和侵袭能力。失巢凋亡指当细胞与其周围的基质和邻近细胞分离后而被动启动死亡的过程[9]。自噬不但可使肿瘤细胞克服失巢凋亡成为转移灶,并且当肿瘤细胞进入淋巴管、血管达到远处后,直到与细胞外基质连接一起才解除休眠状态,自噬有助于肿瘤细胞在这营养匮乏期间保持存活状态[10]。
p62是胃癌预后的独立危险因素,可能一方面自噬降低肿瘤细胞对放化疗的敏感性,另一方面自噬使肿瘤细胞抵抗细胞凋亡刺激。通过抑制自噬,可使肿瘤细胞进入程序性死亡[11]。因此,在放化疗中加入自噬抑制剂可能通过增加肿瘤细胞凋亡而改善患者的预后。
p62的表达参与了胃癌的发生、发展,可作为评估胃癌预后的重要工具,为靶向治疗开辟新的途径。但p62与自噬、肿瘤间作用的具体机制有待进一步研究明确。

