高龄高血压伴良性前列腺增生患者脉压与下尿路症状的相关性
陈 钰
(苏州大学附属第一医院老年医学科,江苏 苏州 215006)
高血压与良性前列腺增生(benign prostatic hyperplasia, BPH)均是老年男性的常见病及多发病。随着人均寿命的延长,在高龄人群中,两者往往同时存在。流行病学数据显示,70 岁以上人群约1/2患有高血压,而60 岁以上男性至少有30%同时合并有BPH和高血压[1]。国外有研究[2]表明,在年龄、血糖、血脂水平基本匹配的两组中,高血压病组老年男性的前列腺体积(prostate volume,PV)和国际前列腺症状评分(international prostate symptom score, IPSS)显著高于血压正常组(对照组)。近年国内也有研究[3]报道,高血压病史超过10 年且合并BPH患者的PV、IPSS和前列腺特异性抗原(prostate specific antigen, PSA)水平均显著高于单纯BPH者,而病史短于10 年者差异也有统计学意义。上述研究均证实高血压与PV及IPSS有密切关系。脉压(pulse pressure, PP)是心脑血管病发生和死亡的独立危险因子,其对心脑血管疾病发生和死亡的预测作用甚至大于收缩压和舒张压[4]。本研究回顾性分析了118 例合并高血压及BPH的高龄老年男性患者PP与PV、IPSS的相关性,从而指导临床的诊断和治疗。
1 资料与方法
1.1 对象 选择2016年1月—2018年12月在苏州大学附属第一医院老年医学科住院的118 例老年男性患者。其年龄均在80 岁以上,合并原发性高血压[收缩压≥140 mmHg和(或)舒张压≥90 mmHg]和BPH(PV>20 mL)。排除以下情况:PV<20 mL;继发性高血压患者(如肾动脉狭窄引起的高血压、肾上腺嗜铬细胞瘤等);存在心房纤颤、严重的传导阻滞和重度心功能不全;服用α-受体阻滞剂;服用5α还原酶抑制剂超过3 个月;有前列腺电切术或剜除术史;存在认知功能障碍,无法正常交流和理解IPSS项目。本研究经我院伦理委员批准同意,所有患者均签署知情同意书。
1.2 方法
1.2.1 24 h动态血压监测方法:采用无锡市中健科仪有限公司CB-2302-A型动态心电血压记录仪测量118 例患者的24 h动态血压,袖带绑于左上臂,设定08:00~23:00为日间,23:00~次日08:00为夜间。白昼每15 min、夜间每30 min测量一次。收集患者24 h平均收缩压(24h-SBP)、24 h平均舒张压(24h-DBP)、24 h平均脉压(24h-PP),白昼平均收缩压(d-SBP)、白昼平均舒张压(d-DBP)、白昼平均脉压(d-PP),夜间平均收缩压(n-SBP)、夜间平均舒张压(n-DBP)、夜间平均脉压(n-PP)。平均PP=平均收缩压-平均舒张压。血压单位为mmHg。
1.2.2 PV及下尿路症状测评方法:经腹SSI-6000型彩超测量前列腺的左右径、上下径和前后径,单位cm,计算PV(PV=前列腺左右径×上下径×前后径×0.52),单位mL。采用IPSS评估受试者下尿路症状。评分根据7个问题得出。其中2、4、6、7项属于储尿期症状;1、3、5项属于排尿期症状。每项1~5 分,总分0~35 分,其中0~7 分为轻度症状、8~19 分为中度症状、20~35 分为重度症状。
1.3 统计学方法 本研究根据IPSS评分将118 例患者分成轻中重三组,组之间各参数的比较使用Whitney U检验(非参数检验);检验双变量的相关性采用Spearman等级相关分析。统计分析软件采用SPSS 17.0,P<0.05(双侧)表示差异有统计学意义。
2 结果
2.1 一般资料比较 三组在年龄、高血压病程、体重指数(BMI)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、糖化血红蛋白(HbA1c)方面差异均无统计学意义(P>0.05)。
2.2 IPSS与PP 24h-PP、d-PP和n-PP在三组间两两比较差异均有统计学意义(P<0.05),即重度组>中度组>轻度组。Pearson等级相关分析结果显示IPSS与24h-PP和d-PP呈正相关。而与n-PP无统计学意义上的相关。(表1、表2)
2.3 IPSS与PV 重度组的PV大于中度组和轻度组(P<0.05),而PV在中度组和轻度组差异无统计学意义(P>0.05)。IPSS与PV呈正相关。(表1、表2)
2.4 PP与PV PV与24h-PP、d-PP呈正相关。而与n-PP无统计学意义相关。(表1、表2)

表1 IPSS 轻、中、重度三组间PP及PV比较
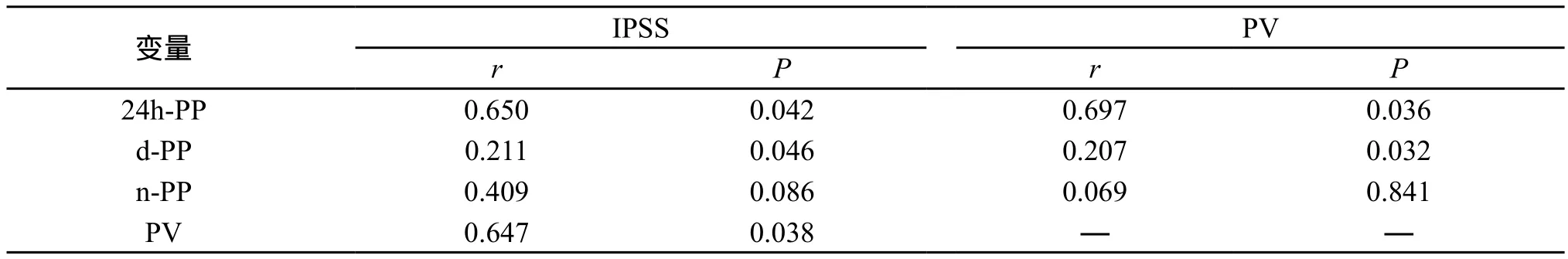
表2 IPSS、PV与PP的相关性
2.5 直线回归分析 为明确变量参数是否独立影响IPSS结果,我们将PP、PV代入直线回归分析。结果显示,24h-PP,d-PP和PV是IPSS的独立影响因子。(表3)

表3 IPSS的多变量Logistic回归分析
3 讨论
BPH是以前列腺增大为主要病理学特征的一种常见的老年男性疾病。可引起排尿困难、尿潴留、肾功能异常甚至肾衰竭,严重影响了人们的生活质量。高血压亦是老年男性的常见病。既往有研究资料[5]提示高血压是BPH的危险因素,高血压患者BPH的患病率明显高于对照组。有研究进一步表明,高血压与前列腺相关下尿路症状及严重程度存在相关性[6],与血压正常的同龄BPH患者相比,合并高血压的患者,其下尿路症状更严重[7],更容易发生血尿,更早因下尿路症状接受手术治疗[8]。而BPH所致的下尿路症状分为储尿期和排尿期症状,其症状严重程度一般用IPSS予量化评价。
老年高血压一般表现为收缩期的高血压及脉压差增大,故对于老年高血压合并BPH的患者来讲,收缩压及PP与PV及下尿路症状更为密切。在本研究中,我们采取了24 h动态血压监测,排除了单次血压的偶然性,同时也避免了情绪、环境、运动、进食、吸烟、饮酒等因素影响血压,更加客观真实地反映了患者的血压情况;且动态血压能监测患者24 h血压的变化规律,能细化为白昼血压与夜间血压,更为详细地阐述了血压与下尿路症状的关系。本研究三组间两两比较,24h-PP、d-PP、n-PP差异均有统计学意义(P<0.05),且24h-PP,d-PP与IPSS及PV呈正相关。其原因可能如下:老年男性随着年龄的增长,交感神经系统活性逐渐增加,血液中去甲肾上腺素水平升高且去甲肾上腺素释放频率也升高。而血管内皮产生的舒血管因子一氧化氮(NO)减少,从而使依赖于NO的血管舒张作用减弱[9];同时动脉壁中层弹力纤维随着年龄增加出现断裂、减少,脂质和钙质沉积,结缔组织生成增加,导致动脉管腔变窄,硬度增加,血管顺应性降低,弹性扩张能力下降,血管压力得不到缓冲[10-11]。上述情况导致高血压患者血压上升。而血管硬化后,主动脉弹性回缩降低又进一步造成舒张压下降,从而使PP增大。增大的PP使血液对血管壁的“冲击”作用增强,导致血管壁更易受损,形成动脉粥样硬化[12-13]。而前列腺的血管硬化、损伤后,可刺激前列腺间质细胞分泌多种生长因子诱发前列腺间质增生肥大,从而导致PV增加,出现下尿路梗阻症状[14]。同时Chen等[15]亦指出,盆腔血管动脉硬化可导致膀胱和前列腺缺血,这也是BPH发病的因素之一,并可引起下尿路症状加重。这和本研究结果相一致。一般来说,交感神经呈现昼夜节律变化,在白天兴奋,夜间会被抑制,因此高血压患者一般白天PP更大,对PV及下尿路症状影响更显著。本研究结果显示,d-PP与PV及IPSS呈正相关,并是IPSS的独立影响因子。
另一方面,血管内皮损伤可增加血管内皮生长因子(VEGF)分泌。VEGF是体内重要的血管生长因子,具有促进血管内皮细胞增殖、增强血管通透性及改变细胞外基质的作用[16]。VEGF可促进前列腺基质及血管新生,并可增加血尿等下尿路症状的发生率。病程越长对PV的影响越显著,下尿路症状越重,IPSS评分越高[17]。
综上所述,对于高龄老年高血压合并BPH的患者,其24h-PP及d-PP与PV及下尿路症状密切相关。控制高血压患者的PV,改善血管硬化,可减少BPH的发生,延缓下尿路症状的出现,减轻下尿路症状的程度,提高老年患者的生活质量。

