IL-9+CD4+T细胞及相关因子在结直肠癌患者外周血中的表达*
廖存, 曹云飞, 钟武, 马晓飞, 胡丽霞, 葛巍, 钟世彪, 张磊昌△
1广西医科大学第一附属医院结直肠肛门外科(广西南宁 530021); 2赣州市人民医院普外科(江西赣州 341000); 3江西中医药大学附属医院肛肠科(江西南昌 330006); 4江西中医药大学(江西南昌 330004); 5广西壮族自治区民族医院肛肠科(广西南宁 530001)
根据国家癌症中心2014年的数据,中国结直肠癌的病死率为10.05/10万,在恶性肿瘤病死率中排第5位[1],根据最新美国癌症协会数据表明[2],结直肠癌的发病率在肺癌和前列腺癌之后,是世界上常见的第三大恶性肿瘤。肿瘤微环境主要由肿瘤细胞、免疫细胞、内皮细胞和成纤维细胞等基质细胞及其分泌的活性介质共同组成,它们参与了肿瘤的发生、转移及进展过程[3]。研究表明[4]CD4+T细胞通过γ干扰素(IFN-γ)依赖途径直接清除肿瘤细胞,另一方面,免疫调节功能激活CD8+T细胞间接激活、产生对记忆性细胞毒性T细胞的反应、并维持期存活。最新研究发现,IL-9+CD4+T细胞是可以通过白细胞介素(IL)-4及转化生长因子-β(TGF-β)体外诱导的新型效应T淋巴细胞,前期研究显示,IL-9+CD4+T细胞于结肠癌的发生密切相关[5],但目前IL-9+CD4+T细胞在国内的相关研究还较少见。通过流式细胞技术获得结直肠癌患者外周血中IL-9+CD4+T细胞的表达,通过实时荧光定量PCR(qRT-PCR)检测相关细胞因子的分布和表达,以研究IL-9+CD4+T细胞在结直肠恶性肿瘤发病机制及作用。
1 资料与方法
1.1 一般资料 2017年6月至2018年2月在广西医科大学第一附属医院初次行结直肠癌手术治疗的患者外周血60例,同时收集20例健康志愿者[男12例,女8例,年龄32~65岁,平均(47.35±17.65)岁,外周血作为健康对照组。所有患者术前均未接受任何化学或放射治疗及免疫治疗,近期无感染性疾病或服用免疫抑制制剂,且术后病理证实为结肠或直肠腺癌。60例入选本次实验的结直肠癌基本资料如下:男31例,女29例:年龄39~78岁,平均(49.52±18.57)岁;≥60岁42例,<60岁18例;壮族37例,汉族23例;参照Dukes分期标准(2010年修改的国际抗癌联盟和美国肿瘤联合会联合制定), 15例Dukes A、B期患者(25.0%),45例Dukes C、D期患者(75.0%)。直肠癌27例,结肠癌33例。收集患者的临床相关资数据,如性别、年龄、肿瘤部位、肿瘤大小、术前癌胚抗原(CEA)水平等。该研究获得所有受试者同意,并得到医院伦理委员会的批准。
1.2 主要仪器与试剂 液佛波酯(PMA)、离子霉素(Ionomycin)和蛋白转运抑制剂(Golgistop)购自Sigma,USA;流式用荧光抗体PE-cy5标记的CD4抗体、PE标记的IL-9抗体及相应的同型对照购自美国BD。购自美国GIBICO公司的胎牛血清FBS,购自中国Solarbio公司的RPMI1640,Ficoll-hypaque分离液位为瑞典Pharmacia公司的产品。C6 Flow Cytometer® System流式细胞仪购自美国BD公司。从中国天根公司购买总RNA提取试剂盒;购自美国Fermentas公司的逆转录试剂盒;实时荧光定量聚合酶链反应SYBR Green荧光购自Thermo Fisher,USA。
1.3 方法
1.3.1 外周血中IL-9+CD4+T细胞的分布 结直肠癌患者的术前和健康对照组在早晨抽取3 mL空腹静脉血,将其缓慢加入装有3 mL Ficoll-hypaque淋巴细胞分离液的15 mL无菌离心管中,进行梯度离心(转速=2 500 r/min,r=6 cm,T=30 min),取其中间云雾状细胞,即为外周血单个核细胞(PBMC),分别加入PMA/Ionomycin混合液2 μL前用PBS反复洗涤2次、Golgistop 1 μL后在培养箱中(37℃,5%CO2)孵育5 h。加入PE-cy5标记的CD4抗体避光孵育15 min后添加破膜剂;加入细胞内PE标记的IL-9抗体,并将相应剂量的相同类型抗体加入对照管组,并在室温下在黑暗中孵育30 min,用1%FBS-PBS液分别洗涤2次,高速离心5 min(1 500 r/min,r=6 cm),添加固定液多聚甲醛后稀释到200 μL每管并移入流式检测管中,用Becton Dikison FACS Calibur流式细胞仪进行上机检测。
1.3.2 荧光定量PCR反应 缓慢加入3 mL外周血至相同量的Ficoll-hypaque淋巴细胞分离液的无菌离心管中进行梯度离心分离30 min(转速=2 500 r/min,r=6 cm),取其中间云雾状细胞即为PBMC,然后通过常规的Trizol 方法提取组织总RNA,并根据试剂盒说明通过cDNA的逆转录扩增靶基因和内参基因β-激动蛋白,最后电泳分析。PCR引物序列见表1。

表1 待测基因引物序列
使用qRT-PCR,β-acting作为内参基因,根据公式2-ΔΔCT计算结直肠癌患者外周血中细胞因子IL-9、转录因子PU.1及趋化因子CCL-2、CCL-5、CCL-20、CCL-27的表达量。

2 结果
2.1 结直肠癌患者外周血中IL-9+CD4+T细胞比例 流式细胞仪检测结果显示:结直肠癌患者外周血中IL-9+CD4+T细胞的比例为(1.14±0.25)%,健康对照组为(0.25±0.17)%,两者比较,差异有统计学意义(t=-7.215,P<0.05),见图1。
2.2 IL-9+CD4+T细胞比率与临床病理因素相关性 结直肠癌淋巴结转移为阳性患者的(Ducks C+D)外周血中IL-9+CD4+T细胞比例明显高于结直肠癌淋巴结转移为阴性的患者(Ducks A+B期),比较两组结果,差异有统计学意义(P<0.05);不同性别、年龄、肿瘤部位、肿瘤最大径、肿瘤分化程度的患者外周血中IL-9+CD4+T细胞比较,差异均无统计学意义(P>0.05)。见表2。
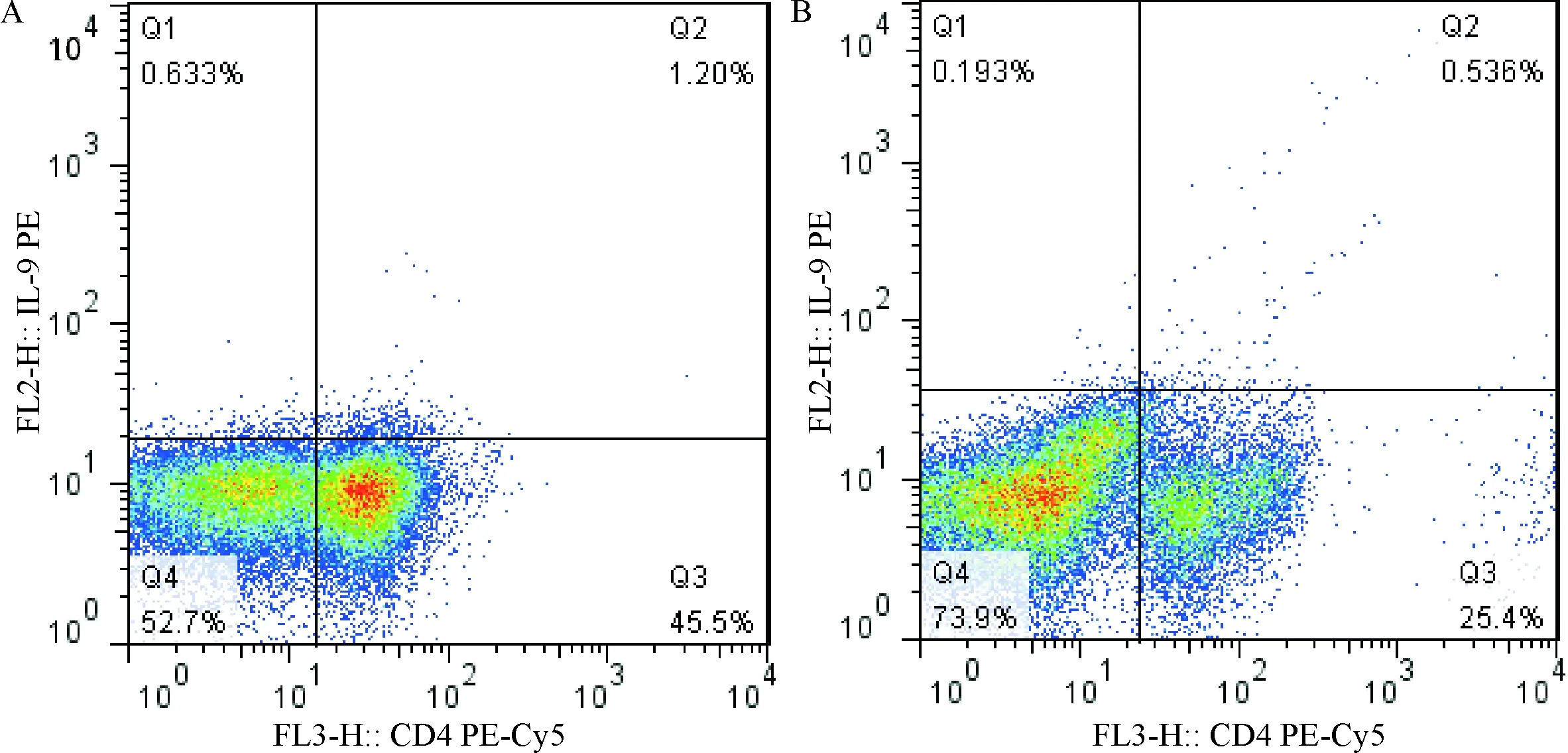
注:A: 结直肠癌患者流式细胞图;B: 健康志愿者外周血流式细胞图
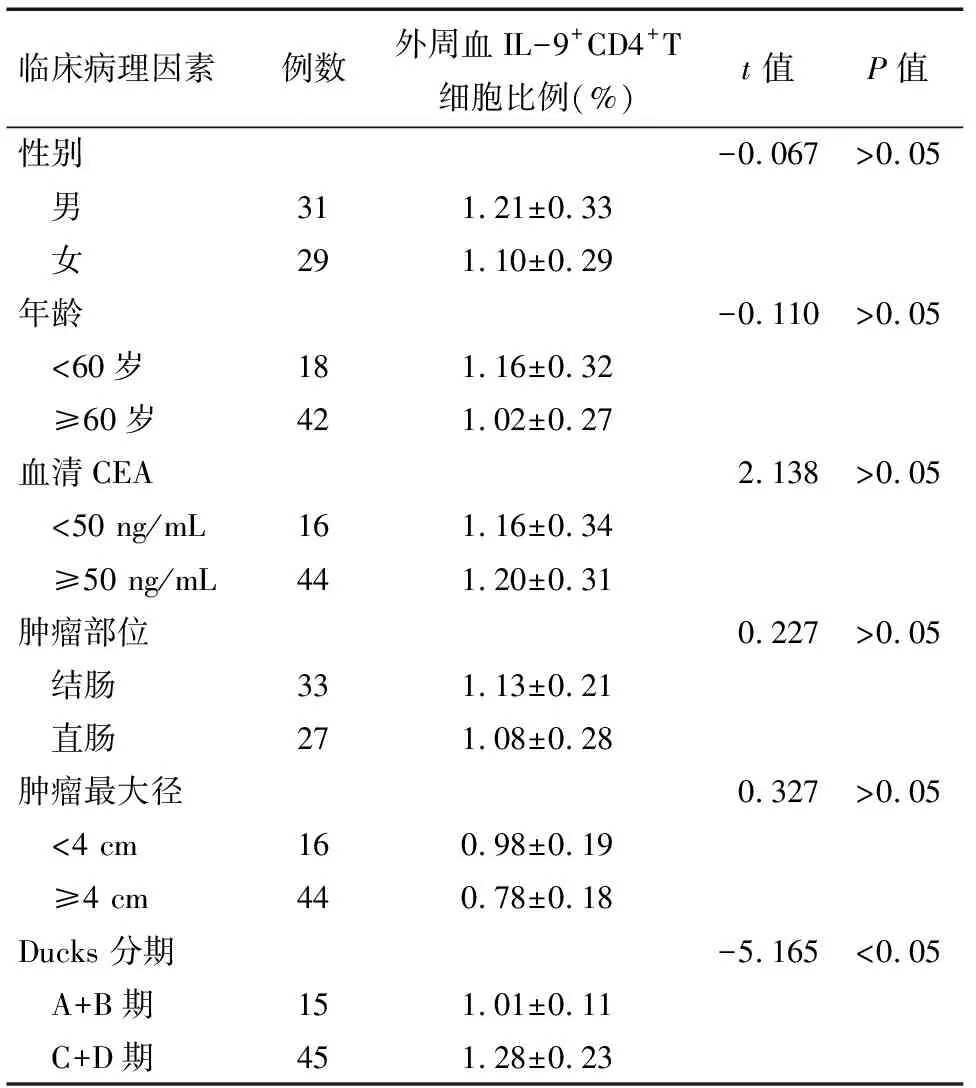
临床病理因素例数外周血IL-9+CD4+T细胞比例(%)t 值P值性别-0.067>0.05 男311.21±0.33 女291.10±0.29年龄-0.110>0.05 <60岁181.16±0.32 ≥60岁421.02±0.27血清CEA2.138>0.05 <50 ng/mL161.16±0.34 ≥50 ng/mL441.20±0.31肿瘤部位0.227>0.05 结肠331.13±0.21 直肠271.08±0.28肿瘤最大径0.327>0.05 <4 cm160.98±0.19 ≥4 cm440.78±0.18Ducks 分期-5.165<0.05 A+B期151.01±0.11 C+D期451.28±0.23
注:Dukes分期根据2010年国际抗癌联盟(UICC)和美国癌症联合会(AJCC)联合制订的改良分期标准进行分期
2.3 结直肠癌患者外周血中 IL-9+CD4+T细胞相关因子的表达 结果显示,结直肠癌患者外周血中PU.1、IL-9、CCL-2和CCL-5的mRNA表达水平显著高于健康对照组,差异有统计学意义(P<0.05)。见表3。
3 讨论
近年来,随着肿瘤特异性抗原的发现,免疫疗法在肿瘤中的应用得到极大的推动。预计肿瘤免疫疗法有望成为手术治疗、放疗、化疗后的第4种治疗方式。抗肿瘤免疫的主要细胞包括Th1、Th2、CD8+细胞毒性T细胞、自然杀伤性细胞等,这些抗肿瘤细胞通过释放不同的细胞因子诱导肿瘤细胞凋亡,并抑制肿瘤细胞的生长[5]。最新研究发现,IL-9+CD4+T细胞是分泌细胞因子IL-9的新型辅助型T淋巴细胞[6]。IL-9起初被认为是Th2细胞的分泌因子,它能够提升肥大细胞及嗜酸性粒细胞分泌黏性产物的活性;然而,最近的研究发现IL-9来源于新型T淋巴细胞亚型IL-9+CD4+T细胞,该细胞可以特异性分泌IL-9,其生长过程依赖IL-4及TGF-β共同刺激[7]。

基因结直肠癌患者外周血(n=60)健康对照组外周血(n=20)t值P值IL-91.37±0.541.09±0.442.09580.0393PU.11.12±0.300.92±0.422.32450.0227CCL-201.12±0.751.14±0.750.10460.9170CCL-21.13±0.560.82±0.622.08730.0401CCL-272.11±1.232.18±1.220.22080.8258CCL-50.61±0.290.45±0.312.10060.0389
研究发现[8]IL-9+CD4+T细胞的含量在变态反应性鼻炎、特异性皮炎患者外周血中较健康对照增加,该细胞对该类疾病的发展具有重要的免疫调节作用。而在肿瘤免疫方面,IL-9+CD4+T表现出两面性,一方面能够抑制肿瘤,一方面能够促进肿瘤。研究表明[9]IL-9+CD4+T细胞通过上调P21及TRAL能够抑制黑色素瘤HTB-72细胞的生长,从而TNF-α及颗粒酶B起到促进炎症发展的作用能够被大多数血源性及组织源性人记忆型IL-9+CD4+T细胞表达[10]。最近的研究[11-12]表明天然型免疫调节T细胞分化成为IL-9+CD4+T细胞可以被糖皮质激素诱导型TNF受体相关蛋白(GITR)直接诱导,进而介导抗肿瘤免疫反应在机体的发生。另有研究显示,IL-9能够显著促进某些肿瘤的生长,尤其是淋巴瘤[13],不同肿瘤中 IL-9+CD4+T细胞的肿瘤免疫特征不同,肿瘤中IL-9R的表达量可能与此有关[6]。
我们研究还发现,直肠癌患者外周血中IL-9+CD4+T细胞比例明显高于健康对照组,两者结果进行比较,差异有统计学意义(P<0.05)。结直肠癌淋巴结转移为阴性(Ducks C+D期)患者的外周血中IL-9+CD4+T细胞比例明显低于结直肠癌淋巴结转移为阳性的患者(Ducks A+B期),该结果提示IL-9+CD4+T细胞参与了结直肠癌的发生、发展与转移过程,表现出一定的促瘤效应。
PU.1[14]主要由Sfpil基因编码,不仅参与幼稚淋巴细胞的发育、增殖和分化,而且还在机体的适应性免疫反应中发挥着至关重要的作用。Chang等[15]研究发现,通过敲除小鼠T细胞中的Sfpi1基因,则能够显著减少Th9细胞分泌IL-9;如果在Th9细胞中PU.1的表达上调,则该结果可以逆转,表明PU.1是促进Th9细胞分泌IL-9的重要转录因子。本研究qRT-PCR结果显示,结直肠癌患者外周血中IL-9+CD4+T细胞的细胞因子IL-9相对表达水平和关键转录因子PU.1明显高于健康对照组,进一步证实,结直肠癌的发展与IL-9+CD4+T细胞密切相关。IL-9+CD4+T细胞的表型特征[16]为PD-1+CD45RO+CCR2+CCR5+,趋化因子CCL-2、CCL-5分别为其相应配体。结果提示结直肠癌患者外周血CCL-5 mRNA表达明显高于正常对照组,差异有统计学意义,但CCL-2的表达相反。该结果提示结直肠癌患者外周血中IL-9+CD4+T细胞的异常表达,可能与此有关,CCL-5和CCR5分泌的IL-9+CD4+T细胞在肿瘤微环境中分泌的趋化性。
本研究采用流式细胞仪检测结直肠癌患者的外周血中IL-9+CD4+T细胞的表达,同时采用荧光RT-PCR方法检测其主要分泌因子IL-9、关键转录因子PU.1以及趋化因子CCL-2、CCL-5的表达情况。结果表明, IL-9+CD4+T细胞及其相关因子在结直肠癌患者外周血中的高度表达,与肿瘤的Dukes分期密切相关;通过研究IL-9+CD4+T细胞在结直肠癌发生发展中的作用机制,它将为通过免疫疗法治疗结直肠癌疾病提供新的思路或靶点。

