新型冠状病毒肺炎患者合并心脏和肝脏损害的临床分析*
李翠芝, 李美瑜, 甘露, 张影, 雷春亮
广州市第八人民医院 1心血管内科, 2超声科, 3外科, 4肝病科(广东广州 510440)
2019年12月湖北省武汉市发现一种传染性极高的新型冠状病毒感染的肺炎[1]。2020年2月7日国家卫生健康委员会将新型冠状病毒感染的肺炎命名为新型冠状病毒肺炎[2]。2020年2月11日世界卫生组织(WHO)将这种“新型冠状病毒感染的肺炎”命名为COVID-19(coronavirus disease 2019)[3]。 为了给临床诊治工作提供依据,本研究拟总结在广州市第八人民医院确诊治疗的82例COVID-19患者临床特征,重点对有关COVID-19合并心脏、肝脏损害的问题进行探讨,现报告如下。
1 资料与方法
1.1 一般资料 选取2020年1月24日至2月25日广州市第八人民医院收治的82例COVID-19确诊患者,年龄18~84岁,平均(44.8±15.6)岁。男48例(58.5%),女34例(41.4%)。
1.2 诊断标准 参照国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》诊断标准[4]:(1)流行病学史:发病前14 d内有武汉市及周边地区,或其他有病例报告社区的旅行史或居住史;发病前14 d内与新型冠状病毒感染者(核酸检测阳性者)有接触史;发病前14 d内接触过来自武汉市及周边地区、或来自有病例报告社区的发热或有呼吸道症状的患者;聚集性发病。(2)临床表现:发热和(或)呼吸道症状;具有COVID-19影像学特征;发病早期白细胞总数正常或降低,淋巴细胞计数减少。(3)疑似病例诊断:具有任何一项流行病学史并且符合以上临床表现任意2条;或无明确流行病学史但符合临床表现的3条。(4)确诊病例诊断:符合疑似病例诊断条件,同时痰液、咽拭子或下呼吸道分泌物等标本行实时荧光RT-PCR检测新型冠状病毒核酸阳性。
同时根据该方案进行临床分型:(1)普通型:具有发热、呼吸道等症状,影像学可见肺炎表现;(2)重型:符合下列条件之一:呼吸窘迫,呼吸频次≥30次/min;静息状态下,指氧饱和度≤93%;氧合指数≤300 mmHg;(3)危重型:符合以下情况之一:出现呼吸衰竭,并且需要机械通气;出现休克;合并其他器官功能衰竭需ICU监护治疗。
1.3 研究方法 通过病历系统收集并获得相关数据,一般资料主要包括性别、年龄、既往病史等。临床资料主要包括症状、体征、实验室检查结果等。实验室检查包括以下项目:血常规(白细胞、中性粒细胞绝对值、中性粒细胞比值、淋巴细胞绝对值、淋巴细胞比值)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、肌钙蛋白I(cTnI)、乳酸脱氢酶(LDH)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白(Alb)、总胆红素(TBIL)、直接胆红素(DBIL)。
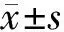
2 结果
2.1 基线资料 82例中普通型58例,重型和危重型24例,两组患者性别比较差异无统计学意义(P>0.05),年龄比较差异有统计学意义(P<0.05);重型和危重型患者既往合并高血压、糖尿病、脑血管病、慢性阻塞性肺疾病(COPD)的比例均高于普通型组,差异有统计学意义(均P<0.05)。见表1。
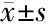
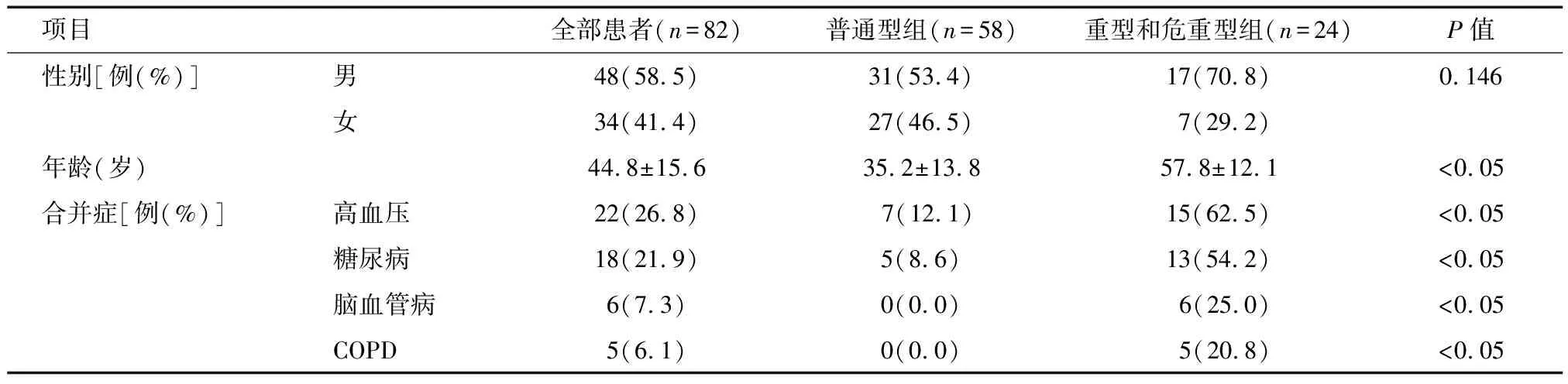
项目全部患者(n=82)普通型组(n=58)重型和危重型组(n=24)P值性别[例(%)]男48(58.5)31(53.4)17(70.8)0.146女34(41.4)27(46.5)7(29.2)年龄(岁)44.8±15.6 35.2±13.857.8±12.1 <0.05合并症[例(%)]高血压22(26.8)7(12.1)15(62.5)<0.05糖尿病18(21.9)5(8.6)13(54.2)<0.05脑血管病6(7.3)0(0.0)6(25.0)<0.05COPD5(6.1)0(0.0)5(20.8)<0.05
2.2 心脏和肝脏损害相关临床表现 本研究纳入病例出现心脏损害(主要表现为心悸、气促)20例(24.3%),肝脏损害(主要表现为乏力、纳差等)38例(46.3%)。心脏损害中2例患者既往有心功能不全病史,同时合并高血压,出现胸闷和呼吸困难后给予抗心力衰竭治疗后症状好转。重型和危重型患者组患者心悸、气促、乏力、纳差症状比例均高于普通型组患者(均P<0.05);两组患者出现胸闷症状的比例差异无统计学意义(P=0.083)。见表2。

表2 COVID-19患者心脏和肝脏损害相关临床表现 例(%)
2.3 心电图表现 住院期间仅有9例患者行心电图检查, 表现为窦性心动过速者2例,表现为房性早搏者1例,1例出现ST-T变化(主要是T波低平),余正常。
2.4 患者入院时实验室检查 82例中有14例(17%)出现CK升高,12例(14.6)出现CK-MB升高,13例(15.8%)出现cTnI升高,26例(31.7%)出现LDH升高,生化指标检查中,分别有12例(14.6%)、10例(12.1%)、11例(13.4%)、16例(19.5%)患者出现ALT、AST、TBIL、DBIL升高,而36例(43.9%)患者出现Alb降低。
2.4.1 血常规 重型和危重型组患者中性粒细胞绝对值和中性粒细胞百分比均高于普通型组患者,两组间差异有统计学意义(P=0.004、P<0.05);而普通型患者组淋巴细胞绝对值和淋巴细胞百分比明显高于重型和危重型组患者(P=0.001、P<0.05),两组间白细胞计数差异无统计学意义(P=0.052)。见表3。
2.4.2 心肌酶和肌钙蛋白 重型和危重型组患者CK-MB、LDH及cTnI数值均高于普通型组患者,两组间差异有统计学意义(P=0.015、P<0.05、P=0.012),而两组的CK检测值差异无统计学意义(P=0.058)。见表3。
2.4.3 生化检测结果 重型和危重型组患者ALT、DBIL指标高于普通型组患者(P=0.019、0.026),而Alb则明显低于普通型组患者,两组间比较有统计学意义(P<0.05),两组间AST、TBIL指标比较,差异无统计学意义(P=0.069、0.163)。见表3。
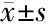

项目普通型组(n=58)重型和危重型组(n=24)P值血常规白细胞(×109·L-1)∗ 5.34(4.28,6.31)6.41(5.04,9.15)0.052中性粒细胞(×109·L-1)∗ 3(2.19,4.19)4.67(3.39,7.93)0.004中性粒细胞比例(%)60.9±13.2 75.5±13.7 <0.05淋巴细胞(×109·L-1) 1.52±0.64 0.97±0.480.001淋巴细胞比例(%)29.3±12.716.1±11.4 <0.05心肌酶谱CK(U/L)∗ 68(43.5,108)93(61.5,155.5)0.058CK-MB(U/L)∗ 10.7(8.05,13.35)18.7(7.57,25.1)0.015LDH(U/L)∗163(150.5,212)272(186.5,443.5)<0.05cTnI(μg/L∗) 0.002(0.001,0.006)0.005(0.002,0.037)0.012生化指标ALT(U/L)∗18.6(14.2,30.2)23(19,54.1)0.019AST(U/L)∗18.7(15.4,25.1)22.6(18.3,32.9)0.069TBIL(μmol/L)∗10.69(7.15,14.46)11.67(6.67,29.5)0.163DBIL(μmol/L)∗4.35(2.79,5.87)6.35(3.64,10.76)0.026Alb(g/L)40.1±5.033.6±5.0<0.05
注:*M(P25,P75)
2.5 预后 截至2月29日,危重症患者死亡1例, 直接死亡原因为多器官功能衰竭。48例患者康复出院,其余患者仍在接受治疗。
3 讨论
Harmer 等[5]运用Real-time PCR 定量 72 种人体组织 ACE2 的表达水平,结果显示 ACE2主要表达于肾脏、心血管、胃肠道系统,在肺脏、中枢神经系统及淋巴组织中表达相对较低。故除肺部损伤之外,新型冠状病毒表现出对人体肾脏及心脏更大的危害。Xu等[6]近期公布了1例COVID-19死亡患者的病理特征,结果示双侧弥漫性肺泡损伤,心脏组织中未见明显的组织学变化,心肌间质中有少量单核细胞炎症浸润,但没有其他心肌实质损害,提示新型冠状病毒感染可能不会直接损害心脏。
本研究中我们观察到重型和危重型患者合并心脏症状较普通型组患者明显,实验室检查中的心肌指标CK-MB、LDH及cTnI在重型和危重型患者中较普通型组患者明显升高。通过对纳入病例的临床观察,我们发现COVID-19患者虽然有心肌酶和肝酶的升高, 但其临床相关症状一般较轻。2例出现胸闷和呼吸困难的患者,是由于既往合并心功能不全,严重缺氧诱发急性心力衰竭所致,给予抗心力衰竭等治疗后好转。本研究患者除1例死亡外,其他患者经过积极治疗原发病、适当对症、保肝、降酶、营养心肌等治疗,大部分COVID-19患者心肌酶及肝酶下降或恢复正常,临床症状亦消失。
目前关于新型冠状病毒感染相关的急性心肌损害的发病机制尚不明确,笔者推测可能有以下几种机制。第一, 如前所述, 新型冠状病毒可通过ACE2 受体感染细胞,而 ACE2 受体广泛表达于心血管系统,因此与 ACE2 相关的信号通路可能也在心脏损伤中发挥了作用[7]。第二,Huang等[8]的研究指出,COVID-19患者体内可能存在Th1与Th2反应的失衡,而由此引发的细胞因子风暴也可能是心肌损伤机制之一。第三,由于COVID-19患者症状主要为发热,心肌缺氧或耗氧量的增加,也可诱发对心肌的损害。因此,目前临床上对于COVID-19引起的心肌酶或心电图的异常,我们暂称之为心脏损害,能否推测为心肌炎有待进一步研究探讨。
从本研究中我们也可得出重型和危重型患者合并肝脏损害症状较普通型组患者明显,生化检查中,反映肝脏损害的指标ALT、DBIL在重型和危重型组患者中均高于普通型组患者,而重型和危重型组患者的Alb水平明显低于普通型组。差异有统计学意义。Xu等[6]近期公布的死亡COVID-19患者的病理结果示中肝活检标本显示中度的微血管脂肪样变性以及轻度的肝小叶汇管区活动性炎症,提示该损伤可能由新型冠状病毒感染或者药物性肝损伤引起的。 结合本研究,笔者推测COVID-19患者的肝损害发病机制存在几种可能:第一,新型冠状病毒感染后激活人体免疫细胞,从而造成免疫细胞的过度聚集和促炎细胞因子大量释放,由此引发的细胞因子风暴是COVID-19感染患者发生肝损伤的重要原因之一[8]。第二,有研究报道呼吸窘迫综合征时缺氧可引发氧化应激反应,同时促使活性氧不断增加,进一步启动多种促炎因子的释放而诱导肝损伤,故呼吸窘迫综合征导致的低氧内环境也是COVID-19患者继发性肝损害因素之一。第三,Chai等[9]发现新型冠状病毒的受体ACE2在肝细胞中低表达(2.6%),在胆管细胞中高表达,推测在COVID-19患者中,胆管细胞损伤可能导致肝损伤。第四,在COVID-19患者中,药物性肝损伤可能也是肝功能异常的重要原因之一。
总而言之,本研究发现部分COVID-19患者特别是重型和危重型患者可合并心脏和肝脏损害,建议临床医师应根据临床症状、体征及实验室检查结果及时作出判断并调整治疗方案。因目前收集病例数有限,大部分患者仍在住院治疗,需进一步扩大样本量,综合考虑多因素的影响,为临床工作提供更多帮助。

