琴叶榕研究进展
陈 畅,胡显镜,宋丽艳,戴卫波,于荣敏*,彭伟文*
(1.广州中医药大学附属中山中医院,广东 中山 528400;2.暨南大学中药生物技术研究所,广东 广州510632)
琴叶榕(Ficus pandurataHance),桑科落叶小灌木,别名牛奶子树、铁石入牛、倒吊葫芦、水照影等[1-3]。主要分布于广东、海南、广西、福建等省,高1~2米,生于山地、旷野或灌木丛林下[1]。以根、叶入药,鲜用或晒干。根全年可采,但以秋季为佳;叶夏秋季采集[4]。中医认为琴叶榕味甘,微辛,性平,具有祛风除湿、解毒消肿、活血通经之效;主治风湿痹痛、黄疸、疟疾、乳汁不通、乳痈、闭经、跌打损伤、毒蛇咬伤等症[4]。在广东江门一带,民间常用来煲汤,作为日常保健。
琴叶榕除正品琴叶榕外,还有全缘琴叶榕(Ficus pandurataHance var.holophyllaMigo)和条叶榕(Ficuspandurata Hance var.angustifoliaCheng)两个变种[1],三者形态上的主要区别表现为叶形过渡,其他差异近无,但其化学成分及药效差异尚待考证[5]。埃及艾斯尤特大学主持研究的埃及产琴叶榕,其植物形态与上述3种中国产的琴叶榕有显著差异[6]。条叶榕及全缘琴叶榕的干燥根及茎为畲药小香勾的原植物来源,为畲族习用药材。正品琴叶榕与畲药小香勾的用法、疗效、对症高度相似,故小香勾的相关报道对于正品琴叶榕的研究具有较高的参考价值。
1 提取方法
琴叶榕的提取方法主要包括乙酸乙酯超声提取、乙醇超声提取、甲醇渗漉提取等。张小平等[7]用乙酸乙酯对条叶榕根茎粉末进行超声提取(料液比1:10,超声功率100 W,温度:30 ℃,时间:45 min),连续3次,提取液合并离心,取上清,真空冷冻干燥成浸膏,甲醇定容。李青松等[8]分别采用碱提取法、石油醚抽提法和乙醇浸提法提取琴叶榕根中的黄酮类成分,结果发现乙醇浸提法提取率最高。陈学智等[9]利用中心组合设计对小香勾总黄酮超声提取工艺进行优化,最终确定各因素对总黄酮得率影响的由大到小的顺序为:乙醇浓度>超声时间>料液比,最佳工艺条件为超声时间40 min,乙醇浓度65 %,液料比46:1。埃及艾斯尤特大学开展的琴叶榕研究均使用甲醇渗漉提取[10-13]。
2 化学成分的分离鉴定
埃及艾斯尤特大学将埃及产琴叶榕的甲醇提取浓缩物加蒸馏水溶解,用正己烷、氯仿、乙酸乙酯萃取,将各级萃取液浓缩,再采用硅胶柱色谱对琴叶榕的各级萃取液进行分离。采用液相色谱和硅胶柱层析进行最终纯化[10-13],并通过质谱、核磁共振氢谱、核磁共振碳谱等分析化合物结构。对于苷类成分的分析,需经部分酸水解及完全酸水解得到苷元。张小平等[7]则利用高效液相色谱-四极杆飞行时间质谱(HPLC-Q-TOF-MS)直接对条叶榕根茎乙酸乙酯提取物进行分离和鉴定。
据报道,已发现琴叶榕中的新化合物包括:1β-羟基-3β-乙酰氧基-11α-甲氧基-12-熊果烯、21α-羟基-3β-乙酰氧基-11α-甲氧基-12-熊果烯[14]及琴叶榕酰胺A~D(panduramide A~D)[13]。此外,琴叶榕中一些化合物是首次从榕属植物中分离得到的,包括3-O-α-L-阿拉伯吡喃糖基-4-羟基苯甲酸、3β-羟基-12, 20-焦油基二烯-22-酮、2β-羟基-3β-乙酰氧基-β-香树脂醇、2α, 3α-二羟基-桦木酸甲酯等[10-12]。
2.1 三萜类
据报道,琴叶榕化学成分中五环三萜类化合物共20个[5]:从琴叶榕果实的正己烷萃取部分分离得到6个三萜类化合物,包括3β-乙酰氧基-20-蒲公英醇-22-酮、α-香树脂醇、β-香树脂醇、3β-羟基-12, 20-焦油基二烯-22-酮、2β-羟基-3β-乙酰氧基-β-香树脂醇、3, 22β-二羟基-13(18)-齐墩果烯[13]。在琴叶榕茎皮的正己烷萃取部位分离得到α-香树脂醇乙酸乙酯、β-香树脂酮;氯仿萃取部位分离得到2α, 3β-二羟基白桦脂酸酯、熊果酸;乙酸乙酯萃取部位分离得到白桦脂酸[10]。在琴叶榕全株乙酸乙酯萃取部位中发现了3β-乙酰氧基-11α-甲氧基-12-齐墩果烯、3β-乙酰氧基-11α-甲氧基-12-熊果烯、11-氧代-α-香树脂醇乙酸酯、11-氧代-β-香树脂醇乙酸酯、1β-羟基-3β-乙酰氧基-11α-甲氧基-12-熊果烯、3β, 21β-二羟基-11α-甲氧基-12-齐墩果烯、21α-羟基-3β-乙酰氧基-11α-甲氧基-12-熊果烯、3β羟基-llα-甲氧基-12-熊果烯、11α, 21α-二羟基-3β-乙酰氧基-12-熊果烯等[13]。
2.2 黄酮类
现已在琴叶榕中分离到了系列黄酮化合物,如在叶中得到了槲皮素、槲皮素-3-O-葡糖苷、山奈酚3-O-β-新橙皮糖苷和芦丁等[10];在条叶榕的地上部位鉴定出木犀草素[14];利用HPLC-Q-TOF-MS从条叶榕中分离鉴定出槲皮素-O-己糖苷、圣草酚、柚皮素、芹黄素-O-己糖苷、芹黄素、6-C-异戊烯基芹黄素、8-C-异戊烯基芹黄素、异戊烯基芹黄素、异戊烯基木犀草素、大黄素[7]等。
2.3 香豆素类
研究者用高效液相色谱-三重四级杆-离子阱串联质谱(HPLC-ESI-MS)在条叶榕中鉴定出补骨脂素、7-羟基香豆素、佛手柑内酯[14]。张小平等[7]从条叶榕中分离得到6-甲氧基-7-羟基-8-异戊烯基香豆素、欧芹酚、别欧前胡素、对香豆酸等。
2.4 酚酸类
人们从条叶榕的醇提液中发现的酚酸类化合物包括[8,14]:绿原酸、儿茶素、原儿茶醛、七叶亭、表儿茶素、香草酸、咖啡酸、原儿茶酸乙酯、对羟基苯甲酸等。琴叶榕乙酸乙酯萃取物中分离得到另外2个酚酸类化合物,经鉴定为原儿茶酸和3-O-α-L-阿拉伯吡喃糖基-4-羟基苯甲酸[10]。
2.5 植物甾醇类
研究者从琴叶榕乙酸乙酯萃取部位分离得到9个植物甾醇类化合物,分别鉴定为β-谷甾醇、豆甾醇、β-谷甾醇-3-O-β-葡糖苷、3, 6-二酮-4, 5-22-豆甾二烯、4-烯-3, 6-豆甾二酮、22-烯-3, 6-豆甾二酮、3, 6-豆甾二酮、6-羟基-4, 22-二烯-3-豆甾酮、6-羟基-4-烯-3-豆甾酮[10-11,14]。
2.6 神经酰胺类
Khedr等[13]从琴叶榕果实的甲醇萃取部分中成功分离得到5种酰胺类成分(1~5),其中神经酰胺1,2,3,5为新化合物,被命名为琴叶榕酰胺A~D(panduramide A~D)。其化学结构见图1。
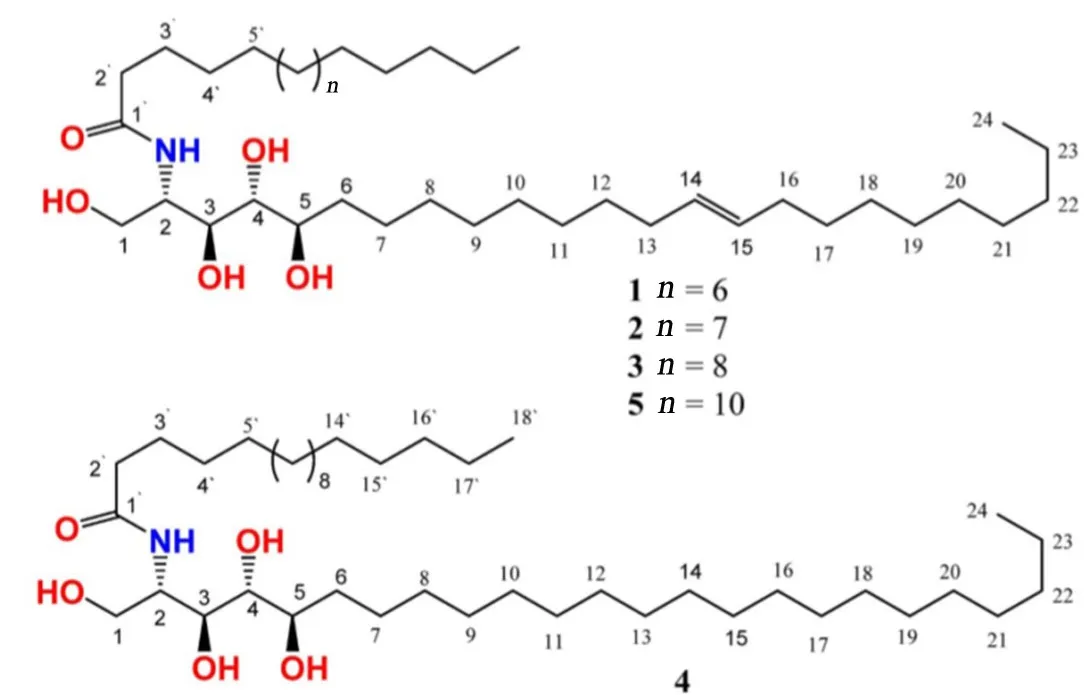
图1 琴叶榕酰胺A~D化学结构
2.7 其他类
研究人员还从琴叶榕乙酸乙酯萃取部分分离得到棕榈酸[12]和蜡醇[11];从条叶榕中分离出三羟基二苯乙烯己糖苷、四羟基二苯乙烯己糖苷、壬二酸、三羟基十八碳二烯酸、9, 12, 13-三羟基-10-十八碳烯酸,9, 10, 11-三羟基-12-十八碳烯酸等[7]。
3 药理作用
3.1 抗氧化作用
研究发现:条叶榕醇提物能显著清除1, 1-二苯基-2-苦肼基(DPPH)自由基和羟基自由基[14];小鼠体内实验结果显示,条叶榕汤剂治疗组的小鼠血清中氧化低密度脂蛋白显著降低,表明条叶榕具有体内抗氧化作用[15];琴叶榕根的水提液也能降低Wistar大鼠血清中丙二醛(MDA)含量,提高血清中超氧化物歧化酶(SOD)活性,表明其具有一定的抗自由基能力[16]。
琴叶榕中的活性成分均表现出不同程度的抗氧化活性,如槲皮素、木犀草素等黄酮类化合物,既能作为还原剂发生氧化反应,也能增强生物体抗氧化系统的活性[17];熊果酸能升高大鼠体内SOD、谷胱甘肽过氧化物酶(GSH-Px)的含量[18];豆甾醇[19]和β-谷甾醇[20]均对羟基自由基有明显的清除作用;绿原酸能减弱铝离子诱导的氧化损伤[21];原儿茶酸表现出强于维生素C的抗氧化活性[22]。
3.2 抗炎镇痛作用
研究发现:条叶榕醇提液抗炎能力强于水提液[14];琴叶榕的正己烷萃取部分及甲醇总提取物分别在200,400 mg/kg剂量下表现出良好的抗炎镇痛作用,并能持续作用5 h[23];琴叶榕中的化合物3β-乙酰氧基-11α-甲氧基-12-齐墩果烯,1β-羟基-3β-乙酰氧基-11α-甲氧基-12-熊果烯和3, 6-豆甾二酮均显示出对大麻素受体CB2良好的亲和力,置换效率达69.7 %,62.5 %和86.5 %[12];而在琴叶榕中发现的琴叶榕酰胺A对大麻素受体CB1也表现出良好的亲和力,置换效率达69.9 %[13]。这些化合物可能是琴叶榕抗炎镇痛作用的药学物质基础之一。
在脂多糖(LPS)诱导的炎症小鼠模型中,白桦脂酸(BA)能显著增加小鼠血清中白介素(IL)-10水平,对IL-6无影响,能减少肿瘤坏死因子(TNF-α)的产生,并抑制吞噬细胞产生促炎介质[24];熊果酸可明显降低肝纤维化模型小鼠的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶2(NADPH oxidase 2,NOX2)、核苷酸结合寡聚化结构域样受体家族吡啉结构域蛋白3(NOD-like receptor family pyrin domain containing 3,NLRP3)炎性小体、胱天蛋白酶1(caspase-1)p10亚基及IL-1β等蛋白质的表达[25];豆甾醇和β-谷甾醇均能治疗急性结肠炎[26];木犀草素及槲皮素[27]均可显著抑制LPS诱导RAW264.7细胞后多种炎症因子的升高。
3.3 抗肿瘤作用
研究表明:白桦脂酸具有广谱抗肿瘤作用,以白桦脂酸为原型合成的多种衍生物也表现出良好的抗肿瘤活性,如白桦脂酸能诱导乳腺癌细胞凋亡[28],能增强人自然杀伤细胞(NK细胞)对SW1990胰腺癌细胞的杀伤作用[29];熊果酸能诱导人肺癌PC9细胞的自噬[30];槲皮素能明显抑制宫颈癌SiHa细胞增殖和侵袭、迁移[31];β-谷甾醇能抑制H22荷瘤小鼠的肿瘤生长[32];木犀草素能降低肝癌HepG2细胞内抑癌基因阿片肽结合蛋白基因(OPCML)的甲基化失活,从而抑制HepG2细胞增殖[33];β-谷甾醇和豆甾醇均能诱导细胞凋亡,抑制B16F10黑色素瘤细胞的生长[34];绿原酸可干扰人乳腺癌MCF-7细胞周期,将癌细胞的生长周期阻滞在G1期[35]。
3.4 保肝作用
琴叶榕中多种活性成分具有保肝护肝作用。研究表明:白桦脂酸可通过核因子E2相关因子2/血红素加氧酶1/核因子-κB受体活化因子(Nrf2/HO1/NF-κB)信号通路改善CCl4诱导的小鼠肝损伤[36],对非酒精性脂肪肝的改善和酒精性肝损伤的预防均有一定作用[37-38],80 mg/(kg·d)白桦脂酸具有显著的抗肝纤维化作用[39];槲皮素可激活核因子E2相关因子2/抗氧化反应元件(Nrf2-ARE)信号通路,发挥对免疫性肝损伤的保护作用[40];豆甾醇和β-谷甾醇均可显著降低脂肪肝细胞甘油三酯(TG)含量及脂质过氧化物MDA水平,提高抗氧化剂GSH含量,以改善肝细胞脂肪变性程度,减轻氧化应激反应,达到改善非酒精性脂肪肝的效果[41];绿原酸具有抑制肝纤维化、改善大鼠脂肪肝的作用[42-43];熊果酸对化学性肝损伤、肝纤维化、药物性肝损伤、酒精性肝损伤等多种实验性肝损伤均具有一定的保护作用[25,43-44]。
3.5 对前列腺的治疗作用
琴叶榕根提取液对家兔的细菌性前列腺炎具有显著疗效[45];姚良权等[46]研究表明补骨脂素可通过降低前列腺细胞增殖,抑制前列腺细胞雌激素受体(ER)和雄激素受体(AR)的表达,对大鼠前列腺增生起治疗作用;Shin等[47]研究表明熊果酸可对抗皮下注射睾酮引起的大鼠良性前列腺增生,抑制血清和前列腺中睾酮和二氢睾酮水平升高;熊果酸对角叉菜胶诱导慢性非细菌性前列腺炎具有较好的治疗作用[48]。
3.6 预防动脉粥样化(AS)
研究表明:小香勾汤剂通过减轻微小RNA(miR)-203对内皮细胞E26转录因子2(Ets-2)的抑制,减轻内源性血管紧张素II对载脂蛋白E基因敲除(ApoE -/-)小鼠动脉粥样硬化斑块形成的促进作用,且作用呈剂量依赖性[15];高脂血症是AS的致病因素之一,据报道,熊果酸[49]和木犀草素[50]均有调节血脂、降胆固醇的功效,故对AS具有一定的预防作用。
3.7 预防阿尔茨海默病(AD)
β淀粉样蛋白(Aβ)是引起AD的内源性致病因子,以Aβ诱导的AD小鼠为研究模型,发现熊果酸能显著抑制AD小鼠海马体中的IL-1β、IL-6和TNF-α水平的上调[51];木犀草素是β-分泌酶(BACE1)转录的有效抑制剂,抑制Aβ的产生[52];白桦脂酸预处理可减轻阿尔茨海默病模型大鼠的海马体长时程增强效应(LTP)缺陷,减轻大鼠海马神经元损伤[53];豆甾醇、β-谷甾醇均具有改善认知的作用[54],可用于预防AD。
3.8 其他
其他药理活性包括:补骨脂素抑制破骨细胞的形成和溶骨活性[55];β-谷甾醇提高脂肪细胞对葡萄糖的吸收[56];木犀草素抑制骨髓单核细胞和Raw264.7细胞分化为破骨细胞,抑制破骨细胞的骨吸收活性[57];白桦脂酸抑制HIV-1型病毒株(X4-HIV-1和R5-HIV-1)的活性[58];木犀草素抑制HIV-1整合酶的活性[59]等。
4 结论与展望
琴叶榕作为一味药食同源药材,其种属分布较为复杂,目前的研究主要包括对国内产的正品琴叶榕、畲药小香勾及埃及产琴叶榕的研究,而三者间的化学成分及药理活性差别暂不明确。关于正品琴叶榕,目前只有相关化学成分的初步鉴定,而无系统研究[60]。鉴定结果认为,琴叶榕根和叶中均含酚类、蒽醌类、强心苷类,根可能含生物碱,叶中不含生物碱;叶含黄酮,根可能含黄酮。综合埃及产琴叶榕与国内小香勾的化学成分研究发现,三萜类、黄酮类、香豆素类、酚酸类、甾醇类及最新发现的神经酰胺类等是琴叶榕主要成分,但各成分的含量暂不明确。诸多中医药典籍均记载琴叶榕具祛风除湿、解毒消肿、活血通经之效,可治多种疾病。现代研究表明琴叶榕具有抗氧化、抗炎镇痛、抗肿瘤、保肝等药理活性。但目前对琴叶榕尤其是正品琴叶榕的研究尚不完善,如药材鉴定标准、药效物质基础、药效作用机制等,均需系统深入的研究。鉴于琴叶榕的良好药理活性,利用琴叶榕研究与开发相关产品将具有广泛的前景。

