人参皂苷抗心肌缺血中医病机及作用机制的研究进展
俞婷 高崎 朱国琴
摘 要 人参皂苷是人参的主要活性成分,其在治疗心血管疾病方面有显著的药理作用。本文对人参皂苷的分类转化,近十年来抗心肌缺血的中医病机、药理作用及其作用机制进行综述,从抗氧化损伤和对离子通道、信号通路、血管内皮生长因子以及炎症因子的调节五个方面着重介绍人参皂苷治疗心肌缺血性疾病的作用机制,为进一步深入研究新药开发以及临床防治心血管疾病提供科学依据。
关键词 人参皂苷 心肌缺血 中医病机 Ca2+通道 信号通路
中图分类号:R285.5 文献标志码:A 文章编号:1006-1533(2020)09-0041-06
Research progress of ginsenoside on the pathogenesis and action mechanism of TCM in myocardial ischemia
YU Ting1*, GAO Qi1,2, ZHU Guoqin2**
(1. Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China; 2. SPH Xingling Sci &Tech Pharmaceutical Co., Ltd., Shanghai 201703, China)
ABSTRACT Ginsenosides are the main active ingredients of ginseng and has some significant pharmacological effects in the treatment of cardiovascular diseases. The TCM pathogenesis, pharmacological action and action mechanism of ginsenosides against myocardial ischemia in the past decade are reviewed and their mechanisms in the treatment of myocardial ischemic disease are also introduced from the aspects of antioxidant damage, regulation of ion channels, signaling pathways, vascular endothelial growth factor and inflammatory factors so as to provide scientific basis for further research on new drug development and clinical prevention and treatment of cardiovascular diseases.
KEy WORDS ginsenoside; myocardial ischemia; TCM pathogenesis; calcium channel; signaling pathway
人参(Panax ginseng C.A. Meyer)属五加科人参属植物,享有“百草之王”的美誉,药典中记载人参具有大补元气、复脉固脱、补脾益肺、生津养血、安神益智之功效,在现存的各类中医药书籍如《神农本草经》[1]、《伤寒杂病论》中也都有所记载[2]。古往今来,人参常被用以治疗病危脉绝的重症患者,如四君子汤、生脉散等方剂中均以人参作为君药治疗元气虚损等症,现代制剂中参麦注射液、参松养心胶囊等运用于临床治疗心血管
疾病[3]。
1 人参皂苷的分类及转化
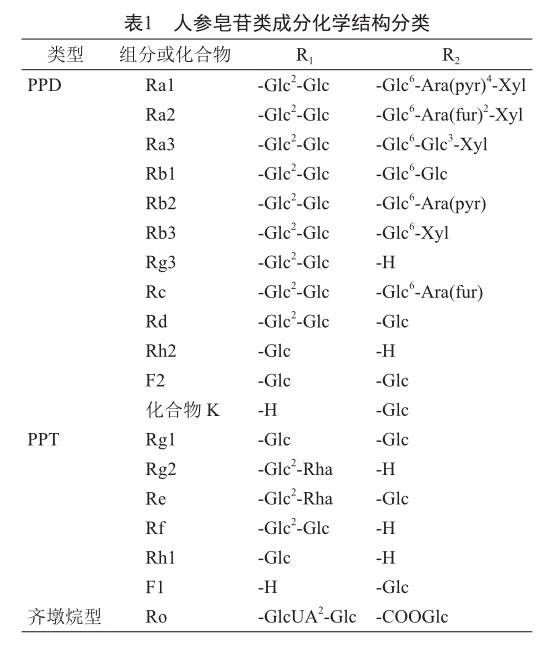
人参含有具生物活性的人参皂苷、多糖、黄酮类和酚类等化合物,其中人参皂苷是人参的主要药理活性成分[4]。根据其化学结构,人参皂苷一般分为四环达玛烷型和五环齐墩烷型。达玛烷型又包括原人参二醇(PPD)和原人参三醇(PPT)(图1),PPD糖基连接在C-3和(或)C-20的 OH上,包括人参皂苷Ra1、Ra2、Ra3、Rb1、Rb2、Rb3、Rc、Rd、Rg3、Rh2、F2和化合物K等;PPT糖基连接在C-6和/或C-20的 OH上,包括人参皂苷Re、Rf、Rg1、Rg2、Rh1和F1等。齐墩烷型由一个五环结构的配基齐墩果酸组成,仅含有人参皂苷Ro[5-7](表1)。
人参皂苷具有多种有益的药理作用[8-10],如抗癌、抗炎以及对心血管系统的保护作用等。从人参属植物中提取的少量皂苷不能满足科研和临床的需要,因此通过主要皂苷的转化来制备稀有皂苷具有重要意义,可利用细菌或真菌菌株以及β-糖苷酶水解C-3、C-6、C-20位糖苷键进行转化[11-12],具有较高的产率和较少的副产物。如人参皂苷Rb2占人参根总皂苷的2%~17%,人参皂苷Rg3只占0.000 3%,Quan等[13]将Rb2 C-20位上的糖基水解后可转化为人参皂苷20(S)-Rg3,并且研究表明去糖基后的某些稀有皂苷比主要皂苷具有更强的生物活性[14]。
2 心肌缺血的中医病因病机
心血管疾病(CVD)[15-16]是全球高发病率和高死亡率的主要疾病之一,世界卫生组织估计,到2030年死于心血管疾病的总人数将增加到2 360万。常见的心血管疾病包括急性心肌梗死、心肌缺血、动脉粥样硬化、高血压等,其中心肌细胞的急性缺血和肥大是由于动脉粥样硬化斑塊和血栓的形成而引起,心肌供血不足即心肌缺血后会直接损害心脏,导致心脏祖细胞死亡[17-18]。
中医在心肌缺血诊治方面有着悠久的历史和丰富的经验,中医认为心肌缺血属于中医学“胸痹”范畴,胸痹是指主证为胸部闷痛,甚则胸痛彻背、短气、喘息不得卧的一种疾病[19]。心肌缺血属本虚标实之证,本虚为心脾肝肾虚,心脉失养,标实为寒凝、气滞、血瘀、痰阻,痹遏胸阳,阻滞心脉[20],因此心肌缺血与心肝脾肾诸脏的盛衰有关。中医理论认为阴寒内盛、胸阳痹阻、阴占阳位、心脉凝泣不通为心肌缺血的主要病机,因此本病的基本治疗原则是辛温通阳、活血化瘀[21],多从扶正补虚出发,辅以活血、化痰、解毒散结,多层次、多途径修正阴阳失调的心肌细胞,符合“气血并调、阴生阳长”的配伍规律,使机体功能趋于阴阳平衡。如清代医家王清任提出的“血府逐瘀汤”[22]是中医治疗“胸痹”的经典中药方剂,是由清代桃红四物汤、四逆散等经典名方加以适量桔梗、牛膝等十一味药物组成,共奏解气化瘀、排浊化痰的功效,还能够通络止痛、养血润燥,并已被证实具有保护心肌细胞、改善心肌缺血的作用;最早记录在金·张元素《医学启源》中的传统古方生脉散[23],具有益气养阴生津之功,在临床上广泛用于治疗心肌病、冠心病、心绞痛等心血管疾病。研究表明近年来临床反馈的中医中药治疗心肌缺血准确有效,并已获得广大患者的接受与认可。

3 人参皂苷抗心肌缺血分子机制
3.1 抗氧化损伤
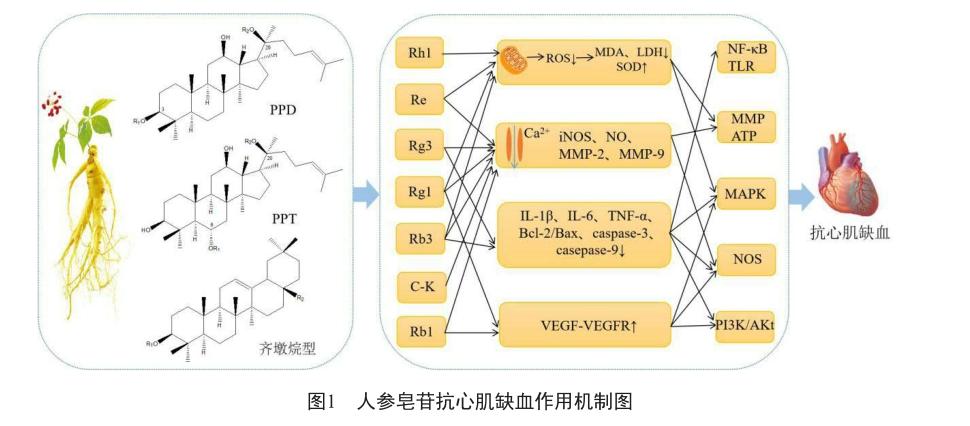
氧化应激是心肌缺血的主要病理因素之一,心肌缺血后,由于冠状动脉血流恢复引起的各种细胞代谢而产生的活性氧ROS会造成心肌损伤。高浓度的ROS释放,可抑制细胞增殖,增加心肌细胞凋亡,增大梗死面积,会造成慢性心力衰竭,提高死亡率[24]。心肌缺血还导致线粒体氧化磷酸化停止,线粒体功能障碍会引起细胞凋亡并产生ROS,两者共同作用加剧心肌损伤[25]。
在心肌缺血过程中,人参皂苷Re通过清除自由基保护心肌细胞不被氧化而增加心肌细胞的存活率[26]。Liu等[27]研究发现,人参皂苷Rb3可降低心肌梗死面积,显著降低左心室丙二醛MDA含量,提高超氧化物歧化酶SOD活性,降低肌酸激酶CK和乳酸脱氢酶LDH活性,从而减少ROS积累起到抗氧化应激作用。Dong等[28]研究表明人参皂苷Rg1通过降低Bcl-2/Bax比值,减少ROS生成和糖酵解来抑制线粒体功能障碍,从而减轻心肌缺血损伤。此外有研究证明人参皂苷Rb1、Rh1具有提高抗氧化酶活性,清除氧自由基从而对缺血心肌有保护作用[29]。因此,探索抗氧化应激药物是治疗缺血性疾病的一个契机。
3.2 对Ca2+通道的调节作用
血管内皮细胞含有多种离子通道,其中钙离子通道的钙超载是缺血损伤和收缩功能障碍的主要临床相关因素,钙超载是由Na+/Ca2+交换增加导致线粒体Ca2+积累引起的,它参与了心肌缺血损伤的发病机制,因此预测和控制钙水平有助于缺血性损伤的心肌保护[15]。
Zhou等[30]研究表明,人参皂苷Rd通过对不同线粒体蛋白激酶的调控来减弱Ca2+诱导的线粒体膜电位降低,且呈剂量依赖性。在心脏中,Ca2+对调节收缩和细胞内信号传导至关重要,心肌细胞膜上钙通道活性下降,大量钙离子沉淀于胞质及线粒体中导致钙超载,Rb1抑制缺血心肌细胞钙通道,降低心脏做功和耗氧量[31]。Li等[32]研究证明了Rb1可以抑制线粒体凋亡通路的激活,保护新生大鼠心肌细胞免受缺氧/缺血诱导的凋亡,还可通过抑制Ca2+-CaN信号传导途径减轻心肌肥厚,保护缺血心肌。血小板完全聚集是止血栓形成的必要条件,人参皂苷Rg3以剂量依赖的方式减弱血栓素诱导的血小板聚集和Ca2+水平的升高,因此,Rg3可通过降低细胞内Ca2+水平,预防血栓形成和其他血小板介导的心血管疾病[33]。
3.3 对多条信号通路的作用
3.3.1 对MAPK信号通路的作用
细胞内MAPK丝裂原活化蛋白激酶信号级联[34]在心血管疾病的发病机制中发挥重要作用,一般分为三个亚组,包括p42/p44细胞外信号相关激酶ERK1/2、p38 MAPK和c-Jun氨基末端蛋白激酶JNK。心肌缺血损伤后激活p38 MAPK,通过转录因子和蛋白磷酸化来增加粘附分子表达和粒细胞活化,最终导致心肌细胞收缩功能障碍,出现大面积坏死和凋亡。
Rb1的作用机制可能与p38 MAPK磷酸化有关,并阻止与凋亡相关基因的激活,因此,Rb1作为p38的抑制剂,在缺血性心脏病中具有治疗的潜力[35]。Rg1抑制p38 MAPK信号通路有效促进治疗性血管生成,减轻心肌纤维化,改善左心室功能[36];Zhang等[37]也证明了Rg1通过抑制p38 MAPK对主动脉缩窄TCA诱导的左心室肥厚和心功能障碍具有保护作用。MKK4是MAPK信号传导通路上的关键基因,人参皂苷Rh2和化合物C-K的处理抑制了肿瘤坏死因子TNF诱导的MKK4磷酸化,从而抑制JNK-AP1通路的激活,此外Rg1通过对JNK磷酸化的保护作用,抑制JNK信号级联,具有保护心脏功能障碍的作用[38]。因此,靶向抑制p38/JNK信号通路可减轻心肌缺血损伤,为防治心肌缺血性疾病提供了新的思路。
3.3.2 对PI3K/Akt信号通路的作用
磷脂酰肌醇3激酶/蛋白激酶B (PI3K/Akt)通路通过多种底物影响细胞存活[39],该通路是细胞增殖、细胞周期进展的重要调控因子,它能够激活Akt信号级联放大的因子,包括B细胞和T细胞受体、细胞因子受体、G蛋白偶联受体等。已有研究表明,PI3K/Akt通路调控的募集T细胞可以减轻小鼠心肌缺血再灌注损伤[40]。
NO是心肌缺血损伤的重要保护因子,人参总皂苷通过激活PI3K/Akt-eNOS信号通路,上调PI3K、p-Akt和p-eNOS蛋白水平,提高NO的产生,从而显著增加缺血再灌注大鼠心脏冠状动脉灌注流量[41]。体外研究表明,Rg3通过抑制caspase-3和caspase-9的活化,增加p-Akt、内皮型一氧化氮合酶eNOS的表达水平和Bcl-2/Bax的比值,介导心肌梗死/心肌缺血再灌注诱导的细胞凋亡[42]。Rb1预处理已被证明可以通过PI3K/Akt信号级联的机制减轻大鼠心肌缺血再灌注损伤,此外,Rb1、Rb2、Rd等被肠道菌群转化为主要代谢物化合物K(C-K),C-K通过介导PI3K通路的激活和Akt、eNOS的磷酸化,对心肌缺血再灌注损伤具有保护作用[43]。
3.4 對血管内皮生长因子VEGF的作用
血管生成是由原有血管形成新血管的过程,对血管的发育、繁殖和修复至关重要,血管生成过程中需要协调各种因素,包括VEGF组、血小板源生长因子PDGF、转化生长因子βTGF-β等[44]。大量的临床前实验证明,VEGF具有促进血管生成的作用,还可以激活多种下游通路,包括PI3K-Akt/mTOR C2通路、Raf-MEK-MAPK通路和Src-FAK通路,促进缺血心肌恢复[45]。
研究发现,VEGF能特异性地与其相应受体VEGFR结合并刺激血管内皮细胞增殖,促进侧支血管的形成,Rg1增加心肌组织VEGF、VEGFR、p-Akt以及NO的表达,因此Rg1通过VEGF-VEGFR-Akt-NO途径促进大鼠急性缺血心肌血管再生[46]。王永刚等[47]也发现了Rg1可上调VEGF mRNA的表达,促进大鼠缺血心肌冠状动脉侧支血管的生成,动员骨髓干细胞归巢于缺血心肌,有效促进微血管再生,促进缺血心脏功能恢复。此外,魏英等[48]研究证明Rg1和Rb1等都具有血管生长因子样作用,Rg1可上调大鼠心肌梗死区的VEGF基因表达,Rb1参与改善急性心肌梗死所致的左室重构,诱导血管新生,改善心肌血液供应,减轻缺血损伤。
3.5 对炎症因子的作用
引起心肌损伤的ROS激活Toll样受体TLR的磷酸化信号通路,促进炎症反应中NF-κB途径,NF-κB信号通路的激活又进一步触发炎性因子的产生,损害心肌功能[49]。因此减少再灌注过程中的炎症反应对恢复心肌缺血损伤是有益的。
心肌缺血损伤引发心肌细胞分泌TNF-α,进一步刺激释放促炎细胞因子浸润白细胞和内皮细胞,启动细胞因子级联反应。Rg3能显著减少缺血再灌注大鼠左心室心肌的TNF-α和IL-1β,通过抗炎作用改善心肌缺血再灌注诱导的心功能损害[50]。MA等[51]研究表明Rb3预处理可显著抑制单核细胞趋化蛋白1MCP-1、基质金属蛋白酶MMP-2、MMP-9以及IL-6和TNF-α mRNA水平,减弱心肌缺血再灌注损伤。Chen等[52]发现Re可抑制巨噬细胞上脂多糖LPS与TLR4的结合,改善诱导型一氧化氮合酶(iNOS)和eNOS之间的不平衡,防止NF-κB信号通路激活,减少炎症因子的生成,保护小鼠心肌功能障碍(图1)。
4 讨论
人参皂苷对心肌缺血性疾病有显著的治疗作用,抗心肌缺血的机制主要包括对氧化损伤、钙离子通道、多条信号通路、血管内皮生长因子以及炎症因子的影响。
目前人参皂苷在心肌缺血性疾病中的研究都采用建立细胞或动物模型进行分析探讨,利用大鼠等作为研究对象进行实验分析,而临床研究鲜有报道,对临床治疗作用于人体的机制尚不明确;并且研究都集中于人参皂苷Rb1、Rg1、Rg3和Re等成分,对于其他有效成分研究较少,例如有研究表明人参皂苷Rg2对心肌缺血也有一定治疗作用,但该类研究动物实验较少,因此具有进一步深入探讨的价值。此外可以利用网络药理学等新技术探索人参皂苷治疗心肌缺血性疾病可能的作用靶点与生物通路,为日后对人参的研究提供更多理论数据支持。
因此,对人参皂苷提高有效成分含量、进行体内转化以及临床运用还需进行深入研究,准确阐明其作用机制,探讨其临床不良反应等,以期进一步开发人参的新型活性制剂,为临床治疗心血管疾病提供候选药物。
参考文献
[1] Bai L, Gao J, Wei F, et al. Therapeutic potential of ginsenosides as an adjuvant treatment for diabetes[J]. Front Pharmacol, 2018, 9: 423.
[2] Sun Y, Liu Y, Chen K. Roles and mechanisms of ginsenoside in cardiovascular diseases: progress and perspectives[J]. Sci China Life Sci, 2016, 59(3): 292-298.
[3] 孫立伟, 李香艳, 赵大庆. 人参“大补元气”中医及生物学内涵研究[J]. 世界科学技术:中医药现代化, 2016, 18(11): 1969-1974.
[4] Kim JH. Pharmacological and medical applications of Panax ginseng and ginsenosides: a review for use in cardiovascular diseases[J]. J Ginseng Res, 2018, 42(3): 264-269.
[5] Rajabian A, Rameshrad M, Hosseinzadeh H. Therapeutic potential of Panax ginseng and its constituents, ginsenosides and gintonin, in neurological and neurodegenerative disorders: a patent review[J]. Expert Opin Ther Pat, 2019, 29(1): 55-72.
[6] Jung J, Lee NK, Paik HD. Bioconversion, health benefits, and application of ginseng and red ginseng in dairy products[J]. Food Sci Biotechnol, 2017, 26(5): 1155-1168.
[7] Mohanan P, Subramaniyam S, Mathiyalagan R, et al. Molecular signaling of ginsenosides Rb1, Rg1, and Rg3 and their mode of actions[J]. J Ginseng Res, 2018, 42(2): 123-132.
[8] Nakhjavani M, Hardingham JE, Palethorpe HM, et al. Ginsenoside Rg3: potential molecular targets and therapeutic indication in metastatic breast cancer[J]. Medicines (Basel), 2019, 6(1): 17.
[9] Ni XJ, Xu ZQ, Jin H, et al. Ginsenoside Rg1 protects human renal tubular epithelial cells from lipopolysaccharide-induced apoptosis and inflammation damage[J]. Braz J Med Biol Res, 2017, 51(2): e6611.
[10] Gan XT, Karmazyn M. Cardioprotection by Ginseng: experimental and clinical evidence and underlying mechanisms[J]. Can J Physiol Pharmacol, 2018, 96(9): 859-868.
[11] Yu S, Zhou X, Li F, et al. Microbial transformation of ginsenoside Rb1, Re and Rg1 and its contribution to the improved anti-inflammatory activity of ginseng[J]. Sci Rep, 2017, 7(1): 138.
[12] Zheng MM, Xu FX, Li YJ, et al. Study on transformation of ginsenosides in different methods[J/OL]. Biomed Res Int, 2017, 2017: 8601027. doi:10.1155/2017/8601027.
[13] Quan LH, Wang C, Jin Y, et al. Isolation and characterization of novel ginsenoside hydrolyzing glycosidase from Microbacterium esteraromaticum that transforms ginsenoside Rb2 to rare ginsenoside 20(S)-Rg3[J]. Antonie Van Leeuwenhoek, 2013, 104(1): 129-137.
[14] Kim MJ, Upadhyaya J, Yoon MS, et al. Highly regioselective biotransformation of ginsenoside Rb2 into compound Y and compound K by β-glycosidase purified from Armillaria mellea mycelia[J]. J Ginseng Res, 2018, 42(4): 504-511.
[15] Han X, Li M, Zhao Z, et al. Mechanisms underlying the cardio-protection of total ginsenosides against myocardial ischemia in rats in vivo and in vitro: possible involvement of L-type Ca2+ channels, contractility and Ca2+ homeostasis[J]. J Pharmacol Sci, 2019, 139(3): 240-248.
[16] Lee S, Lee MS, Kim CT, et al. Ginsenoside Rg3 reduces lipid accumulation with AMP-activated protein kinase (AMPK) activation in HepG2 cells[J]. Int J Mol Sci, 2012, 13(5): 5729-5739.
[17] Haybar H, Khodadi E, Shahrabi S, et al. Wnt/β-catenin in ischemic myocardium: interactions and signaling pathways as a therapeutic target[J]. Heart Fail Rev, 2019, 24(3): 411-419.
[18] Jiang L, Zeng H, Ni L, et al. HIF-1α preconditioning potentiates antioxidant activity in ischemic injury: the role of sequential administration of dihydrotanshinone I and protocatechuic aldehyde in cardioprotection[J]. Antioxid Redox Signal, 2019, 31(3): 227-242.
[19] 馬伟国. 中医胸痹的病因病机探讨[J]. 云南中医中药杂志, 2012, 33(6): 16-17.
[20] 刘文全. 浅析中医对心肌缺血的辩证疗法[J/OL]. 中西医结合心血管病电子杂志, 2016, 4(35): 13.
[21] 吴金桂, 莫雪妮, 李伟茜, 等. 四逆汤对心肌缺血保护作用机制探析[J]. 亚太传统医药, 2018, 14(10): 88-91.
[22] 许晓梅. 血府逐瘀汤治疗冠心病心肌缺血患者的临床观察[J]. 中国中医药现代远程教育, 2017, 15(16): 98-100.
[23] 崔洁, 于远望. 生脉散防治心血管疾病的研究进展[J]. 现代中医药, 2018, 38(3): 78-81.
[24] Kim JH. Cardiovascular diseases and panax ginseng: a review on molecular mechanisms and medical applications[J]. J Ginseng Res, 2012, 36(1): 16-26.
[25] Li L, Pan CS, Yan L, et al. Ginsenoside Rg1 ameliorates rat myocardial ischemia-reperfusion injury by modulating energy metabolism pathways[J]. Front Physiol, 2018, 9: 78.
[26] Lim KH, Lim DJ, Kim JH. Ginsenoside-Re ameliorates ischemia and reperfusion injury in the heart: a hemodynamics approach[J]. J Ginseng Res, 2013, 37(3): 283-292.
[27] Liu X, Jiang Y, Yu X, et al. Ginsenoside-Rb3 protects the myocardium from ischemia-reperfusion injury via the inhibition of apoptosis in rats[J]. Exp Ther Med, 2014, 8(6): 1751-1756.
[28] Dong G, Chen T, Ren X, et al. Rg1 prevents myocardial hypoxia/reoxygenation injury by regulating mitochondrial dynamics imbalance via modulation of glutamate dehydrogenase and mitofusin 2[J]. Mitochondrion, 2016, 26: 7-18.
[29] Gai Y, Ma Z, Yu X, et al. Effect of ginsenoside Rh1 on myocardial injury and heart function in isoproterenol-induced cardiotoxicity in rats[J]. Toxicol Mech Methods, 2012, 22(8): 584-591.
[30] Zhou JS, Wang JF, He BR, et al. Ginsenoside Rd attenuates mitochondrial permeability transition and cytochrome C release in isolated spinal cord mitochondria: involvement of kinase-mediated pathways[J]. Int J Mol Sci, 2014, 15(6): 9859-9877.
[31] Kwan CY, Kwan TK. Effects of Panax notoginseng saponins on vascular endothelial cells in vitro[J]. Acta Pharmacol Sin, 2000, 21(12): 1101-1105.
[32] Li YH, Li YY, Fan GW, et al. Cardioprotection of ginsenoside Rb1 against ischemia/reperfusion injury is associated with mitochondrial permeability transition pore opening inhibition[J/OL]. Chin J Integr Med, 2016. doi:10.1007/ s11655-015-2433-6.
[33] Kwon HW. Inhibitory effect of 20(S)-ginsenoside Rg3 on human platelet aggregation and intracellular Ca2+ levels via cyclic adenosine monophosphate dependent manner[J]. Prev Nutr Food Sci, 2018, 23(4): 317-325.
[34] Pang LZ, Ju AC, Zheng XJ, et al. YiQiFuMai Powder Injection attenuates coronary artery ligation-induced myocardial remodeling and heart failure through modulating MAPKs signaling pathway[J]. J Ethnopharmacol, 2017, 202: 67-77.
[35] Li G, Qian W, Zhao C. Analyzing the anti-ischemia–reperfusion injury effects of ginsenoside Rb1 mediated through the inhibition of p38 MAPK[J]. Can J Physiol Pharmacol, 2016, 94(1): 97-103.
[36] Yin H, Liu Z, Li F, et al. Ginsenoside-Rg1 enhances angiogenesis and ameliorates ventricular remodeling in a rat model of myocardial infarction[J]. J Mol Med (Berl), 2011, 89(4): 363-375.
[37] Zhang YJ, Zhang XL, Li MH, et al. The ginsenoside Rg1 prevents transverse aortic constriction–induced left ventricular hypertrophy and cardiac dysfunction by inhibiting fibrosis and enhancing angiogenesis[J]. J Cardiovasc Pharmacol, 2013, 62(1): 50-57.
[38] Kim JH. Pharmacological and medical applications of Panax ginseng and Q2 ginsenosides: a review for use in cardiovascular diseases[J]. J Ginseng Res, 2018, 42(3): 264-269.
[39] Wu Y, Xia ZY, Dou J, et al. Protective effect of ginsenoside Rb1 against myocardial ischemia/reperfusion injury in streptozotocin-induced diabetic rats[J]. Mol Biol Rep, 2011, 38(7): 4327-4335.
[40] Chen X, Wang R, Chen W, et al. Decoy receptor-3 regulates inflammation and apoptosis via PI3K/AKT signaling pathway in coronary heart disease[J]. Exp Ther Med, 2019, 17(4): 2614-2622.
[41] Chen X, Wang R, Chen W, et al. Total ginsenosides increase coronary perfusion flow in isolated rat hearts through activation of PI3K/Akt-eNOS signaling[J]. Phytomedicine, 2010, 17(13): 1006-1015.
[42] Wang Y, Hu Z, Sun B, et al. Ginsenoside Rg3 attenuates myocardial ischemia/reperfusion injury via Akt/endothelial nitric oxide synthase signaling and the B-cell lymphoma/ B-cell lymphoma-associated X protein pathway[J]. Mol Med Rep, 2015, 11(6): 4518-4524.
[43] Tsutsumi YM, Tsutsumi R, Mawatari K, et al. Compound K, a metabolite of ginsenosides, induces cardiac protection mediated nitric oxide via Akt/PI3K pathway[J]. Life Sci, 2011, 88(15/16): 725-729.
[44] Kang JI, Choi Y, Cui CH, et al. Pro-angiogenic ginsenosides F1 and Rh1 inhibit vascular leakage by modulating NR4A1[J]. Sci Rep, 2019, 9(1): 4502.
[45] Guo D, Murdoch CE, Liu T, et al. Therapeutic angiogenesis of Chinese herbal medicines in ischemic heart disease: a review[J/OL]. Front Pharmacol, 2018, 9: 428. doi: 10.1155/2018/3725962.
[46] 張庆勇, 陈燕萍, 刘芬, 等. 人参皂苷Rg1对大鼠急性缺血心肌血管再生的促进作用[J]. 第三军医大学学报, 2013, 35(1): 42-45.
[47] 王永刚, 钟伟, 于远望, 等. 人参与丹参配伍对心肌缺血再灌注模型大鼠抗氧化和血管内皮细胞因子的影响[J]. 世界中西医结合杂志, 2013, 8(7): 669-671.
[48] 魏英, 余丽梅, 王钰莹, 等. 人参总皂苷促进血管新生改善急性心肌梗死大鼠心功能[J]. 中国药理学通报, 2016, 32(4): 559-564.
[49] Gan J, Qian W, Lin S. Umbelliferone alleviates myocardial ischemia: the role of inflammation and apoptosis[J]. Inflammation, 2018, 41(2): 464-473.
[50] Zhang LP, Jiang YC, Yu XF, et al. Ginsenoside Rg3 improves cardiac function after myocardial ischemia/reperfusion via attenuating apoptosis and inflammation[J/OL]. Evid Based Complement Alternat Med, 2016, 2016: 6967853. doi:10.1155/2016/6967853.
[51] Ma L, Liu H, Xie Z, et al. Ginsenoside Rb3 protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of jnk-mediated nf-κb pathway: a mouse cardiomyocyte model[J/OL]. PLoS One, 2014, 9(8): e103628. doi:10.1371/journal.pone.0103628.
[52] Chen RC, Wang J, Yang L, et al. Protective effects of ginsenoside Re on lipopolysaccharide-induced cardiac dysfunction in mice[J]. Food Funct, 2016, 7(5): 2278-2287.

