焦亡介导高糖引起的小鼠胚胎成骨细胞MC3T3-E1炎症与损伤*
罗立慧 ,傅晓莹 ,郑扬希 ,梁伟杰 ,智喜梅 ,邓海鸥,张伟杰,王瑞雪,吴 文△
(1南方医科大学第二临床医学院,广东广州510515;2广东省人民医院,广东省医学科学院,广东省老年医学研究所东病区内分泌科,广东广州510080;3汕头大学医学院,广东汕头515063)
糖尿病(diabetes mellitus,DM)合并骨质疏松症(diabetic osteoporosis,DOP)是指长期血糖升高引起的骨骼基质层破坏、骨密度降低、骨折风险升高的一种骨病,其发病率高、治疗措施有限,是DM严重的并发症之一,已成为当前国际上有关糖尿病并发症研究的热点之一[1]。迄今,DOP骨代谢异常的作用机制尚未完全阐明,其中成骨细胞(osteoblast,OB)功能障碍处于骨代谢异常的核心环节[2-3]。因此,深入探讨高血糖对OB的损伤作用及其机制具有重要的临床意义。
近年来,DM被认为是一种慢性免疫炎症性疾病,特别是其并发症与慢性炎症有密切的关系[4]。细胞焦亡(pyroptosis),也被称为“细胞炎性坏死”,是一种和炎症反应密切相关的程序性细胞死亡方式。细胞焦亡这一术语由Brennan和Cooksen在2000年提出[5],并于2012年被国际细胞死亡命名委员会定义为胱天蛋白酶1(caspase-1,CASP1)依赖性程序性细胞死亡[6]。焦亡发生过程中所产生的炎症小体(inflammasome)是由胞浆内核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)等模式识别受体及胱天蛋白酶1前体(procaspase-1)经含胱天蛋白酶募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)衔接而组装形成的大分子复合物。炎症小体能识别细菌、病毒等感染性或非感染性危险信号分子,将非活性的procaspase-1聚集;procaspase-1则自发解构形成两类亚基(p20和p10),2个p20亚基和2个p10亚基组装成四聚体并激活CASP1,进而促进白细胞介素1β(interleukin-1β,IL-1β)和IL-18等炎症细胞因子大量释放,引起“瀑布效应”[7]。细胞焦亡与DM及其并发症关系密切,其中在DM相关心血管损害中的作用研究颇多。Qiu等[8]指出,高糖(high glucose,HG)激活NLRP3炎症小体后能通过细胞焦亡途径加重DM大鼠的心肌缺血/再灌注损伤,同时采用CASP1抑制剂可减轻心肌细胞损伤;Luo[9]等报道,在2型 DM大鼠在体或离体模型中均可见NLRP3、procaspase-1、CASP1和IL-1β表达的增加,但是,沉默NLRP3基因可抑制糖尿病心肌病的发展。此外,亦有研究表明,焦亡能够介导DM引起的慢性肾小球疾病[10]及视网膜病变[11]。然而,细胞焦亡是否参与HG引起的骨代谢紊乱,至今鲜有报道。为此,本研究建立HG损伤MC3T3-E1细胞(小鼠胚胎成骨细胞)模型,旨在探讨细胞焦亡是否参与HG引起的成骨细胞炎症和损伤。
材料和方法
1 材料
针对CASP1基因的小干扰RNA(CASP1-siRNA)由广州锐博生物公司设计合成;地塞米松、维生素C、β-甘油磷酸钠、罗丹明123(rhodamine 123,Rh123)及 2′,7′-二氯二氢荧光素二乙酯(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)购于 Sigma-Aldrich;抗NLRP3抗体和抗CASP1抗体购自Abcam公司;细胞计数试剂盒 8(Cell Counting Kit-8,CCK-8)购于上海贝博生物科技有限公司;IL-18和IL-1β ELISA试剂盒由武汉华美生物工程有限公司提供;碱性磷酸酶(alkaline phosphatase,ALP)活性测定试剂盒购自南京建成生物工程研究所;茜素红染色试剂盒购自索莱宝科技有限公司;特级胎牛血清和α-MEM培养基购自Gibco BRL;MC3T3-E1细胞由上海中科院细胞库提供。
2 方法
2.1 细胞培养 MC3T3-E1细胞为小鼠胚胎成骨细胞,来源于颅顶骨,培养于含10%优质胎牛血清的α-MEM 培养基,置于 5%CO2、湿度 70%~80%、温度37℃的细胞培养箱中培育。当细胞密度达80%左右时,加入0.25%胰蛋白酶-EDTA进行消化,根据消化情况迅速加入完全培养基终止消化,轻轻吹落瓶壁细胞并吸出细胞悬液,在1 000 r/min条件下离心5 min,按1∶3~1∶5的比例进行传代及后续实验。
2.2 实验分组 实验分为4组:(1)对照(control)组:α-MEM培养基(葡萄糖浓度为5.5 mmol/L)处理MC3T3-E1细胞24 h;(2)HG组:用高糖培养基(葡萄糖浓度为45 mmol/L)处理细胞24 h;(3)CASP1-siRNA+HG组:50 nmol/L CASP1-siRNA转染细胞6 h后撤去,PBS冲洗后更换为高糖培养基继续处理细胞24 h;(4)阴性对照(negative control,NC)siRNA+HG组:50 nmol/L NC siRNA转染细胞6 h后撤去,PBS冲洗后更换为高糖培养基处理细胞24 h。
2.3 CASP1-siRNA细胞转染和最佳干扰序列的筛选 由广州锐博生物公司设计并提供3条CASP1-siRNA序列(001:5′-GAAGGCCCATATAGAGAAA-3′;002:5′-CCAAGGTGATCATTATTCA-3′;003:5′-GCTGAAACATTTGTTGTCA-3′)和1条NC siRNA序列。用RNase-free water溶解siRNA冻干粉并配制成20 μmol/L的储存液,在细胞密度达30%~50%实施转染,按说明书要求稀释siRNA及加入riboFECTTMCP Reagent制备成转染复合物,使转染浓度为50 nmol/L,室温孵育10 min后进行转染操作,6 h后按实验分组要求进行相应的干预措施。转染效果评估通过Western blot法检测CASP1的表达来进行,选取沉默效果最佳的一个序列用于后续的实验。实验重复3次。
2.4 成骨细胞诱导分化 待细胞生长融合约80%时,根据实验分组要求处理后更换成骨诱导分化液继续培养,每3 d换液1次,其中诱导分化培养基由含4%胎牛血清、10 nmol/L地塞米松、50 mg/L维生素C及10 mmol/L β-甘油磷酸钠的α-MEM培养基配制而成。
2.5 CCK-8法测定细胞存活率 接种MC3T3-E1细胞于96孔板,当细胞密度达到80%时,给予不同干预后,根据CCK-8试剂盒说明书要求,先弃去细胞培养液,于每孔加入 90 μL α-MEM和10 μL CCK-8试剂,37℃温箱中孵育2~4 h,设定酶标仪波长为450 nm,轻轻振动5 s,记录各孔吸光度(A),并计算各组重复孔平均值,代入公式:细胞相对活力(%)=处理组A/对照组A×100%。实验重复3次。
2.6 Western blot法检测NLRP3和CASP1蛋白表达水平 接种MC3T3-E1细胞于6孔板中,密度达80%后根据实验分组予相应处理后吸出培养基,预冷PBS冲洗 3次,每孔加入裂解液 30~40 μL,于冰上静置裂解30 min,细胞刮刀充分刮取蛋白,4℃、12 000 r/min离心10 min,取上清并采用BCA法计算蛋白浓度。各组蛋白经SDS-PAGE分离后转移至PVDF膜上,5%脱脂奶粉封闭60 min,随后分别加入抗NLRP3抗体和抗CASP1抗体(均1∶1 000稀释),4℃摇床孵育过夜,冷TBST漂洗3次,每次5 min,加入相应的II抗(1∶2 500稀释)4℃摇床孵育2 h,再予TBST漂洗3次,每次5 min,在PVDF膜上加入发光试剂ECL显色,暗室曝光,最后凝胶成像系统扫描分析结果。实验重复3次。
2.7 ELISA法检测IL-18和IL-1β水平 收集各组细胞培养上清液作为待测标本,按照ELISA试剂盒操作说明书步骤,往包被抗IL-18和IL-1β抗体的微孔板中分别加入待测标本,最终每孔加入终止溶液终止反应,5 min内用酶标仪在450 nm波长下测定吸光度(A),计算各组重复孔平均值,代入公式:IL-18和IL-1β的释放率(%)=处理组A/对照组A×100%。实验重复3次。
2.8 DCFH-DA染色荧光显微镜照相法检测细胞内ROS水平 将MC3T3-E1细胞传代接种于24孔板,经干预处理后,PBS液冲洗3次,每孔加入浓度为10 μmol/L的DCFH-DA荧光液200 μL,温箱中孵育30 min,继续PBS冲洗吸干,倒置荧光显微镜每个分组随机拍摄3个高倍镜视野,ImageJ 1.47i软件记录每张照片绿色荧光强度的平均值[即平均荧光强度(mean fluorescent intensity,MFI)]并进行统计分析。实验重复3次。
2.9 Rh123染色荧光显微镜测定成骨细胞线粒体膜电位(mitochondrial membrane potential,MMP) 24孔板培育MC3T3-E1细胞,细胞融合约80%时干预细胞后予PBS润洗3次,每孔加入含1 mg/L Rh123染色剂的无血清培养基200 μL,37℃培养箱中温育45 min,随后显微镜下随机摄片,最后应用图像分析软件计算MFI(反映MMP高低),并统计分析各组数据。实验重复3次。
2.10 ALP活性测定 将MC3T3-E1细胞传代接种于6孔板中,按照不同实验分组予相应干预后,更换成骨诱导分化液培养7 d,吸去培养基,每孔加入适量裂解液充分裂解60 min,4℃、15 000 r/min离心15 min,上清液作为待测样本,遵循ALP微板法测定试剂盒步骤添加试剂,在酶标仪波长520 nm下测定各孔吸光度(A),根据说明书提供的公式计算出细胞ALP活性。
2.11 茜素红钙化结节染色 MC3T3-E1细胞接种于6孔板中,按实验组要求给予相应的干预后更换成骨诱导分化培养基,第21天时收集细胞,95%无水乙醇进行样本固定,茜素红染色试剂染色,PBS冲洗,随后在倒置显微镜下观察钙化结节的数量。
3 统计学处理
采用SPSS 21.0软件对实验数据进行统计分析,计量资料以均数±标准误(mean±SEM)表示,多组间均数比较采用单因素方差分析(one-way ANOVA),两两比较运用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 HG上调成骨细胞NLRP3和CASP1蛋白的表达
HG作用于成骨细胞24 h,从6 h开始,与control组相比,NLRP3和CASP1蛋白表达水平分别升高,见图1(P<0.01),其中HG作用细胞24 h时,上述蛋白表达水平升高最明显(P<0.01)。
2 CASP1-siRNA最佳干扰序列的筛选
Western blot结果显示,与control组比较,CASP1-siRNA 001和003均能显著下调CASP1蛋白的表达(P<0.01),其中003组CASP1的蛋白表达水平下调了76%,下降程度最为显著,故选取CASP1-siRNA 003用于后续的实验。CASP1-siRNA 002和NC siRNA对CASP1的蛋白表达无明显影响,见图2。
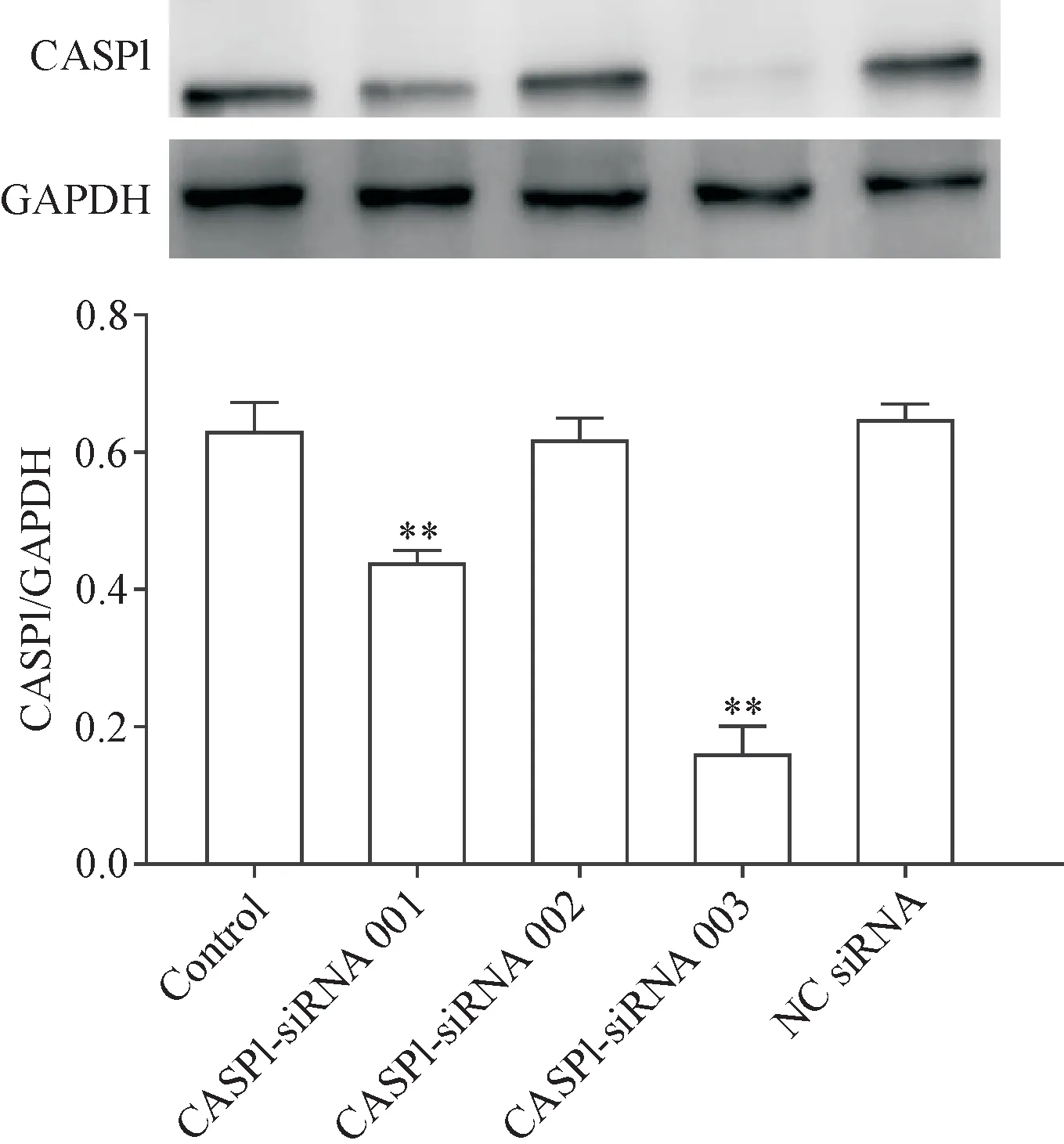
Figure 2.Screening of the most effective CASP1-siRNA in MC3T3-E1 osteoblasts.Mean±SEM.n=3.**P<0.01 vs control group.图2 CASP1-siRNA最佳干扰序列的筛选
3 沉默CASP1基因抑制HG对成骨细胞的毒性
为了观察HG对MC3T3-E1成骨细胞活力的影响,我们分别进行量-效及时-效关系的研究。首先以不同浓度(25、35、45和55 mmol/L)的葡萄糖对细胞作用24 h,观察其对细胞活力的影响,结果显示,与control组相比,上述浓度葡萄糖均有明显的细胞毒性,使细胞活力下降(P<0.01),其中葡萄糖浓度为45和55 mmol/L时细胞毒性最明显,细胞相对活力均下降均接近50%,且两者之间无明显差异,因此我们选定45 mmol/L作为葡萄糖损伤细胞的浓度,见3A;然后用45 mmol/L葡萄糖处理细胞不同时间(0、6、12和24 h),结果显示,随着葡萄糖干预时间的延长,细胞活力显著降低,并且呈明显的时间依赖关系(P<0.01),24 h时的细胞相对活力下降到(57.03±1.36)%,见图3B。根据上述结果,我们选定45 mmol/L葡萄糖干预MC3T3-E1细胞24 h来构建HG损伤成骨细胞模型。
与control组相比,HG处理MC3T3-E1细胞24 h,可使细胞活力明显下降(P<0.01);与HG组比较,CASP1-siRNA转染细胞6 h能减轻HG的细胞毒性,使细胞活力显著升高(P<0.01);NC siRNA对HG降低成骨细胞活力的作用无明显影响,见图3C。
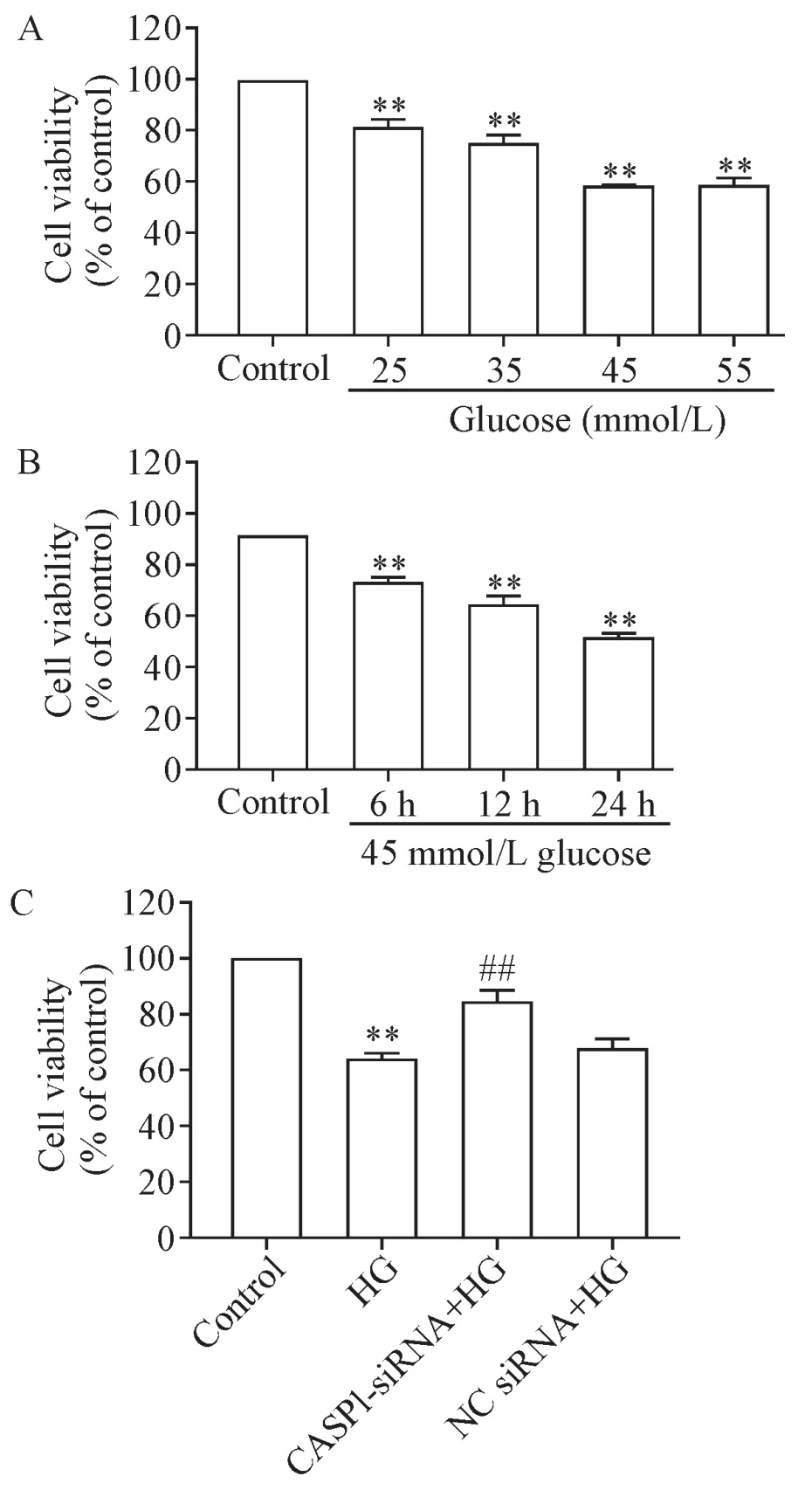
Figure 3.Knockdown of CASP1 expression inhibited the cytotoxicity of high glucose(HG)on MC3T3-E1 osteoblasts.The cell viability was detected by CCK-8 assay.A:dose-dependent effect of HG;B:time-dependent effect of HG;C:the effect of CASP1-siRNA on the viability of the cells treated with HG.Mean±SEM.n=3.**P<0.01 vs control group;##P<0.01 vs HG group.图3 沉默CASP1基因抑制HG对成骨细胞的毒性
4 沉默CASP1基因减少HG引起的成骨细胞炎症因子分泌
与control组相比,HG作用成骨细胞24 h能促进IL-18及IL-1β的分泌(P<0.01);应用CASP1-siRNA转染细胞6 h后再予HG作用24 h,IL-18及IL-1β的分泌明显减少,与HG组相比差异均有统计学意义(P<0.01);NC siRNA对HG促进IL-18和IL-1β分泌的作用无明显影响,见图4。
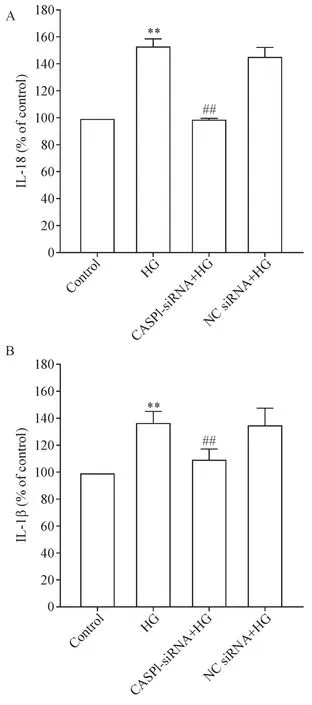
Figure 4.Knockdown of CASP1 expression inhibited high glucose(HG)-induced secretion of IL-18(A)and IL-1β(B) in MC3T3-E1 osteoblasts.Mean±SEM.n=3.**P<0.01 vs control group;##P<0.01 vs HG group.图4 沉默CASP1基因减少HG引起的成骨细胞IL-18和IL-1β分泌
5 沉默CASP1基因抑制HG引起的成骨细胞氧化应激反应
与control组比较,HG作用成骨细胞24 h可引起明显的氧化应激反应,导致胞内ROS堆积,MFI明显升高(P<0.01);与HG组比较,以50 nmol/L CASP1-siRNA转染细胞6 h后再用HG处理24 h,能显著减少细胞内ROS的堆积,MFI明显降低(P<0.01);NC siRNA对HG促进成骨细胞内ROS生成的作用无明显影响,见图5。
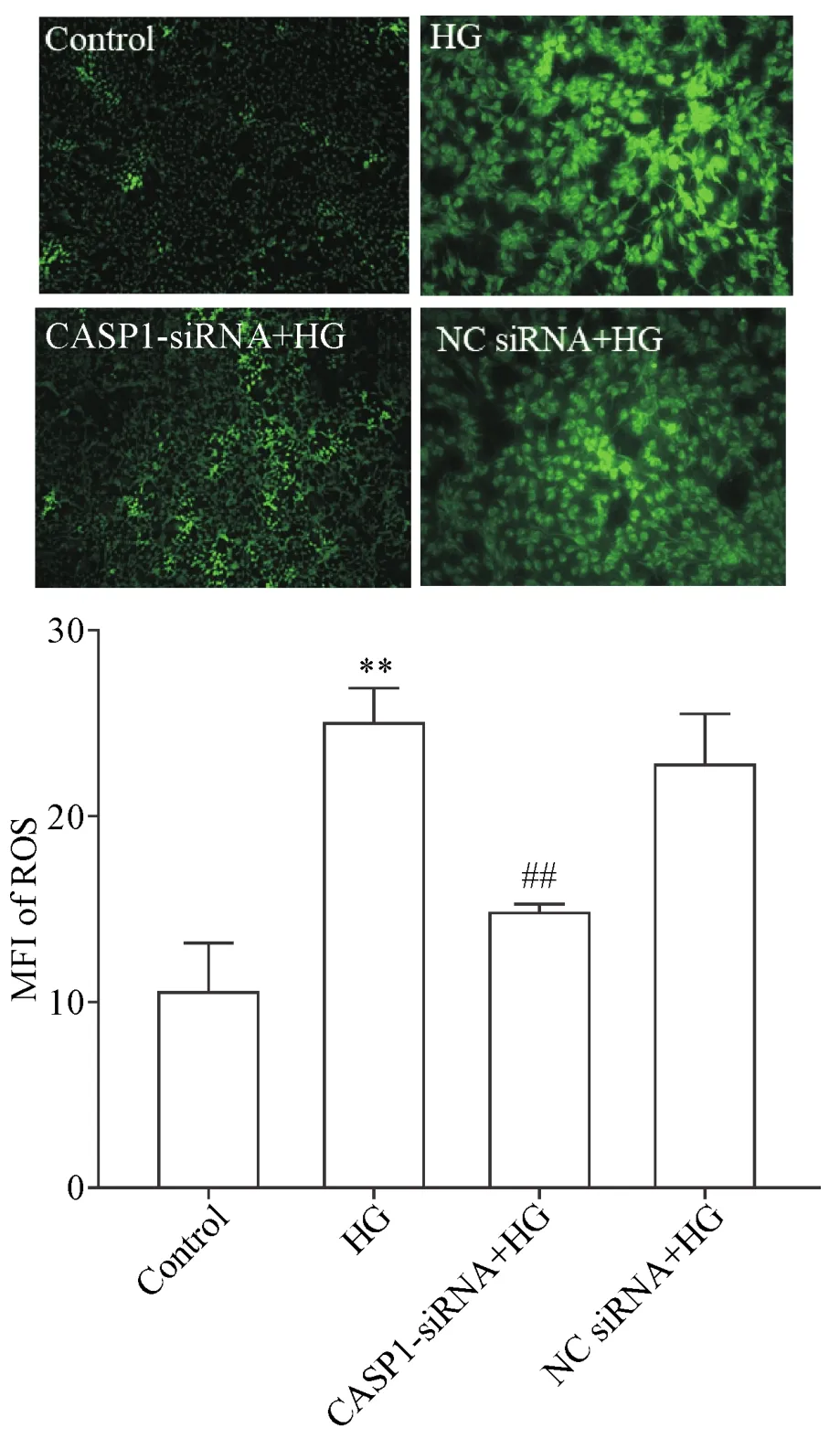
Figure 5.Knockdown of CASP1 expression inhibited high glucose(HG)-induced accumulation of intracellular reactive oxygen species(ROS)in MC3T3-E1 osteoblasts(×40).Mean±SEM.n=3.**P<0.01 vs control group;##P<0.01 vs HG group.图5 沉默CASP1基因抑制HG引起的MC3T3-E1成骨细胞氧化应激反应
6 沉默CASP1基因抑制HG引起的MMP丢失
HG干预24 h可使成骨细胞内Rh123的MFI值从(27.63±0.37)%(control组)降低至(10.33±0.88)%(P<0.01);CASP1-siRNA能够减少成骨细胞MMP丢失,使MFI上升至(24.54±0.30)%,与HG组相比差异有统计学意义(P<0.01);NC siRNA处理对HG引起的MMP丢失无明显影响,见图6。
7 沉默CASP1基因减轻HG对ALP活性的抑制
与control组比较,HG作用MC3T3-E1细胞24 h可使ALP活性明显下降(P<0.01);CASP1-siRNA转染可对抗HG对ALP活性的抑制作用(P<0.01),使ALP活性升高,与HG组相比差异有统计学意义(P<0.01);NC siRNA干预对HG抑制ALP活性的作用无明显影响,见图7。
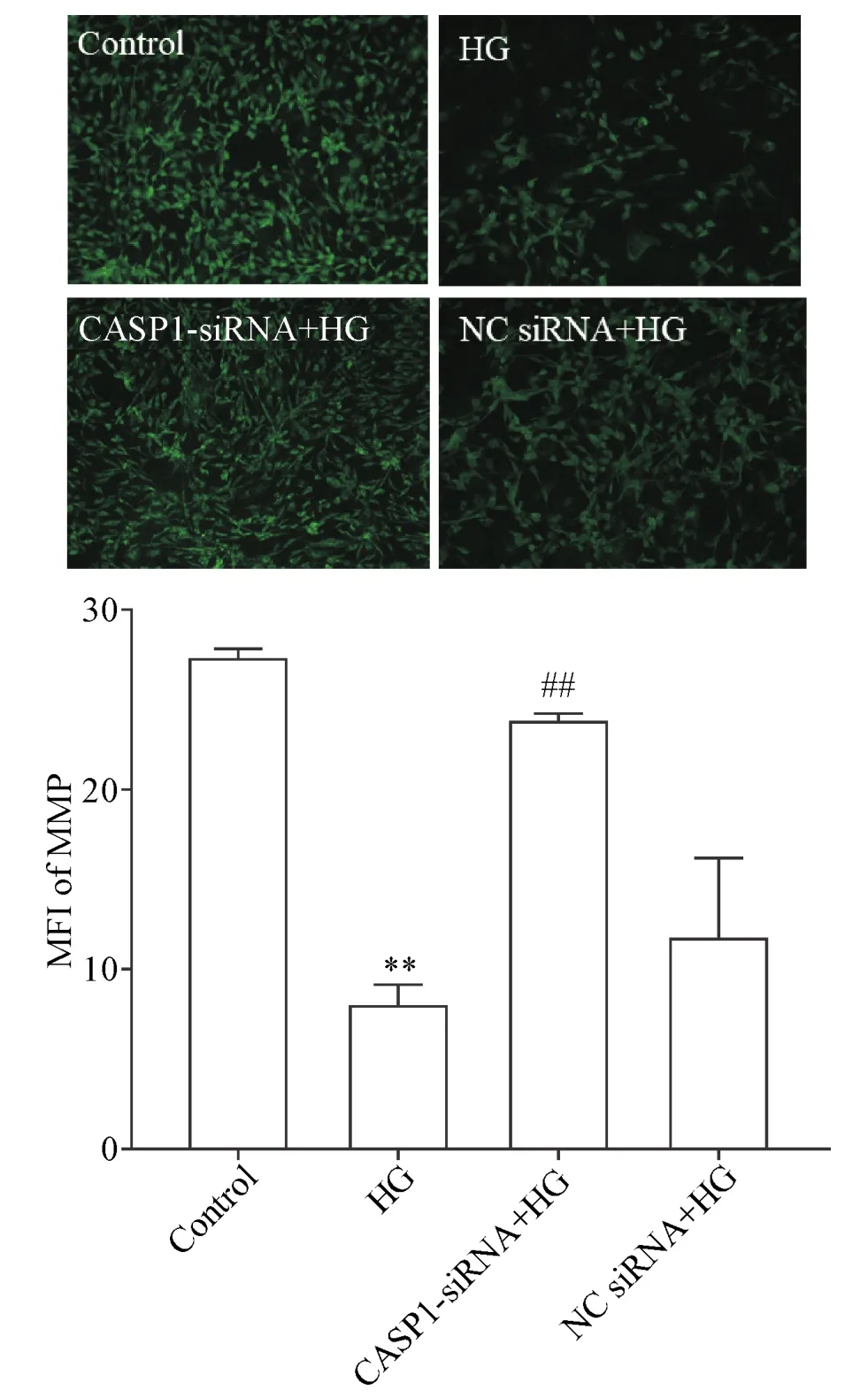
Figure 6.Knockdown of CASP1 expression inhibited HG-induced loss of mitochondrial membrane potential(MMP) in MC3T3-E1 osteoblasts(×40).Mean±SEM.n=3.**P<0.01 vs control group;##P<0.01 vs HG group.图6 沉默CASP1基因抑制HG引起MC3T3-E1成骨细胞的MMP丢失
8 沉默CASP1基因可对抗HG引起的矿化结节数量减少
成骨细胞培养至21 d时,经茜素红染色后镜下可见橙红色的矿化结节;HG作用细胞24 h可明显减少矿化结节的形成,与control组比较有显著差异(P<0.01);沉默CASP1表达可减弱HG对矿化结节形成的抑制作用,与HG组比较差异有统计学意义(P<0.01);NC siRNA对HG减少矿化结节生成的作用无明显影响,见图8。
讨 论
迄今已有实验证实,自噬(autophagy)、凋亡(apoptosis)、坏死性凋亡(necroptosis)等多种细胞死亡方式参与DOP的发生和发展[12-14]。焦亡作为一种新近发现的细胞死亡方式,在DM导致多器官损伤如糖尿病心肌病、糖尿病肾病和糖尿病视网膜病变中起着重要作用[8-11],但焦亡是否参与DOP的发生,目前尚未见报道。

Figure 7.Knockdown of CASP1 expression inhibited HG-induced reduction of ALP activity in MC3T3-E1 osteoblasts.Mean±SEM.n=3.**P<0.01 vs control group;##P<0.01 vs HG group.图7 沉默CASP1基因减轻HG对成骨细胞ALP活性的抑制
现已明确,OB功能障碍是骨代谢异常的核心环节[2-3]。高血糖可通过多种病理生理机制,例如氧化应激与钙超载[15]、炎症及 PI3K/AKT 信号通路[12,16]等损伤OB或引起骨质坏死[17-18]。本研究在HG损伤小鼠胚胎成骨细胞MC3T3-E1的实验模型也证实,HG对OB损伤是多方面的,除了能引起明显的细胞炎症反应外,还可使细胞存活率、ALP活性和矿化能力下降,ROS生成和MMP丢失增多等,这与郭宝磊[16]及Dong等[12]的报道相一致,表明这一细胞模型能较客观地反映HG对MC3T3-E1成骨细胞的致炎症与损伤作用,为深入研究HG对OB的损伤及其机制提供了可靠的细胞实验模型。
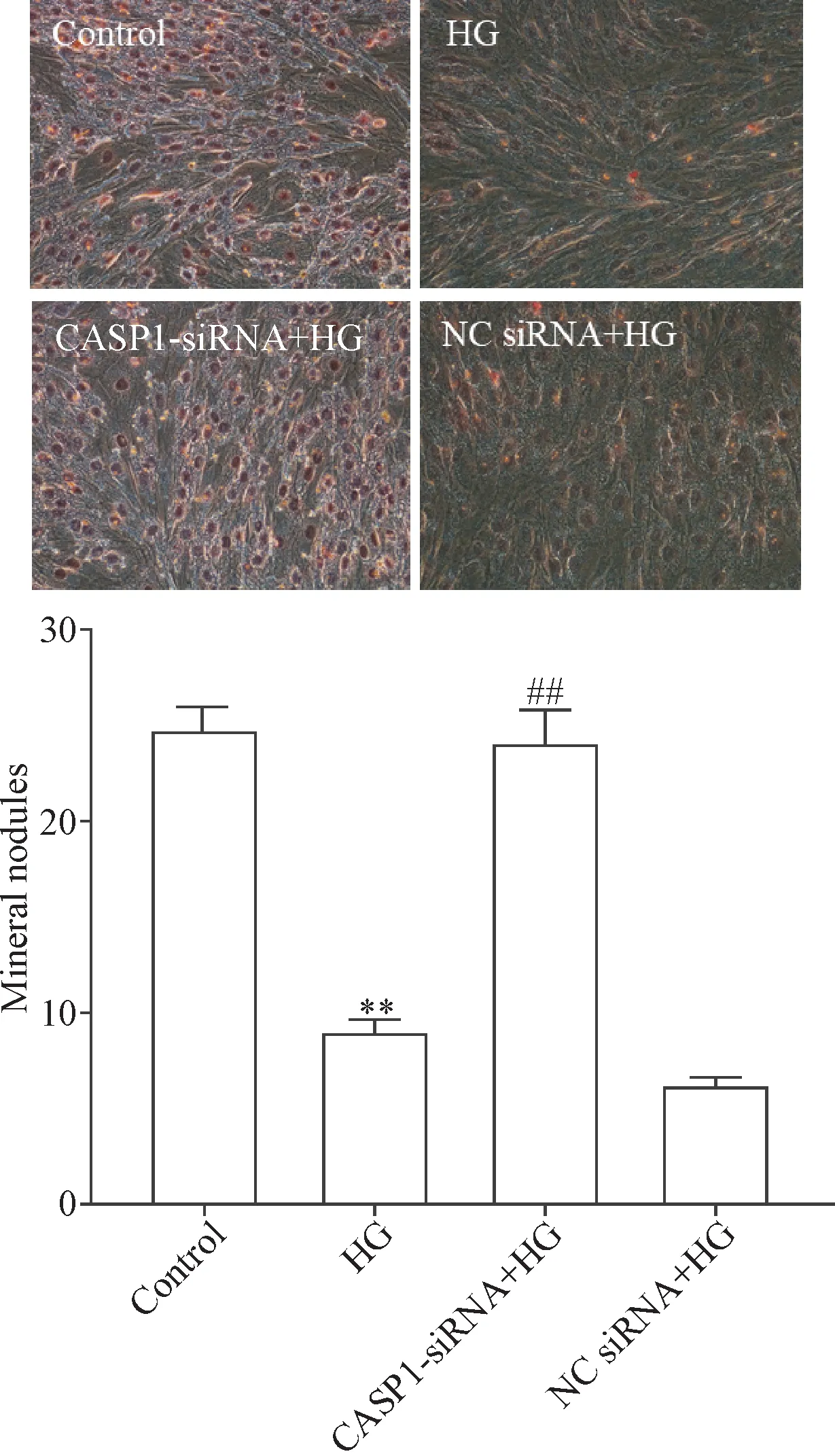
Figure 8.Knockdown of casepase-1 expression reduces the HG-induced the mineralization capability in MC3T3-E1 osteoblasts(×200).Mean±SEM.n=3.**P<0.01 vs control group;##P<0.01 vs the HG group.图8 沉默CASP1基因可对抗HG引起的MC3T3-E1成骨细胞矿化结节数量减少
值得注意的是,在本研究中,我们观察到:HG作用MC3T3-E1细胞可呈时间依赖性趋势上调NLRP3和CASP1蛋白表达水平,且能促进其下游炎症因子如IL-18和IL-1β的释放,这与Qiu等[8]与Luo等[9]在DM大鼠心肌细胞模型的研究结果相类似,并清晰地提示:在HG损伤OB过程中,可能存在细胞焦亡这一现象。于是,我们采用CASP1-siRNA转染技术,进一步观察特异性沉默CASP1的表达对HG损伤OB的影响。实验结果表明,沉默CASP1基因表达具有明显的OB保护作用,能抑制HG对MC3T3-E1细胞的致炎症及损伤作用,表现为细胞活力和ALP活性增高,矿化能力恢复,IL-18和IL-1β分泌、ROS生成及MMP丢失减少,这进一步证实焦亡参与HG引起的OB炎症和损伤。此外,Li等[17]发现,在DM大鼠模型中,抑制NLRP3炎性体分泌,可下调ASC、procaspase-1、IL-1β表达从而促进牙槽骨损伤修复;Zhang等[18]亦指出,双膦酸盐通过NLRP3/caspase-1/IL-1β机制诱导DM小鼠发生下颌骨坏死。以上研究支持本文的实验结果。
另外,由于血糖水平的高低与体内胰岛素缺乏和(或)胰岛素抵抗水平密切相关,因此,在探讨焦亡在高糖引起成骨细胞炎症与损伤中的作用时,亦应考虑胰岛素水平在其中的作用。有研究指出,胰岛素能刺激成骨细胞分化并导致骨钙素(osteocalcin)生成增多,骨钙素能促进胰岛β细胞增殖,提高骨骼肌对胰岛素的敏感性[19]。Gower等[20]报道,2型糖尿病的骨钙素水平降低。鉴于胰岛素对成骨细胞分化的作用,今后,本研究拟在2型糖尿病大鼠模型进一步探讨胰岛素对焦亡损伤成骨细胞及炎症反应的影响。
综上所述,本研究证实,焦亡介导HG诱导的小鼠胚胎成骨细胞炎症和损伤,进一步揭示DOP新的病理生理机制,并为防治DOP开拓了新思路。

