小鼠黑色素瘤细胞外泌体促进成纤维细胞表达Rac1蛋白*
把小云,王祎婷,常秀林,段乳侠,方廖琼,△
(1超声医学工程国家重点实验室,重庆医科大学生物工程学院,重庆400016;2西南大学生物技术学院,重庆400716)
肿瘤并非孤立的实体,其生存发展涉及到复杂微环境,正如一个多世纪之前的“种子和土壤”假说[1],肿瘤细胞(种子)离不开微环境(土壤)的支持,肿瘤微环境是由基质细胞、分泌因子、细胞外基质组分、外泌体等构成的复杂体系[2-3],其中外泌体是介导肿瘤细胞间通讯的特殊媒介,可携带亲本细胞的蛋白质、核酸等信息物质传递给靶细胞,赋予靶细胞“新的”生物学功能[3]。研究表明,实体组织中较为丰富的成纤维细胞可以在肿瘤外泌体的介导下由正常成纤维细胞转化为肿瘤相关成纤维细胞(cancer associated fibroblasts,CAF)而触发细胞外基质重塑,分泌多种生长因子和趋化因子,从而促进肿瘤细胞的侵袭转移过程[4],但具体的机制还未明确。值得一提的是,Ras相关C3肉毒毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)蛋白可以参与CAF介导的肿瘤微环境重塑以增强肿瘤细胞的侵袭能力。Rozenchan等[5]研究表明CAF内Rac1蛋白表达水平显著高于正常成纤维细胞,且Rac1的表达水平与乳腺癌细胞入侵淋巴结的活跃性正相关。本课题组前期的研究表明小鼠黑色素瘤B16-F10细胞外泌体可诱导小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEF)侵袭能力的表达[6],这提示我们B16-F10细胞外泌体是影响MEF侵袭性表征改变的重要介质,但具体的分子机制还有待深入研究。本研究是在此基础上通过建立B16-F10细胞外泌体与MEF共培养体系,检测共培养后MEF中Rac1蛋白表达水平变化,初步探索了B16-F10细胞外泌体影响MEF中Rac1蛋白表达的情况,为后期深入研究B16-F10细胞外泌体影响MEF侵袭的机制提供参考资料。
材料和方法
1 动物
SPF级雌性C57BL/6小鼠(孕13.5 d)由重庆医科大学实验动物中心提供。
2 细胞和主要试剂
小鼠黑色素瘤B16-F10细胞购自中国科学院上海细胞库。DMEM和RPMI-1640培养液购自Hy-Clone;胎牛血清购自ExCell Bio;肿瘤易感基因101(tumor susceptibility gene 101,Tsg101)和酪氨酸酶相关蛋白2(tyrosinase-related protein 2,Tyrp2)抗体购自Abcam;Rac1抗体购自Affinity;DAPI染色液购自碧云天;PKH26染色试剂购自Sigma;兔二步法检测试剂盒(兔增强聚合物法检测系统)PV9001和DAB显色试剂盒(ZLI-9018)购自中杉金桥公司。
3 主要方法
3.1 B16-F10细胞培养及外泌体制备 使用含10%胎牛血清、1%双抗的RPMI-1640培养液培养B16-F10细胞,并在37℃、5%CO2、饱和湿度的细胞培养箱内进行常规培养。参考Théry等[7]制备外泌体的方法:预先将胎牛血清100 000×g超高速离心8 h去除胎牛血清中的外泌体,用含10%去除外泌体的胎牛血清和1%双抗的RPMI-1640完全培养液培养B16-F10细胞,待细胞在75 cm2的细胞瓶中汇合度达到80%左右,弃上清液,PBS清洗2次,换成去除外泌体的胎牛血清继续培养48 h。收集细胞培养上清液300×g(4℃)离心 10 min,弃沉淀。上清液 2 000×g(4℃)离心15 min,弃沉淀。上清液5 000×g(4℃)离心15 min,弃沉淀。上清液100 000×g(4℃)离心70 min,收集沉淀,加入PBS缓冲液,100 000×g(4℃)离心70 min,收集沉淀,所得即为外泌体。
3.2 MEF的原代提取及培养 选择孕期在12~14 d的C57BL/6小鼠颈椎脱臼致死,在无菌条件下取出胚胎,去除胚胎头部,尾部,四肢及内脏部分。用剪刀将剩余部分剪碎,反复研磨后,置于37℃,用0.25%胰蛋白酶处理5 min,胎牛血清终止消化,120目过滤筛筛除去颗粒性组织块,将过滤后悬液96×g离心5 min,弃上清,细胞沉淀用含有10%胎牛血清和1%双抗的DMEM完全培养液重悬,置于37℃、5%CO2、饱和湿度的细胞培养箱内进行常规培养。
3.3 纳米颗粒跟踪分析(nonoparticle tracking analysis,NTA)检测粒径分布 将离心后的外泌体沉淀溶于1 mL的PBS中,涡旋使其尽可能均匀分布,将其稀释至1×1012/L的外泌体悬液,取1 mL外泌体悬液置于干净的比色皿内,使用Malvern Panalytical粒度仪检测B16-F10细胞外泌体粒径分布情况。
3.4 透射电镜负染色观察外泌体形态特征 将离心后的外泌体沉淀溶于1 mL的PBS中,涡旋使其尽可能均匀分布,将其稀释至1×1012/L的外泌体悬液,用100 μL微量注射器吸取外泌体悬液,取10 μL滴在铜网上,过夜晾干,晾干后的铜网上滴加10 μL醋酸双氧铀溶液,吸去多余液体,染色2 min,双蒸水润洗,晾干后用透射电镜观察。
3.5 Western blot实验检测外泌体特征蛋白Tsg101和Tyrp2及MEF中Rac1蛋白表达水平 准备适量外泌体及MEF样本,用含蛋白酶抑制剂的RIPA裂解液冰上裂解10 min后,收集上清液,BCA法测定蛋白浓度,取10 μg总蛋白量的蛋白提取液加入loading buffer,煮沸90 s使蛋白变性,进行SDS-PAGE,110 V恒压转膜90 min,5%BSA封闭后加入I抗(Tsg101、Tyrp2和Rac1抗体)4℃孵育过夜,加入辣根过氧化物酶标记的II抗室温孵育2 h,清洗后ECL法显色,采用ImageJ软件进行灰度值统计。
3.6 激光共聚焦显微镜观察MEF摄取外泌体过程 避光条件下,使用稀释后的PKH26染色液对外泌体的磷脂双分子膜进行染色5 min,加入适量胎牛血清终止染色后添加PBS重悬外泌体沉淀,100 000×g(4℃)离心70 min,除去多余染色液。收集离心后的外泌体沉淀,在共聚焦皿中将外泌体和MEF共培养0、12、24和36 h。待共培养结束,弃细胞培养上清液,PBS清洗,加入4%多聚甲醛避光固定;避光条件下进行DAPI染细胞核;弃去DAPI染色液,加入抗荧光淬灭液,共聚焦显微镜下观察拍照。
3.7 免疫细胞化学染色实验检测Rac1蛋白表达预先将细胞接种至铺有爬片的6孔板内,置于孵箱内使其贴壁后进行MEF与B16-F10细胞外泌体共培养0、12、24和36 h。待共培养结束,PBS清洗MEF后固定30 min,0.5%Triton X-100通透细胞,加入内源性过氧化物酶阻断剂进行封闭处理,37℃孵育I抗,经反应增强液孵育后,室温孵育II抗,DAB显色液显色,苏木素复染,自来水冲洗、脱水、透明、封片,在显微镜下观察,ImageJ软件分析每张爬片的阳性表达水平并进行统计学分析。
4 统计学处理
实验数据用SPSS 19.0软件进行统计分析,GraphPad Prism 7.0软件作图。每组实验均重复3次。计量资料采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1 B16-F10细胞外泌体结构特征
超速离心法制备的B16-F10细胞外泌体通过透射电镜负染色观察可见,外泌体呈典型茶托状形态特征,见图1A;Malvern Panalytical粒度仪检测结果表明,B16-F10细胞外泌体的粒径分布范围在141~255 nm处,见图1B;Western blot检测到B16-F10细胞外泌体表达Tsg101和Tyrp2蛋白,见图1C。
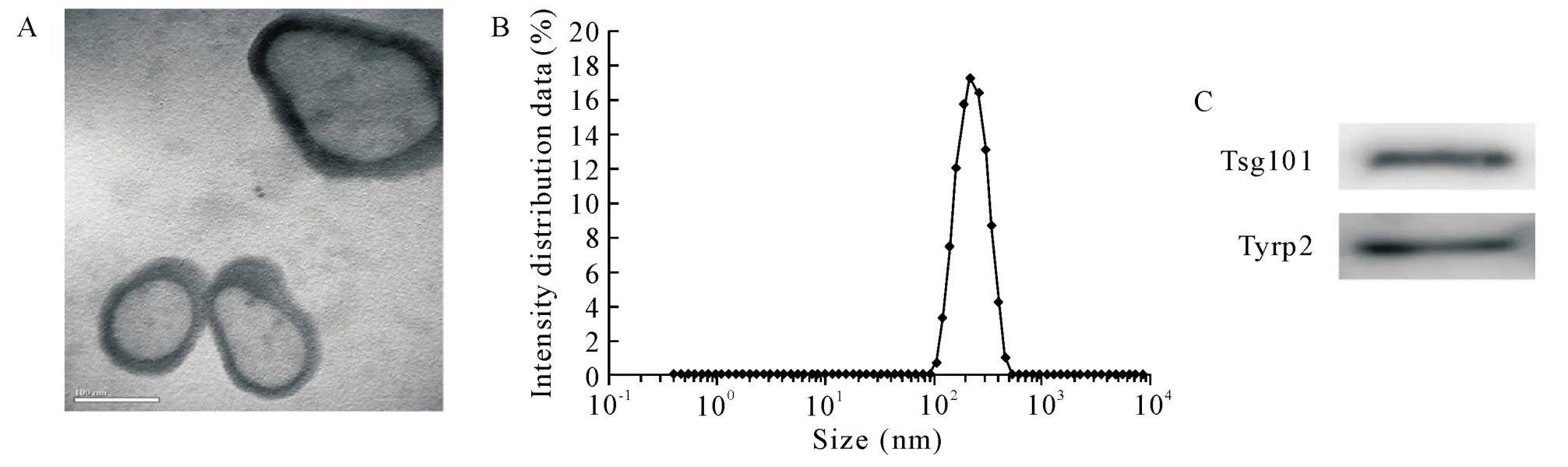
Figure 1.Identification of B16-F10 cell-derived exosomes.A:exosomes were confirmed by negative-staining transmission electron microscopy(scale bar=100 nm);B:exosome particle size distribution was quantified by Malvern Panalytical particle size analyzer;C:Western blot for determing the protein expression of tumor susceptibility gene 101(Tsg101)and tyrosinaserelated protein 2(Tyrp2)in the exosomes.图1 B16-F10细胞外泌体的鉴定
2 MEF摄取B16-F10细胞外泌体
激光共聚焦显微镜观察结果显示,与共培养0 h相比较,共培养12 h的MEF胞质内出现了少量PKH26标记的B16-F10细胞外泌体,共培养24和36 h的MEF胞质及核周围聚集了大量PKH26标记的B16-F10细胞外泌体,见图2。这表明随着时间增加,MEF摄取B16-F10细胞外泌体的能力有所增强。
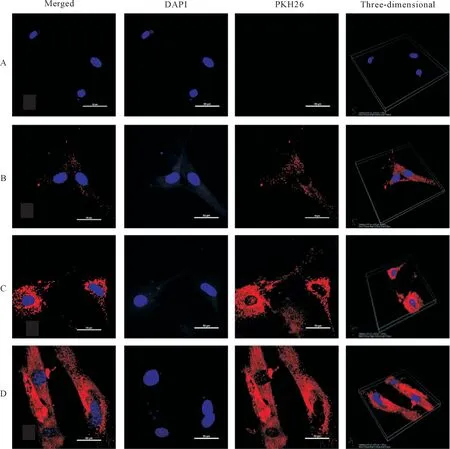
Figure 2.Uptake of B16-F10 cell-derived exosomes by MEF was observed under laser confocal microscope(scale bar=50 μm).The nuclei were labeled by DAPI,while the exosomes were labeled by PKH26.A:co-culture at 0 h;B:co-culture at 12 h;C:co-culture at 24 h;D:co-culture at 36 h.图2 MEF摄取B16-F10细胞外泌体
3 B16-F10细胞外泌体促进MEF表达Rac1蛋白
免疫细胞化学染色实验检测结果中Rac1阳性表达为棕黄色;与共培养0 h相比较,共培养12、24和36 h的MEF内Rac1阳性表达呈现逐渐增加的趋势(P<0.05或P<0.01),见图3A。Western blot实验结果显示,与共培养0 h相比较,共培养24和36 h的MEF中Rac1蛋白表达水平显著增加(P<0.01),见图3B。这些结果均证明黑色素瘤B16-F10细胞外泌体能够促进MEF中Rac1蛋白表达。
讨 论
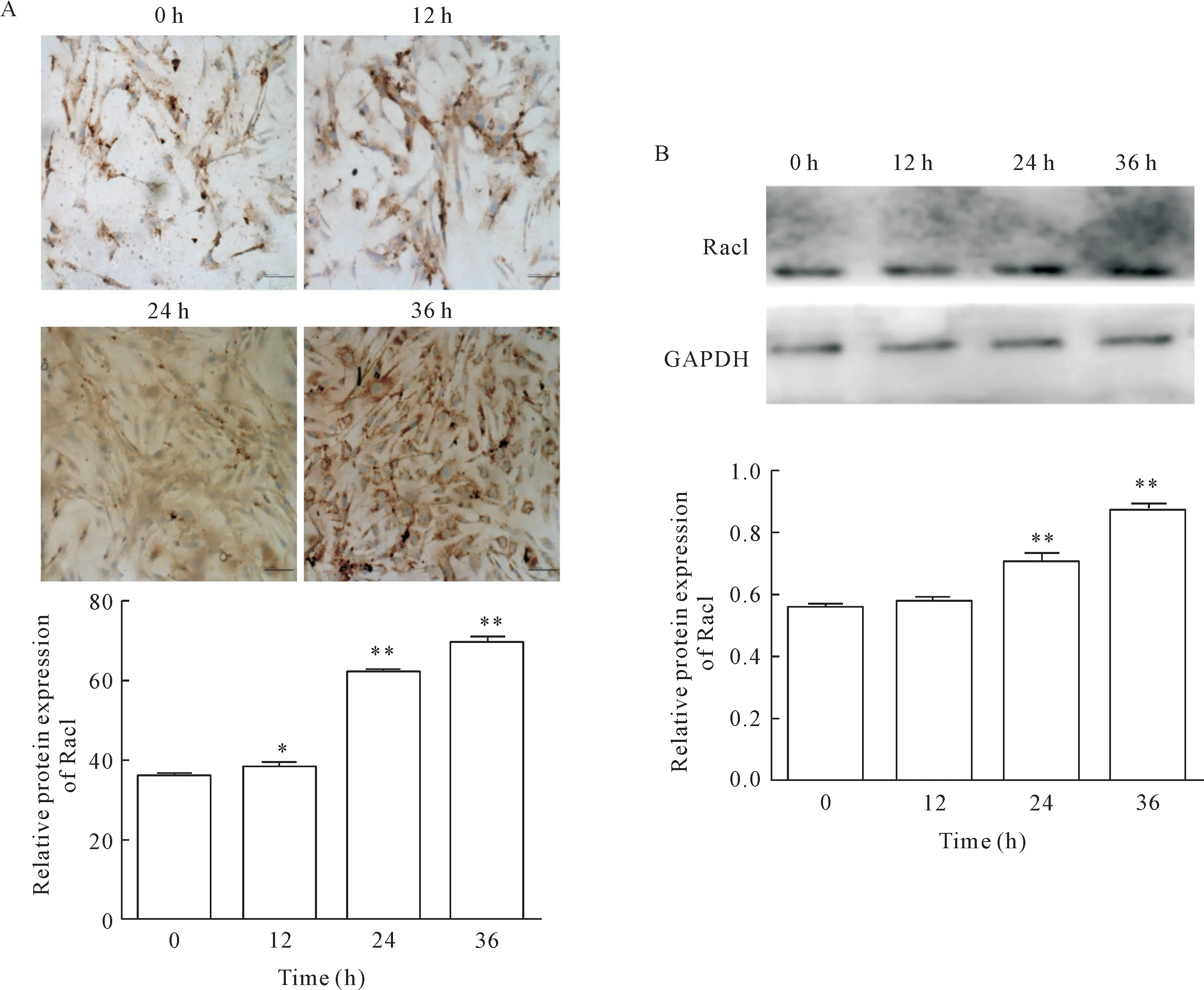
Figure 3.B16-F10 cell exosomes promoted the expression of Rac1 protein in MEF.A:immunocytochemical staining(scale bar=50 μm);B:Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs 0 h group.图3 B16-F10细胞外泌体促进MEF表达Rac1蛋白
黑色素瘤源于表皮黑素细胞的恶性转化,是最具侵袭性的皮肤癌之一,预后极差,一旦侵袭转移,5年内的存活率为5%[8]。近年来,随着研究的深入,研究人员证明黑色素瘤细胞外泌体携带丰富的蛋白质、核酸、脂质等细胞来源的信息分子,可直接充当细胞间通讯的媒介,改造周围基质细胞转变为肿瘤微环境的组成部分,促进黑色素瘤细胞的侵袭转移[9]。有研究表明,具有高度转移性的B16-F10细胞外泌体通过致癌蛋白MET(受体酪氨酸激酶)可导致骨髓祖细胞具有肿瘤恶性表型特征,促进了原发性肿瘤的转移行为[10],这表明高度转移性的B16-F10细胞外泌体可以改造正常细胞的生物学功能。本课题组前期致力于研究黑色素瘤细胞外泌体是如何营造有利于黑色素瘤细胞生存发展的微环境,基于成纤维细胞是大多数实体组织中最丰富的基质细胞,具有在一定条件下转变为CAF的潜力,成为肿瘤微环境的重要组分,我们证明了小鼠黑色素瘤B16-F10细胞外泌体能够影响正常胚胎成纤维MEF侵袭性改变[6],但有关B16-F10细胞外泌体如何影响MEF侵袭性的具体机制还未探索,有待深入探究。
Rac1蛋白可以调节黑色素瘤细胞肌动蛋白骨架重组,形成侵袭伪足,降解细胞外基质,促进细胞的侵袭转移[11-12]。近年来大量的研究表明在结肠癌[13]、乳腺癌[14]、黑色素瘤[12]等多种恶性肿瘤细胞中 Rac1蛋白表达水平较高,且其表达水平与细胞的侵袭能力紧密相关。Lee等[15]的研究表明胆脂瘤上皮中Rac1的mRNA的表达水平相比于正常皮肤平均增加2.94倍,且Rac1的异常的表达促进上皮细胞的侵袭性。Tian等[16]的研究表明在黑色素瘤B16细胞内高表达水平的Rac1蛋白会诱导F-肌动蛋白聚合,触发上皮-间充质转化,进一步增强了细胞的侵袭性。Zhang等[17]通过生物学信息分析证明了黑色素瘤B16-F10细胞外泌体内Rac1蛋白表达水平较高。因此,本研究通过建立B16-F10细胞与MEF共培养体系证明摄取了B16-F10细胞外泌体的MEF中Rac1蛋白表达水平有所升高,但究竟是B16-F10细胞外泌体释放Rac1蛋白到MEF,还是外泌体内的某种活性成分调节MEF内Rac1蛋白表达升高,以及B16-F10细胞外泌体是通过Rac1的哪种信号通路调控MEF的侵袭过程等方面还需要更深入的研究。
综上所述,本研究初步证明了黑色素瘤B16-F10细胞外泌体可促进MEF表达Rac1蛋白。这为本课题组后期探索黑色素瘤细胞外泌体导致成纤维细胞侵袭性改变的机制奠定了基础。下一步我们将重点研究黑色素瘤B16-F10细胞外泌体是否通过Rac1相关信号途径促进MEF的侵袭能力。

