穿心莲内酯对骨肉瘤143B细胞的抑制作用及其机制*
黄华坤,袁晓慧,张 平,喻婷婷,张露露,杨春梅,罗小辑,罗进勇△
(1重庆医科大学检验医学院临床检验诊断学教育部重点实验室,重庆400016;2重庆医科大学附属第一医院骨科,重庆400016)
骨肉瘤是最常见的恶性原发性骨肿瘤[1],其具有较高的局部侵袭和早期转移的趋势[2]。目前,治疗骨肉瘤的方法主要是化疗[3]和放疗[4],但是无论是放疗还是化疗都有患者承受不起的巨大副作用。鉴于此,临床上急需容易获取、疗效好而药物毒副作用低的新型药物用于骨肉瘤的辅助治疗。
穿心莲内酯(andrographolide,AG)是从穿心莲植物中提取出来,具有多种药理活性,相关文献研究了穿心莲内酯治疗人类癌症和免疫细胞的细胞过程和调控靶点[5]。随着对穿心莲内酯研究的深入,发现其还有抗炎[6-8]、抗病毒[9-10]、抗肿瘤和保护中枢神经系统作用[11-12]。文献研究表明,穿心莲内酯可以很好地抑制膀胱癌[13]、前列腺癌[14]、口腔癌[15]、胃癌[16]、结肠癌[17]、乳腺癌[18]等多种肿瘤,且抗肿瘤作用效果好,毒副作用较小。然而,目前穿心莲内酯在骨肉瘤方面的研究还比较少。本研究旨在讨论穿心莲内酯对人骨肉瘤143B细胞增殖、迁移和侵袭等方面的抑制作用及促凋亡作用,再深入探讨其潜在的分子机制,为临床上骨肉瘤的治疗提供一个新的方向。
材料和方法
1 细胞株与主要试剂
骨肉瘤143B细胞(重庆医科大学临床检验诊断学教育部重点实验室保存备用)。胎牛血清(fetal bovine serum,FBS;ExCell Bio);DMEM高糖培养基(HyClone);穿心莲内酯(成都瑞芬思生物科技有限公司);MTT(Sigma);青霉素+链霉素和Lipofectamine 2000(Thermo Scientific);Hoechst 33258 染液(Solarbio);结晶紫染液、蛋白提取试剂盒及Western blot相关试剂(上海碧云天公司);二甲基亚砜(dimethyl sulfoxide,DMSO;BioFrox);孔径为8 μm的Transwell小室(Corning);基质胶(BD Biosciences);荧光素酶检测试剂盒(New England Biolabs);聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜和化学发光试剂盒(Millipore);鼠抗人Snail及Bcl-2单克隆抗体,兔抗人基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)、波形蛋白(vimentin)、β-catenin和c-Myc单克隆抗体,兔抗人cleaved caspase-3和caspase-3多克隆抗体(CST);鼠抗人β-actin单克隆抗体(钟鼎生物);辣根过氧化物酶标记的山羊抗鼠和山羊抗兔IgG(II抗;北京中杉金桥生物技术有限公司)。
2 方法
2.1 细胞培养 人骨肉瘤细胞用含5 mL青霉素+链霉素配制成的10%DMEM高糖培养液(10%FBS),置于含5%CO2的37℃培养箱中培养。待细胞融合度达80%~90%时,即可以进行传代培养。
2.2 结晶紫染色实验检测143B细胞总数 当143B细胞融合度达80%~90%时,用胰酶消化细胞(在镜下观察到细胞形态开始变圆时,即终止消化),然后用10%FBS重悬细胞,制备成单细胞悬液。将10 μL的细胞悬液打进牛鲍计数板中,显微镜下计数。向24孔板中的每个孔加入500 μL含4×104个细胞的10%FBS。待细胞融合度达50%时,将细胞分为溶剂DMSO对照(control)组及0、5、10、15和20 μmol/L AG(用DMSO溶解成40 mmol/L的储存液)处理组,每个浓度均有3个复孔。分别在AG处理后的24、48和72 h后,取出相应时间的24孔板,用PBS洗涤2次,然后用4%的多聚甲醛37℃孵育箱中固定20 min,弃去多聚甲醛,在暗处将结晶紫染料加入到每个孔中(结晶紫染料以覆盖住孔底为宜),避光染色10 min,用水冲洗剩余的结晶紫染料,干燥后扫描仪扫描孔板。然后向每个孔加入10%的冰乙酸500 μL,并在震荡仪上室温适当震荡10 min,以便结晶紫充分溶解,并使用酶联免疫检测仪测定570 nm处各孔的吸光度(A)。此实验重复3次。细胞相对生长率(%)=(control组A值-处理组A值)/control组A值×100%。
2.3 MTT实验检测143B细胞的活力 当143B细胞融合度达80%~90%时,用胰酶消化细胞(在镜下观察到细胞形态开始变圆时,即终止消化),然后用10%FBS重悬细胞,制备成单细胞悬液。将10 μL的细胞悬液打进牛鲍计数板中,显微镜下计数。向96孔板中的每个孔加入200 μL含4 000个细胞的10%FBS。待细胞融合度达50%时,按2.2所述分组,每个浓度均有2个复孔。分别在AG处理后的0、24和48 h后,取出相应时间的96孔板,往每个孔加入10 μL MTT溶液,放置37℃培养箱4 h后,弃去培养基,每孔加入100 μL DMSO,室温避光适当震荡10 min,然后使用酶联免疫检测仪在492 nm波长处检测各孔的A值,并绘制细胞活力图。重复3次此实验。
2.4 集落形成实验检测143B细胞的集落形成能力 当143B细胞融合度达80%~90%时,用胰酶消化细胞(在镜下观察到细胞形态开始变圆时,即终止消化),然后用10%FBS重悬细胞,制备成单细胞悬液。将10 μL的细胞悬液打进牛鲍计数板中,显微镜下计数。每孔1 000个接种于6孔板中。待细胞完全贴壁后,将细胞分为control组及 0、1.875、2.5、3.125和3.75 μmol/L AG处理组。在37℃孵箱中培养7 d,弃去培养基,用PBS洗涤2次,然后用4%的多聚甲醛37℃孵育箱中固定20 min,弃去多聚甲醛,在暗处将结晶紫染料加入到每个孔中(结晶紫染料以覆盖住孔底为宜),避光染色10 min,用水冲洗剩余的结晶紫染料,干燥后扫描仪扫描孔板。镜下计数大于50个细胞的集落为有效细胞集落。重复此实验3次。集落形成率(%)=有效细胞集落数/总细胞集落数100%。
2.5 细胞Hoechst 33258染色检测143B细胞凋亡水平 当143B细胞融合度达80%~90%时,用胰酶消化细胞(在镜下观察到细胞形态开始变圆时,即终止消化),然后用10%FBS重悬细胞,制备成单细胞悬液。将10 μL的细胞悬液打进牛鲍计数板中,显微镜下计数。向24孔板中的每个孔加入500 μL含4×104个细胞的10%FBS。待细胞贴壁生长融合度到50%的时候,按2.2所述分组,分别处理细胞24 h,每个浓度均有3个复孔。待处理时间结束后,取出24孔板,弃去培养基后用PBS洗涤两次,然后用4%的多聚甲醛37℃孵育箱中固定20 min,弃去多聚甲醛,每孔加入0.01 g/L的Hoechst 33258染液300 μL,避光静止10 min,弃去染液。在倒置荧光显微镜下观察到细胞核形态及大小出现明显改变时,对每个视野的凋亡细胞数进行计数分析。重复此实验3次。细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
2.6 流式细胞术检测143B细胞凋亡水平 当143B细胞融合度达80%~90%时,用胰酶消化细胞(在镜下观察到细胞形态开始变圆时,即终止消化),然后用10%FBS重悬细胞,制备成单细胞悬液。将细胞加入到6 cm培养皿中,待待细胞贴壁生长融合度到50%的时候,按2.2所述分组,分别处理细胞24 h,每个浓度均有3个复孔。待处理时间结束后,0.25%胰蛋白酶消化细胞,800 r/min离心3 min。弃上清,PBS洗涤,重复3次,最后一次用500 mL PBS重悬细胞。具体操作方法按照annexin V-FITC/PI试剂盒说明书进行操作,然后经流式细胞仪检测骨肉瘤143B细胞凋亡情况。
2.7 细胞划痕愈合实验检测143B细胞的迁移能力 当143B细胞融合度达80%~90%时,用胰酶消化细胞(在镜下观察到细胞形态开始变圆时,即终止消化),然后用10%FBS重悬细胞,制备成单细胞悬液。将10 μL的细胞悬液打进牛鲍计数板中,显微镜下计数。向6孔板中每个孔加入2 mL含有1×105个细胞的10%FBS,待细胞贴壁长满整个孔板后,按2.2所述分组并分别处理细胞,并且在处理后的0、18和36 h分别记录相对应点上同一位置的划痕区域的宽度来反应AG对骨肉瘤143B细胞迁移能力的影响。划痕愈合率(%)=(0 h划痕宽度-36 h划痕宽度)/0 h划痕宽度×100%。
2.8 Transwell细胞侵袭实验检测143B细胞的侵袭能力 基质胶原液用DMEM稀释20倍,将Transwell小室放置于24孔板中,往Transwell小室上室加入60 μL稀释20倍的基质胶。放入37℃孵育箱中,待基质胶凝固后,弃去小室中剩余的液态培养基。取融合度达80%~90%的143B细胞,用胰酶消化细胞(在镜下观察到细胞形态开始变圆时,即终止消化),然后用10%FBS重悬细胞,制备成单细胞悬液。将10 μL的细胞悬液打进牛鲍计数板中,显微镜下计数。并向每个小室的上室加入400 μL含2.5×105个细胞的DMEM,按2.2所述分组并分别处理细胞,然后在下室加入500 μL 10%FBS,37℃孵育箱培养24 h。24 h后取出Transwell小室,弃去剩余的培养基,用PBS洗涤2次,然后用4%的多聚甲醛37℃孵育箱中固定20 min,弃去多聚甲醛,用棉签擦掉上室中未穿透小室膜的细胞。在暗处用结晶紫染料染色,避光染色10 min,用水冲洗剩余的结晶紫染料。干燥后在光学显微镜下观察并拍照,显微镜下取3个随机视野计数并统计结果。
2.9 Western blot检测相关蛋白的表达 取细胞融合度达50%的143B细胞,按2.2所述分组并分别处理细胞,24 h后分别提取总蛋白,用BCA法测定各组蛋白浓度,分别加入蛋白上样缓冲液后(蛋白量与缓冲液比值为4∶1),于沸水中煮10 min使蛋白变性,-80℃储存。将适量蛋白样品加入到10%SDSPAGE,恒压浓缩和分离蛋白,恒流(210 mA)将蛋白转移至PVDF膜上,用含5%BSA封闭液在37℃封闭3 h,然后加入相对应的I抗(1∶1 000稀释)于4℃放置12~16 h。在震荡仪上用TBST洗膜3次,每次10 min。然后加入相对应的山羊抗兔IgG或山羊抗鼠IgG II抗(1∶5 000稀释)于37℃孵育1 h,再用TBST洗膜3次,每次10 min,用化学发光成像仪成像。显色结果用Image Lab软件分析。
3 统计学处理
各实验均独立重复3次后,用GraphPad Prism 5进行数据分析。实验数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组内差异采用Tukey检验。以P<0.05为差异具有统计学意义。
结 果
1 AG对143B细胞增殖的抑制
结晶紫染色结果显示,143B细胞分别经过不同浓度(5、10、15、20)μmol/L AG处理24、48和72 h后,与空白组相比,细胞总数出现浓度依赖性下降。(P<0.01),见图1A。随后,我们使用低浓度AG(0 μmol/L、1.875 μmol/L、2.5 μmol/L、3.125 μmol/L和3.73 μmol/L)处理143B细胞,经过7 d的培养,与空白组相比,随着AG浓度增加,143B细胞集落形成数目明显减少(P<0.01),见图1B。MTT实验检测结果所示,与空白组相比,经过AG处理48 h后,15 μmol/L和20 μmol/L AG处理组中143B细胞的活力明显受到抑制(P<0.01),见图1C。Western blot结果同样显示,143B细胞经过AG各组处理后,AG可下调143B细胞中增殖相关蛋白PCNA的水平(P<0.01),见图1D。由此表明AG可抑制骨肉瘤143B细胞的增殖,且这种抑制效果呈浓度依赖性。
2 穿心莲内酯诱导骨肉瘤143B细胞凋亡
Hoechst 33258染色结果所示。143B细胞经过AG各组处理后,细胞出现不同程度的凋亡,其中空白组细胞凋亡率为(2.45±0.80)%,20 μmol/L AG处理组凋亡率为(68.33±1.51)%,处理组较空白组凋亡率显著升高(P<0.01),见图2A。流式细胞术检测所示,143B细胞经过AG各组处理后,各处理组与空白对照组的早期和晚期凋亡率差异明显,特别是10 μmol/L、15 μmol/L和20 μmol/L AG 处理组(均P<0.01),见图2B。Western blot结果同样显示,143B细胞经过AG各组处理后,AG可下调143B细胞中抗凋亡蛋白Bcl-2的水平(P<0.05)、上调促凋亡蛋白Bax的水平(P<0.05),凋亡相关蛋白总 caspase-3和PARP下降,而剪切的caspase-3(c-caspase-3)和剪切的PARP(c-PARP)蛋白水平上升(P<0.01),见图2C。以上结果均表明AG可以诱导143B细胞凋亡。
3 AG抑制骨肉瘤143B细胞的迁移及其侵袭能力
划痕愈合实验结果显示,经过20 μmol/L AG处理36 h后,143B细胞的迁移能力明显受到抑制,愈合率仅为(36.43±2.57)%,而与空白组0 h(左上)相比,36 h后空白组(左下)的细胞划痕愈合率高达(87.26±2.21)%,处理组较空白组迁移能力显著降低(P<0.01),见图3A。随后,我们使用Transwell小室实验检测AG对143B细胞侵袭能力的影响,经过24 h处理后,空白组中穿透小室的143B细胞数量为(405±5)个,而20 μmol/L AG处理组中,穿过小室的细胞数为(112±6)个,数量明显减少(P<0.01),见图3B。Western blot结果同样显示,迁移侵袭相关蛋白MMP-9、vimentin和Snail的表达水平明显下降(P<0.01),见图3C。以上结果均表明经AG处理,143B细胞的迁移和侵袭能力显著受到抑制。
4 AG抑制骨肉瘤143B细胞中的Wnt/β-catenin信号通路
Wnt信号通路的激活是骨肉瘤发生发展的重要因素,鉴于此,本研究使用Western blot检测Wnt信号通路中的β-catenin及其下游靶分子c-Myc的表达量。结果显示,15 μmol/L和20 μmol/L AG处理组与空白组相比,143B细胞中β-catenin和c-Myc的表达明显降低(P<0.01),见图4。由此提示AG可能通过抑制Wnt/β-catenin信号通路而抑制骨肉瘤143B细胞的增殖和侵袭,并促其凋亡。
讨 论
骨肉瘤是一种多发于青少年儿童的原发性骨恶性肿瘤,主要发生在骨远端管状骨和肱骨近端,具有恶性程度高、远端转移早的特点,也是其死亡的主要原因。手术治疗和辅助化疗是治疗骨肉瘤的主要方法[19]。然而,目前的化疗药物如顺铂、5-氟尿嘧啶、阿霉素、甲氨蝶呤等有骨髓抑制、肝功能损伤、恶心呕吐等许多副作用[20]。因此,寻找新的、治疗效果好的、毒副作用低的抗肿瘤药物已经成为人们关注的重点。
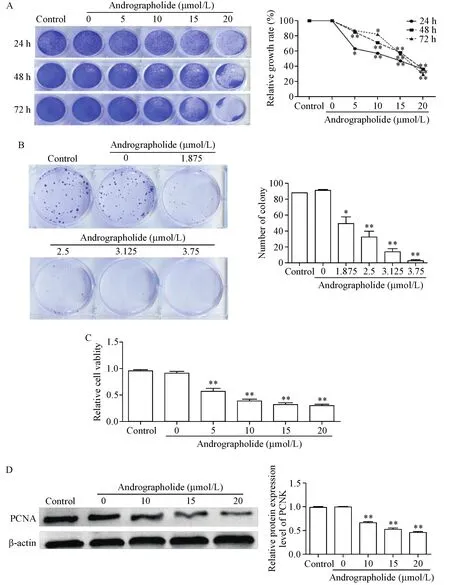
Figure 1.Effect of andrographolide(AG)on the proliferation of osteosarcoma 143B cells.A:the change of the total number of 143B cells after AG treatment was detected by crystal violet staining;B:the colony formation ability of 143B cells was detected by the colony formation assay(crystal violet staining);C:the viability of 143B cells was detected by MTT assay;D:the expression of proliferation-related protein PCNA was detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group.图1 AG对骨肉瘤143B细胞增殖能力的影响
穿心莲内酯是从穿心莲植物中提取出来,具有多种药理活性。据大量文献报道,AG具有抗多种肿瘤的作用,而且效果显著。AG可以通过将细胞周期阻滞在G2/M期,从而抑制前列腺癌[14]、胃癌[16]和黑色素瘤细胞[21]增殖;还可抑制TLR4信号通路活性,诱导结肠癌[17]和前列腺癌[22]凋亡;AG可通过下调Bcl-2的蛋白水平,并激活caspase信号级联从而诱导胃癌细胞[16]凋亡;通过上调miR-218抑制口腔癌侵袭性,降低Bmi1的表达而抑制口腔癌的干性[15]。还可以与阿霉素连用而发挥抑制乳腺癌的生长和转移的作用[23]。以上的研究结果充分说明穿心莲内酯可以通过多种途径发挥抑癌作用。但是,AG对人骨肉瘤的影响和作用及其潜在的机制仍然有待进一步的探索。
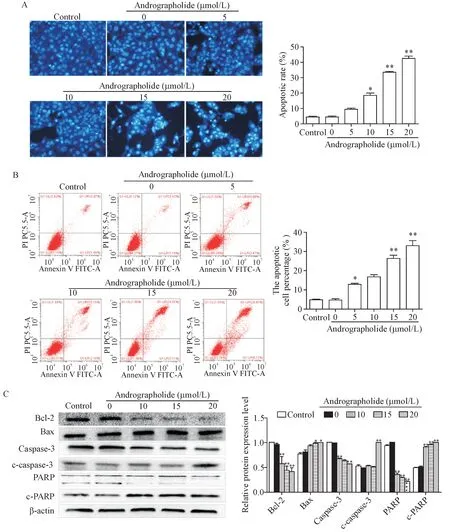
Figure 2.Effect of andrographolide(AG)on the apoptosis of osteosarcoma 143B cells.A,B:Hoechst 33258 staining(×200)and flow cytometry were performed to detect the apoptosis of 143B cells;C:the protein levels of antiapoptotic protein Bcl-2,pro-apoptotic protein Bax,and apoptosis-related proteins caspase-3,cleaved caspase-3(c-caspase-3),PARP and cleaved PARP(c-PARP)were detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group.图2 AG对骨肉瘤143B细胞凋亡的影响
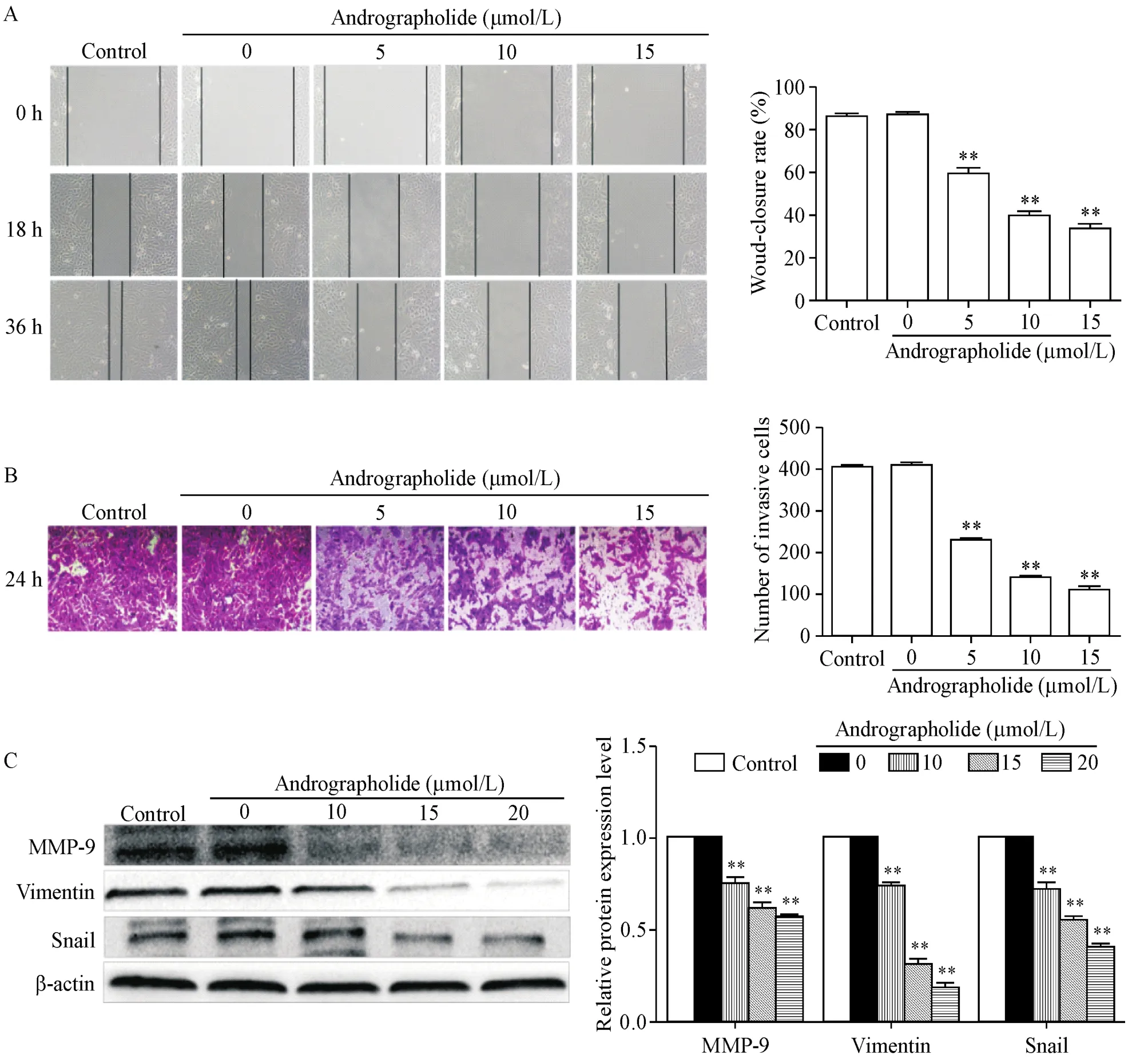
Figure 3.A:the wound-healing test was performed to measured the effect of andrographolide on the migration ability of osteosarcoma 143B cells(×100);B:the effect of andrographolide on the invasive ability of osteosarcoma 143B cells was tested by transwell assay(crystal violet staining,×100);C:the protein levels of migration and invasion related proteins vimentin,Snail and MMP-9 were detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group.图3 AG对骨肉瘤143B细胞迁移和侵袭能力的影响
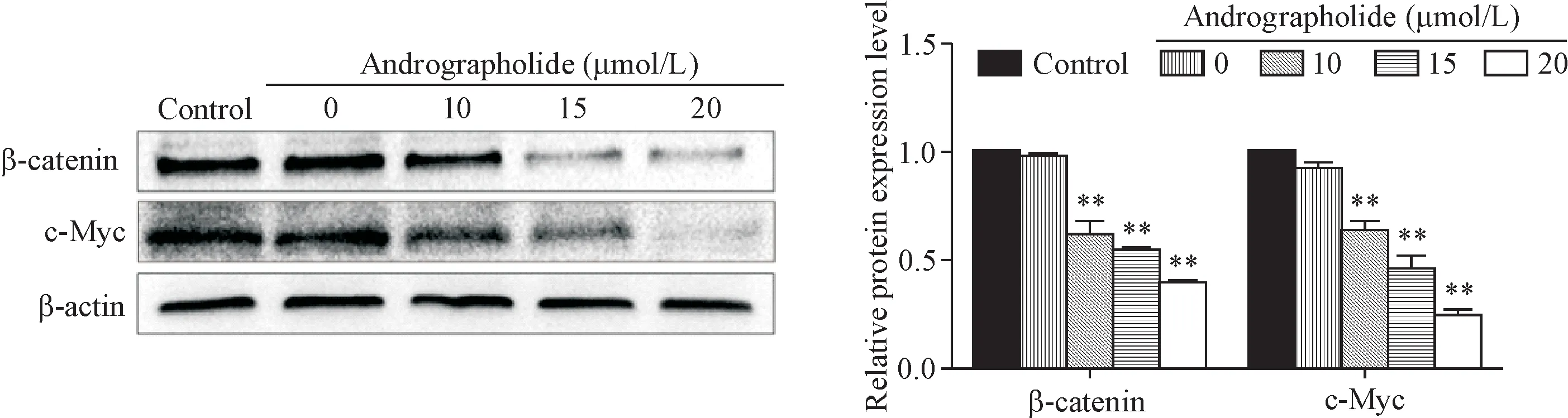
Figure 4.The effects of AG on the expression levels of Wnt/β-catenin pathway-related proteins(including β-Catenin and c-Myc)in the osteosarcoma 143B cells were detected by Western blot.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group.图4 AG对骨肉瘤143B细胞WNT信号通路相关蛋白表达的影响
本研究中,我们对AG作用于骨肉瘤143B细胞的抗肿瘤作用及其可能的机制进行了探索。细胞增殖失控是肿瘤细胞的基本特征,肿瘤细胞通过解除正常的促生长信号产生和释放从而达到维持细胞增殖,抵抗凋亡的作用[24]。于是我们使用了结晶紫染色法、集落形成实验和MTT实验以及Western blot实验去证实了AG能够抑制骨肉瘤143B细胞的增殖,并且降低增殖相关蛋白PCNA的水平。细胞凋亡是细胞自杀或程序性细胞死亡,是通过激活进化保守的细胞通路介导的。凋亡可以通过外部或内部(线粒体)途径发生。Bcl-2家族蛋白包括抗凋亡蛋白(Bcl-2、Bcl-xL、Mcl-1)和促凋亡蛋白(Bid、Bax、Bad)。当促凋亡蛋白在线粒体中被激活时,它与另一种促凋亡因子APAF1结合形成“凋亡体”复合物。然后凋亡体复合体激活一系列caspases,进而导致内源性细胞死亡。TNF受体超家族通过配体-受体相互作用发生,就会启动capspase-8的激活,进而激活下游执行靶蛋白,触发外源性细胞凋亡[25]。细胞凋亡为有效的抗癌治疗提供了一些线索,但是缺乏凋亡诱导和不适当的凋亡控制过程涉及肿瘤的发展和进展以及耐药。Sukardiman等[26]发现穿心莲内酯具有诱导癌细胞凋亡的抗肿瘤作用。我们的研究结果表明,AG使143B细胞凋亡率增加,并且使抗凋亡蛋白Bcl-2表达量下调,促进caspase凋亡途径中cleaved caspase-3的蛋白水平增多,而使caspase-3的蛋白水平下降。因而可以说明AG可以促进143B细胞的凋亡。上皮-间质转化是一个复杂的细胞过程,其主要特征是上皮细胞极性的丧失以及间质细胞特征的发展,促进了肿瘤细胞的迁移和侵袭能力[27]。拉毛卓玛等[28]证实了上皮-间充质转化可以促进肺鳞癌细胞的转移。本研究通过Transwell小室实验、划痕愈合实验以及Western blot实验发现AG能够显著地抑制人骨肉瘤细胞143B细胞的迁移和侵袭,下调迁移侵袭相关蛋白MMP-9、vimentin和Snail的表达水平。以上结果显示,AG可能是通过逆转骨肉瘤143B细胞EMT进程从而抑制其迁移和侵袭能力。
文献报道Wnt信号通路的激活是骨肉瘤发生发展的重要因素[29]。而Wnt信号通路中的c-Myc的表达降低与抗肿瘤相关,并且将会影响肿瘤的发生发展[30]。本研究使用Western blot检测后,发现AG可以明显降低β-catenin蛋白的表达量,同时也使Wnt信号通路下游的靶蛋白c-Myc的表达量显著下调。以上结果表明AG可能通过抑制143B细胞中的Wnt信号通路,从而发挥抗骨肉瘤的作用。
综上所述,本研究证实了AG能抑制骨肉瘤143B细胞的迁移、侵袭和增殖作用,并且促进其凋亡,其潜在机制可能是抑制Wnt信号通路。这些结果证明,AG具有良好的抗癌作用,这可能为AG作为新的治疗骨肉瘤候选药物提供了重要的实验依据。后续我们将进一步了解该药物在实验动物体内对骨肉瘤的抑制作用。

