脱细胞随机肌腱支架促进骨髓间充质干细胞骨向分化*
张珂珂,李红梅△,刘 畅
(1暨南大学基础医学院病理生理学系国家中医药管理局重点实验室,广东广州510632;2大连市中心医院中心实验室,辽宁大连116033)
肌腱损伤的修复和重建是骨科医生面临的一大挑战。肌腱组织血液供应差,自我修复能力有限,因此,受损肌腱组织愈合非常缓慢,即使愈合也很难达到正常肌腱的完整结构和机械强度[1]。目前用于受损肌腱修复的治疗方法有自体移植物、异体移植物、合成和天然细胞外基质(extracellular matrix,ECM)来源的移植物等,成功率极低,且具有传播疾病或产生免疫排斥反应的风险。因此,寻找有效的肌腱组织修复材料依然是临床面临的重大难题[2]。
近年来,去细胞肌腱组织由于具有巨大的临床应用潜力而备受关注。研究发现,去细胞多层肌腱切片支架可诱导骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)分化为肌腱细胞[3],且天然肌腱ECM支架能增强受损肌腱的承重能力[4]。Tong等[5]利用牛跟腱作为支架,进一步研究发现胶原纤维的方向而非胶原蛋白的含量影响BMSCs排列、延伸和分化。Yiu等[6]利用纳米纤维模拟肌腱组织的胶原纤维结构,发现有序排列的纳米纤维可以促进干细胞向肌腱分化,而随机排列的纳米纤维则促进干细胞向成骨细胞分化。我们前期利用大鼠尾肌腱制备了胶原纤维定向排列的肌腱ECM支架(定向肌腱ECM支架),发现胶原纤维的有序结构能诱导BMSCs沿胶原纤维定向生长,并促进BMSCs向肌腱细胞分化,然而随机排列的胶原纤维支架对BMSCs分化的影响尚不清楚。在本研究中,我们通过打乱鼠尾肌腱胶原纤维固有的排列,制备出胶原纤维随机排列的肌腱ECM支架(随机肌腱ECM支架),在此基础上进一步探究随机肌腱ECM支架对BMSCs活力和分化的影响。
材料和方法
1 材料
SPF级雄性 Sprague-Dawley(SD)大鼠,4~6周龄,160~180 g,购自广东医学实验动物中心,许可证号为SCXK(粤)2013-0020。LG-DMEM培养基、澳洲胎牛血清(fetal bovine serum,FBS)、PBS缓冲液、0.25%胰酶(trypsin)均购自HyClone;青霉素/链霉素(双抗)购自Gibco公司;流式检测抗体(小鼠抗人CD44-FITC、CD45-FITC、CD90-FITC和CD106-PE)购自 BioLegend;4%多聚甲醛固定液、DAPI、Triton X-100、DNA酶(DNase)和RNA酶(RNase)均购自Sigma;戊巴比妥钠购自北京诺特莱斯生物科技有限公司;细胞计数试剂盒8(Cell Counting Kit-8,CCK8)购自Dojindo;DNA提取试剂盒购自天根生物科技有限公司;Live/Dead试剂盒购自Life Technologies;RNA提取试剂盒(RNeasy Plus Mini Kit)购自Qiagen;逆转录试剂盒(PrimeScript RT Kit)和real-time PCR试剂盒(SYBR Premix Ex Taq Kit)购自TaKaRa;所用引物由Invitrogen公司设计合成。
2 方法
2.1 大鼠BMSCs的提取 采用全骨髓贴壁培养法培养BMSCs。SD大鼠3%戊巴比妥钠麻醉后,小心分离股骨和胫骨,75%乙醇浸泡消毒,PBS清洗2~3次。使用含10%FBS和1%双抗的LG-DMEM培养基冲洗骨髓腔,获取原代BMSCs,接种于细胞培养瓶内,置于细胞培养箱(37℃,5%CO2)中,每隔48 h换液,弃去未贴壁细胞。待细胞融合度达80%以上时,1∶3传代培养。
2.2 大鼠BMSCs的鉴定 利用流式细胞术检测干细胞表面标志物:取融合率达80%以上的第2代BMSCs,弃去培养液,PBS清洗,0.25%胰酶消化后制备成单细胞悬液,调整细胞密度为1×109/L,装入流式管;每管中加入500 μL细胞悬液,依次将CD44(1∶1 000)、CD45(1∶8 000)、CD90(1∶1 000)、CD106(1∶1 000)抗体稀释到相应比例后加入到细胞悬液中,吹打均匀,4℃避光孵育30 min;PBS清洗3次,弃去上清,加入500 μL PBS重悬细胞后,避光使用流式细胞术检测,计算细胞表面抗原表达率。
2.3 随机肌腱ECM支架的制备方法
2.3.1 天然肌腱组织的提取和脱细胞处理 对大鼠实施安乐死后,收集其尾巴,去除尾巴外包围的皮肤组织,使尾肌腱组织内的胶原蛋白纤维暴露出来;小心去除与胶原蛋白黏附的肌肉、脂肪等组织;收集大鼠尾肌腱胶原蛋白,PBS清洗3次。收集的鼠尾肌腱即为天然肌腱组织(normal)。脱细胞肌腱组织(decellularized)经以下处理:1%Triton X-100静置处理48小时,PBS洗涤3次,每次30 min;再用含400 μg/L DNase和200 μg/L RNase的混合液处理 24 h,37℃水平震荡,60 Hz,PBS洗涤3次,每次30 min。利用HE染色检测组织内细胞核残余情况,利用试剂盒分别提取天然组织和脱细胞组织内DNA,紫外分光光度计测量DNA浓度,并计算每g组织内的DNA含量(μg),以μg/g为单位表示。
2.3.2 随机肌腱ECM支架的制备 将脱细胞肌腱组织纵向切成长度约5 cm的片段后,放入含有5颗研磨珠的2 mL离心管,置于液氮中30 s,然后用组织匀浆机研磨90 s(60 Hz);经此步骤后,肌腱呈絮状;将絮状肌腱基质均匀平铺在载玻片上,室温下晾干后收集;使用前,修剪成1.5 cm×1.5 cm大小。利用体视显微镜和扫描电子显微镜观察支架表面结构。其他样品经伽马射线灭菌后,无菌密封保存备用。
2.4 BMSCs在随机肌腱ECM支架上的活力检测
2.4.1 Live/Dead染色 支架于生物安全柜中用无菌水浸泡过夜,风干0.5 h。以4×103/cm2的密度将BMSCs种植在支架上,37℃、5%CO2条件下培养3 h。待细胞充分粘附在支架上后,沿壁缓慢补加3 mL培养基,每48 h更换培养基。培养1、3、7和14 d后,将支架小心转移至新的24孔板中,PBS小心清洗;加入2 mL Live/Dead染色工作液,覆盖支架表面,于37℃细胞培养箱中孵育30 min,PBS清洗2次,激光共聚焦扫描显微镜观察细胞活力和形态。
2.4.2 CCK8法检测细胞活力 将BMSCs按上述方法分别接种在24孔板(对照组,control group)和随机肌腱ECM支架(实验组,random group)上,每孔板和支架上的接种细胞数为9 000个。培养1、3和7 d时,每孔加入2 mL含10%(体积分数)CCK8的完全培养基,于37℃细胞培养箱中孵育2 h,然后吸取200 μL孵育液,加入96孔板中,用酶标仪在450 nm波长下检测各孔吸光度(A)。
2.5 RT-qPCR检测 将BMSCs以1×105/cm2的密度种植在不含支架的24孔板(对照组,control group)和随机肌腱ECM支架上(实验组,random group)上。培养14 d后,将随机ECM支架转移至新的24孔板中,PBS清洗2次;加入2 mL胰酶,37℃下消化5 min,镜下观察到有脱落的圆形细胞时,加入6 mL培养基中和,然后利用培养基清洗支架3次,收集所有液体;2 000 r/min离心5 min,去上清;使用RNeasy Plus Mini Kit提取BMSCs总RNA,逆转录获得cDNA,利用real-time PCR技术检测肌腱标志物I型胶原蛋白(collagen type I,Col I)、肌腱特异转录因子scleraxis(SCX)及成骨标志物碱性磷酸酶(alkaline phosphatase,ALP)和Runt相关转录因子2(Runt-related transcription factor 2,RUNX2)的mRNA表达水平。所用引物序列如表1所示。GAPDH作为内参照,通过2-ΔΔCt法计算各组mRNA的表达量。
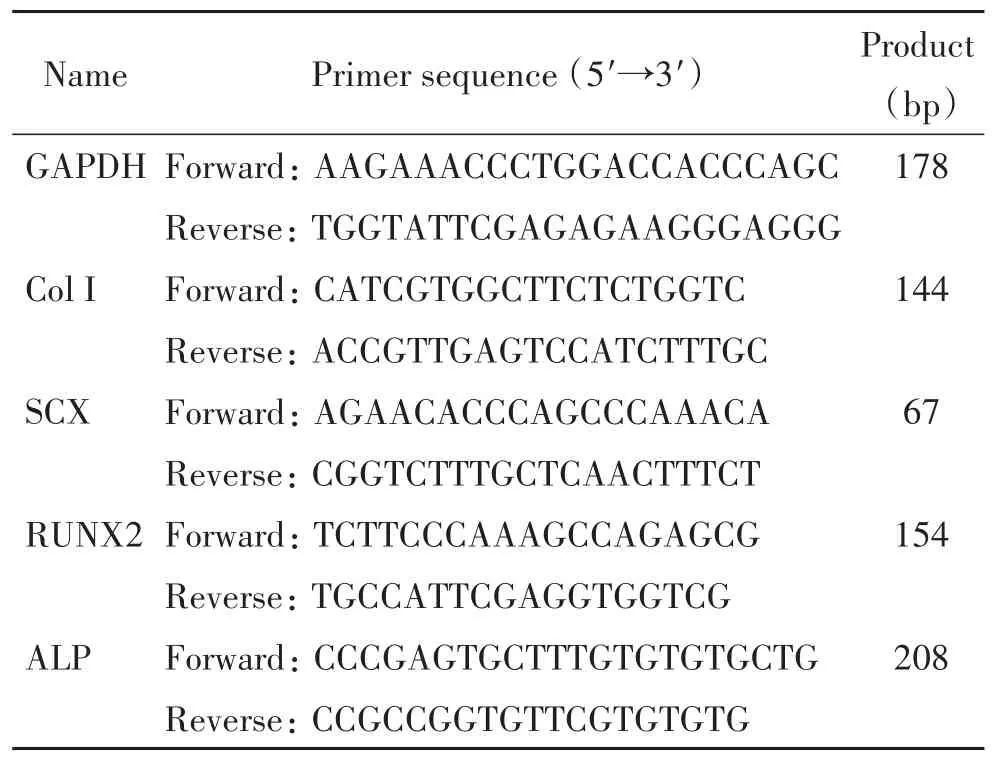
表1 RT-qPCR实验的引物序列Table 1.The sequences of the primers for RT-qPCR
3 统计学处理
使用SPSS 14.0软件对数据进行统计分析。数据以均数±标准差(mean±SD)表示,两组间均数比较使用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1 BMSCs的鉴定
原代BMSCs培养至第4天时在倒置相差显微镜下进行观察,细胞呈纺锤形,贴壁生长,并逐渐形成均一群落,见图1A,与文献报道BMSCs形态一致[4]。流式细胞术分析结果显示,第2代BMCSs中间充质细胞标志物CD44和成纤维细胞标志物CD90表达率分别为95.6%和99.5%,均大于95%;淋巴细胞标志物CD45和内皮细胞标志物CD106表达率分别为3.25%和2.32%,均小于5%,见图1B,证明分离纯化的细胞是BMSCs。
2 肌腱组织脱细胞处理
HE染色结果显示,经过1%Triton X-100和DNase/RNase脱细胞处理后,肌腱组织内细胞核显著减少,见图1A。此外,与天然肌腱组织(normal)相比,脱细胞处理组(decellularized)肌腱组织的DNA含量显著降低(P<0.05),从(481.7±15.8)μg/g显著降至(31.0±3.8)μg/g,见图2B。
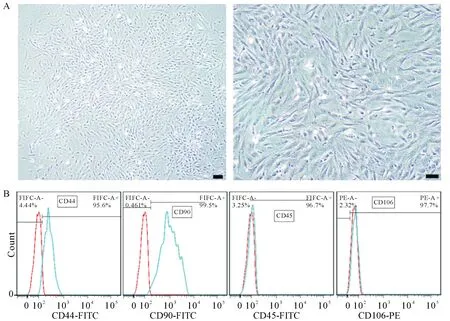
Figure 1.The morphological observation and stemness identification of the BMSCs.A:the morphological observation of the BMSCs at passage 0(scale bar=100 μm);B:flow cytometric analysis of the expression of mesenchymalstem cell marker CD44,fibroblast marker CD90,leukocyte marker CD45 and endothelial cell marker CD106 on BMSCs.图1 BMSCs形态观察及干性鉴定

Figure 2.Decellularization of rat tail tendons.A:HE staining of normal tendons and decellularized tendons(scale bar=50 μm);B:cell DNA content in normal tendons and decellularized tendons.Mean±SD.n=6.*P<0.05 vs normal group.图2 肌腱组织脱细胞
3 随机肌腱ECM支架的表面结构表征
随机肌腱ECM支架的制备过程如图3A所示,其外观图和表面结构如图3B所示,材料表面结构均匀,且观察不到原有胶原纤维的有序结构,胶原纤维呈无序排布。
4 BMSCs在随机肌腱ECM支架上活力增强
Live/Dead染液将活细胞标记为绿色,死细胞标记为红色。BMSCs在随机肌腱ECM支架上培养1、3、7和14 d后,均未在支架表面检测到死细胞;随着培养时间延长,随机肌腱ECM支架表面BMSCs数目逐渐增多,呈多边形,细胞之间联系密切;第14天,BMSCs充满整个支架表面,见图4A。CCK8结果进一步证实,与对照组相比,培养第7天BMSCs在随机肌腱ECM支架上的活力显著增强(P<0.05),见图4B。
5 BMSCs在随机肌腱ECM支架上向成骨细胞分化

Figure 3.Preparation of random tendon ECM scaffolds(A)and their appearance,stereomicroscopic image(scale bar=100 μm)and SEM image(B).图3 随机肌腱ECM支架的制备和表面结构观察
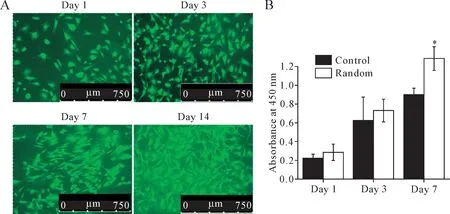
Figure 4.The viability of the BMSCs.A:BMSCs seeded on the random tendon ECM scaffolds at day 1,day 3,day 7 and day 14 were observed by fluorescence microscopy,with live cells stained green and dead cells stained red;B:the viability of the BMSCs at day 1,day 3 and day 7 was measured by CCK8 assay.Control:BMSCs seeded on the culture plate;random:BMSCs seeded on random tendon ECM scaffolds.Mean±SD.n=6.*P<0.05 vs control group.图4 BMSCs在随机肌腱ECM支架上的活力增强
与单独在24孔板中培养的BMSCs对照(control)组相比,BMSCs在随机肌腱ECM支架(random)上培养14 d后,肌腱细胞标志物Col I和SCX的表达量显著下调(P<0.05),而成骨标志物ALP和RUNX2在随机肌腱ECM支架上的表达量显著上调(P<0.05),见图5。
讨 论
脱细胞天然肌腱组织,被认为是肌腱组织工程的理想支架材料,在肌腱组织工程和再生医学领域受到广泛重视[7]。目前常用的动物肌腱组织取自兔、牛等,材料获取周期长。而大鼠来源充足,个体间差异较小,且尾肌腱材质均一,取材简单,可有效提高实验效率。因此,本研究利用大鼠尾肌腱ECM作为基质微环境,研究胶原纤维排列方式对BMSCs分化的影响,希望为修复肌腱损伤的组织工程提供所需生物材料。
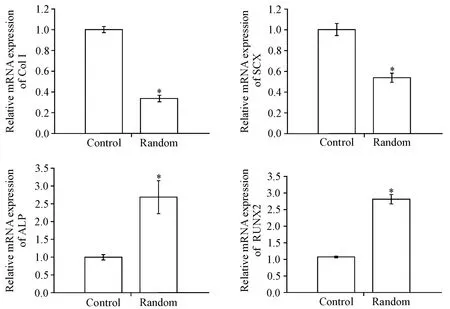
Figure 5.Differentiation of BMSCs at day 14.Relative mRNA expression levels of tenocyte-related markers collagen type I(Col I)and scleraxis(SCX),and osteogenic markers alkaline phosphatase(ALP)and Runt-related transcription factor 2(RUNX2)were detected by RT-qPCR.Control:BMSCs seeded on the culture plate;random:BMSCs seeded on random tendon ECM scaffolds.Mean±SD.n=6.*P<0.05 vs control group.图5 BMSCs在随机肌腱ECM支架上向成骨细胞分化
在应用来源于动物的肌腱组织作为支架材料时,首先要进行脱细胞处理,以去除组织原本的细胞和表面抗原,降低免疫原性,但要保持其ECM结构、组成及固有的生物力学特性,以保证肌腱ECM再细胞化后用于肌腱重建效果良好[8]。物理法、化学试剂处理法和生物试剂处理法是最常见的脱细胞方法。十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和Triton X-100被广泛用于脱细胞处理[9],其中SDS脱细胞能力强,但对组织损伤也较严重;Triton X-100较为温和,但脱细胞效果不如SDS。使用这些化学物质时,对于不同的组织,其使用浓度、处理时间以及其他物理或化学参数都要相应地发生变化,很难设定标准实验方案。在本研究中,大鼠尾肌腱组织经1%Triton X-100处理48 h,DNase/RNase混合液处理24 h后,未观察到残余细胞核,组织内残留的DNA 含量小于 50 μg/g,符合脱细胞标准[10],同时又保留了天然肌腱的物理结构。
肌腱组织ECM的组成和胶原纤维排列方式为细胞接种、黏附、增殖和分化提供了理想的微环境[11]。文献报道,经脱细胞处理后,肌腱ECM中的蛋白聚糖(纤维调节蛋白、双糖链蛋白聚糖)和生长因子(TGF-β1、IGF-1、VEGF和CTGF)能妥善保存在组织内[12]。在本研究中,我们制备了胶原纤维随机排列的肌腱ECM支架,发现种植在支架上的BMSCs能够维持较高的细胞活力,这可能与脱细胞肌腱支架中保留的蛋白聚糖和少量生长因子有关。Zhang等[13]的研究也发现兔来源的肌腱干细胞在肌腱基质上的增长速度比在塑料培养皿上更快,这与我们的研究结果一致。我们在前期研究中利用大鼠尾肌腱制备了肌腱胶原纤维定向排列的脱细胞肌腱ECM支架,发现种植在其上的BMSCs沿胶原纤维平行方向排列生长[14];在本研究中,我们利用匀浆机研磨制备胶原纤维随机排列的肌腱ECM支架,发现种植在其上的BMSCs排列杂乱,并非平行排列生长,这些结果均表明支架中胶原纤维的排列方式能够影响种子细胞的排列和生物行为学。
肌腱ECM微环境的生物化学和生物物理信号,可以直接参与调控干细胞的生物学行为。据报道,纤维调节蛋白和双糖链蛋白聚糖是构成肌腱组织ECM的两个关键成分,它们的缺失可能会导致种子细胞从成腱分化变为成骨分化[15]。此外,也有报道ECM微环境的表面形貌在调节干细胞行为中起重要作用[16]。另一个重要的微环境因素——基质硬度已证明能决定干细胞命运。Engler等[17]发现,在模仿大脑组织的柔软基质上,MSCs开始显示神经元表型;在类似横纹肌硬度的中等基质上,干细胞发育成肌细胞谱系;在类似骨骼前体(类骨质)的坚硬基质上,干细胞分化为成骨细胞[18]。我们前期研究发现,定向肌腱ECM支架能促进BMSCs向肌腱细胞进行特异性分化[14]。而本研究发现,在随机肌腱ECM支架上BMSCs肌腱细胞标志物Col I和SCX的表达显著下调,而成骨细胞标志物ALP和RUNX2显著上调,表明随机肌腱ECM支架具有诱导BMSCs向成骨细胞分化的潜能。Liu等[10]发现定向肌腱ECM支架对干细胞成骨分化的诱导作用很弱;相反地,生长在随机肌腱ECM支架上的BMSCs中Kdm6b和Jmjd1c的表达水平上调,表明随机ECM支架的表面形貌可以调控表观遗传基因的表达,增强参与成骨分化信号传导途径的激活。综上所述,随机肌腱ECM支架和定向肌腱ECM支架对BMSCs分化的不同诱导作用可能与肌腱ECM的生化成分、基质硬度、基质表面形貌等因素有关,但这些因素对干细胞分化的调控机制尚需进一步研究。
本研究制备的胶原纤维随机排列的肌腱ECM支架,能支持BMSCs黏附,增强BMSCs活力,并诱导BMSCs向成骨细胞分化,在韧带/肌腱-骨连接的修复应用中具有重大潜能。

