56℃加热灭活对流感病毒核酸检测结果影响的初步研究
周百灵 杨光能 陈俊伶 冯星星 许彬 奎莉越 杜廷义
流行性感冒(简称流感)是由流感病毒引起的急性呼吸道传染病,是人类面临的主要公共健康问题之一[1]。流感病毒属于正粘病毒科,为单股、负链、分节段的RNA 病毒,根据核蛋白和基质蛋白分为甲、乙、丙三型,其中甲型流感病毒的抗原变异性最大,在本世纪的四次流感大流行均是由甲型流感病毒引起的[1-2]。核酸检测是流感病毒确诊的主要方法之一[3],在季节性流感及流感大流行中都发挥重要作用,但核酸提取过程中可能存在的暴露风险,限制了基层实验室开展该技术,因此简单有效的病毒灭活前处理方法,有利于流感监测网络的扩大以及降低检验人员检测时的感染风险。目前新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)已成为全球大流行[4],而流感作为新型冠状病毒的主要鉴别疾病之一[5],也让流感的核酸检测面临着更高的感染风险。在《流行性感冒与治疗指南(2011 版)》中指出流感病毒一般可在56℃、30 min 被灭活,而此温度也为许多指南中[6-7]建议新型冠状病毒的灭活温度。本研究通过对口咽拭子样本加热56℃、30 min病毒灭活的条件,采用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)进行流感病毒的检测,分析灭活前和灭活后甲型流感病毒及乙型流感病毒核酸结果,对本实验室疫情监测需要做准备,做了初步探讨,进行初步的数据积累,报道如下。
1 资料与方法
1.1 临床资料
收集本院2020年1月31日至2020年2月15日收取的47例流感病毒qPCR 核酸检测阳性的口咽拭子标本(21例为甲型流感病毒,26例为乙型流感病毒),其中阳性标本包括强阳性(n=27,Ct≤26),中等阳性(n=16,26<Ct≤33)和弱阳性(n=4,33<Ct≤39);以及14例甲型流感病毒和乙型流感病毒qPCR 核酸检测均为阴性的口咽拭子标本。
1.2 试剂与仪器
ABI7500 荧光定量PCR 仪(美国Thermofisher公司);甲型流感病毒核酸检测试剂盒(中山大学达安基因股份有限公司);乙型流感病毒核酸检测试剂盒(中山大学达安基因股份有限公司)。
1.3 标本处理
将-20℃冻存的口咽拭子标本(含有1 mL 病毒运输液),复融后,分别吸取200 μL 于两个无菌离心管中,一份用于常规甲型流感病毒及乙型流感病毒的核酸检测,另一份先在56℃水浴箱中水浴30 min 后再进行常规甲型流感病毒和乙型流感病毒核酸检测的常规操作。
1.4 核酸提取和PCR 扩增
采用中山大学达安基因股份有限公司的甲型流感病毒核酸检测试剂盒和乙型流感病毒核酸检测试剂盒提取病毒RNA,按试剂盒操作说明进行。在ABI7500 型荧光定量PCR 仪上进行核酸检测,反应条件如下:50℃、15 min →95℃、15 min →94℃、15 s →58℃、45 s(45 个循环)。采用循环阈值(cycling threshold,CT)进行计算。试剂盒采用一步法实时荧光PCR 技术。每批次实验均同时检测阴性质控品,临界阳性质控品和强阳性质控品。
1.5 检测结果判断
①甲型流感病毒阳性结果的判读标准为FAM检测通道有扩增曲线且Ct 值≤39.7,乙型流感病毒阳性结果判读标准为FAM 检测通道有扩增曲线且Ct 值≤38.0;②甲型流感病毒阴性结果的判读标准为FAM 检测通道无扩增曲线或FAM 检测通道有扩增曲线且Ct 值>39.7,乙型流感病毒阴性结果判读标准为FAM 检测通道无扩增曲线或FAM 检测通道有扩增曲线且Ct 值>38.0。
1.6 统计学处理
采用SPSS 26.0 统计软件及GraphPad Prism 软件(Version8.0)进行处理,计量资料()表示,符合正态分布数据,两组数据间比较采用t检验,一致性分析采用Bland-Altman 分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 流感病毒阳性标本未加热和加热灭活后的qPCR 结果比较
对21例甲型流感病毒核酸检测阳性及26例乙型流感病毒核酸检测阳性的咽拭子标本进行未加热和加热后的qPCR 结果比较。两种流感病毒在加热后结果均为阳性,阳性结果符合率为100%。未加热和加热56℃、30 min 后其Ct 结果之间差异无统计学意义(P>0.05)。见表1及表2。
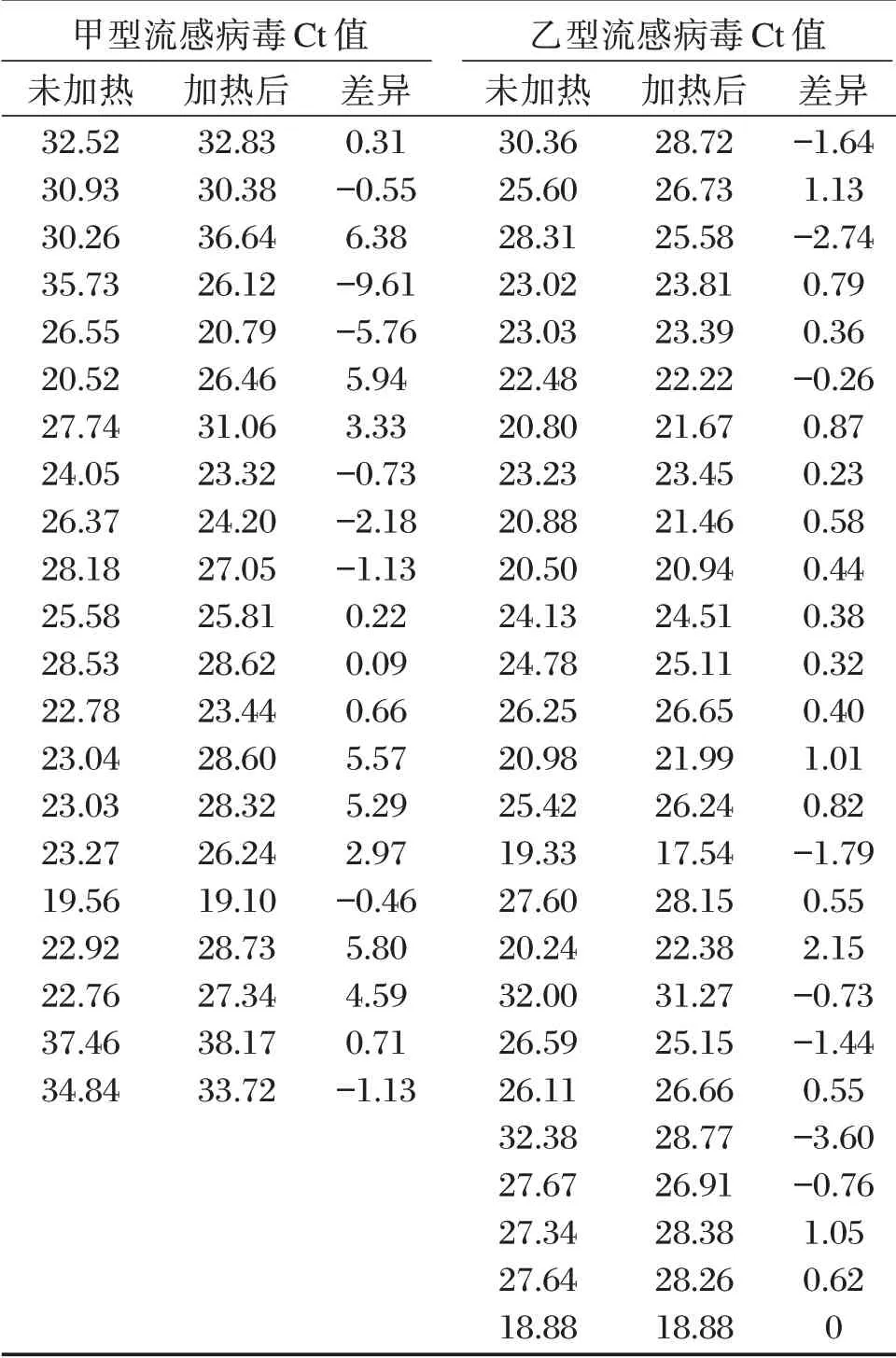
表1 未加热和加热灭活后的qPCR 结果Table1 The qPCR results of unheated and heat inactivation
表2 未加热及加热灭活后的qPCR 结果比较(±s)Table2 Comparison of the qPCR results between unheated and heat inactivation(±s)

表2 未加热及加热灭活后的qPCR 结果比较(±s)Table2 Comparison of the qPCR results between unheated and heat inactivation(±s)
n 检测项目甲流感病毒Ct 值乙流感病毒Ct 值21 26未加热26.98±5.07 24.83±3.77加热后27.95±4.76 24.80±3.32t 值-1.100 0.108P 值0.284 0.915
2.2 流感病毒阳性标本未加热和加热灭活后的qPCR 结果的一致性分析
流感病毒阳性标本加热后和未加热的标本结果具有良好的一致性。甲型流感病毒的qPCR 检测分析显示,所有点均在95%的一致性界限的置信区间以内,且在置信区间以内的差值在临床上可以接受见图1A;图B 为乙型流感病的qPCR 检测分析显示,其中3.8%(1/26)的点在95%的一致性界限的置信区间以外,小于5%,且在置信区间以内的差值在临床上可以接受。见图1B。
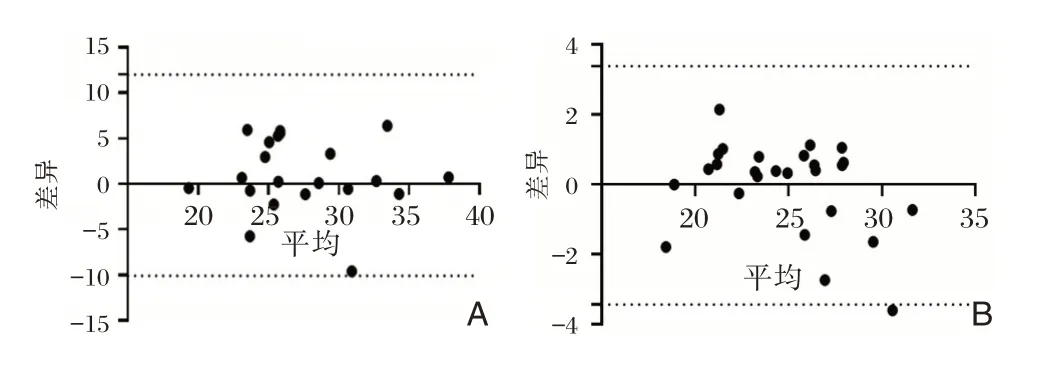
图1 未加热与加热灭活病毒后结果的一致性分析Figure1 Analysis of consistent results between unheated and heat inactivation
2.3 流感病毒阴性标本未加热和加热灭活后的qPCR 结果比较
对14例甲型流感病毒及乙型流感病毒核酸检测阴性的咽拭子标本进行未加热和加热后的qPCR 结果比较,加热后结果全部为阴性结果。阴性结果符合率为100%。
3 讨论
加热灭活病毒的方法不引入任何的化学试剂,仅需控制温度和时间,能使病毒的高级结构受到破坏,其蛋白不再有生理活性,而失去感染、致病和繁殖能力[8-9]。这种方法在牛奶消毒和血液制品病毒灭活中得到广泛运用,在血液制品中可用于血浆、凝血因子、抗凝血剂、蛋白酶抑制剂和免疫球蛋白等产品的制备[10]。而在临床检验方面,为减少实验室人员感染传染性及致病性较强的病毒(如埃博拉病毒、马尔堡病毒及沙拉病毒等)风险,更多研究关注于将血浆或血清标本加热灭活后的对生化结果的影响[11-12],但对加热灭活后对核酸检测的影响研究较少。鄢心革[13]等人利用不同温度对SARS 冠状病毒抗原性灭活效果的研究中发现,56℃、60 min 比56℃、30 min 对SARS 冠状病毒灭活的效果好,同时此温度灭活30 min 及60 min 核酸的含量变化不大;陈培松[14]等的研究发现56℃、30 min 和75%乙醇处理和未灭活处理的标本结果具有明显的相关性且一致性良好;张沁欣[15]等的研究发现在没有核糖核酸酶抑制剂的保护下,56℃灭活导致猪流行性腹泻病毒冠状病毒RNA 的明显降解,而添加RNA 酶抑制剂后则RNA 降解得到一定程度的改善。
本研究采用56℃、30 min 进行病毒灭活,此温度下在灭活新型冠状病毒的同时,流感病毒也被灭活,这对实验室核酸检测人员是极大地保护。但从一致性分析及差异结果中可以发现甲型流感病毒阳性标本中有三例标本在加热后其Ct 值反而远低于未加热的Ct 值,而在乙型流感病毒阳性标本中也发现在加热后其Ct 值反而低于未加热的Ct值此现象,考虑原因主要为以下三点:①可能为此温度加热灭活下可以促进RNA 和蛋白复合物的分离,因而使得加热灭活后核酸提取效率更高;②本试剂盒检测的甲型流感病毒的亚型不仅仅只为一种,而实际收集的样本中可能含有甲型流感病毒的不同亚型,而不同亚型之间可能对热灭活的效果不一样;③可能手工提取核酸及核酸扩增带来的误差。在甲型流感病毒的实验中,其未加热的qPCR 结果与加热后的差异大于乙型流感病毒的差异,是否与加热灭活病毒后对甲型流感病毒的检测效率影响更大尚不明确。
加热灭活病毒的方法操作简单、经济同时不引入其他化学试剂,对样本进行加热灭活病毒的前处理可以降低病毒核酸检测实验室人员的感染风险。对于热灭活病毒后是否影响核酸检测效率存在不同意见[16],而这方面的研究资料也较少,因此加热灭活或其它灭活手段对病毒核酸检测结果的影响评估尤为迫切和重要,因为该项评估的完成有利于加强实验室对高风险样本的处置管理,同时有利于更好地满足特殊情况下临床诊断和鉴别诊断的客观需要。实验室有必要收集整理相关资料,并全面完成灭活手段对临床相关检测项目的影响评估。
本实验室对加热灭活病毒的初步研究中发现,对咽拭子标本采用加热56℃、30 min 灭活病毒后再进行甲型流感病毒以及乙型流感病毒的qPCR 检测,其结果没有明显影响;但在本研究中也存在许多不足之处:①由于实验室条件限制,不能进行灭活后病毒培养,从而无法评估此条件下病毒灭活的效率,因此其降低实验室检测的生物安全压力的程度尚不能完全评估;②对于流感病毒的阳性标本上,弱阳性标本占比较少(仅有4例甲型流感病毒弱阳性标本),尚不能有效评估加热灭活对流感病毒核酸检测临界阳性样本的影响。③本次初步研究完全模拟日常检测流程,检测过程中的随机误差因素未得到更为有效的控制。上述不足将在随后展开的评估中得到进一步改进和完善。

