MicroRNA-124靶向调控caveolin-1介导肝癌细胞恶性行为的研究*
寇大庆 孙文平 綦霞
肝癌是全球范围内常见恶性肿瘤之一,其病死率居于所有肿瘤的第3位[1]。探索肝癌相关侵袭、转移的潜在分子标志物,可为肝癌的治疗提供新的指导。
微小RNA(microRNA,miRNA)是一类长度约为21~25 个核苷酸的小分子RNA,参与转录后基因的调控。miRNA与肝癌的发生、侵袭、转移及预后密切相关。已有研究证实,miR-124在肝癌细胞系和肝细胞癌组织中表达量低[2],且过表达miR-124可抑制肝癌细胞的增殖[3]。caveolin-1是细胞膜内陷小窝的结构蛋白,在肿瘤细胞恶性增殖、分化、预后等方面发挥重要作用[4-5]。因此,阐明由miRNA调控caveolin-1的水平继而影响肝癌细胞恶性行为的分子生物学机制对肝癌临床诊疗尤为重要。
1 材料与方法
1.1 材料
1.1.1 实验对象 1)组织标本:收集2012年8月至2014年7月收治于大连医科大学附属第一医院的临床肝癌患者标本32例,术后半年进行随访用于临床5年预后分析。所用样本在取样前均与患者签署了知情同意书。所取肝癌组织经病理医生证实为肝细胞肝癌,癌旁组织取自距离肿瘤边缘3 cm以上处;2)细胞株:肝癌细胞高转移细胞株MHCC97H、肝癌细胞低转移细胞株MHCC97L 及人胚肾细胞株HEK 293T购自南京凯基生物有限公司。
1.1.2 主要试剂和仪器 胎牛血清、DMEM高糖培养基(美国Gibco 公司)、胰蛋白酶-EDTA 消化液(0.25%)、Trizol 试剂及LipofectamineTM2000 试剂盒(美国Invitrogen 公司);caveolin-1 pEGFP-N2 vector、miR-124 mimic/inhibitor、sicaveolin-1(广州锐博公司);双荧光素酶报告质粒pmirGLO(吉玛公司);CCK8 试剂(南京凯基公司);PVDF 膜(美国Pall 公司);多克隆抗体(武汉三鹰生物技术有限公司);ECL发光试剂盒及QuantiTect Reverse Transcription Kit(美国Thermal Fisher Scientific公司)。
1.2 方法
1.2.1 细胞培养和转染 将肝癌细胞株置于含有10%体积的热灭活胎牛血清、1%体积的青霉素(100µg/mL)、链霉素(100µg/mL),90%体积的DMEM培养基,在37℃、5%CO2、饱和湿度的CO2培养箱中培养。
取对数生长期的肝癌细胞,用胰酶消化后,将2 mL、密度为1×105个/mL 细胞悬液接种到6 孔板,培养24 h后,按照LipofectamineTM2000转染试剂说明书介绍的方法进行miR-124 inhibitor、miR-124 mimic、caveolin-1、sicaveolin-1等转染,48 h后置于荧光显微镜下观察细胞的转染效果。
1.2.2 RNA 提取和Real-time PCR 用Trizol 法提取人肝癌组织及肝癌细胞株中总RNA,紫外分光光度计检测RNA浓度和纯度。按反转录试剂盒说明书操作,反应体系为20 µL,在25℃反应5 min,在42℃反应60 min,在70℃反应5 min,将所提取RNA 反转录为cDNA。按照SYBR Premix Ex TaqⅡ加样体系,再对所得的DNA 进行实时定量PCR 扩增,反应体系总体积为25µL,分别在95℃预变性30 s,95℃变性5 s,60℃退火,72℃延伸30 s,共40 个扩增循环。采用2-△△CT计算miR-124和caveolin-1的相对表达量。
1.2.3 免疫印迹分析 提取总蛋白并测定浓度。煮沸变性的蛋白以每孔30µg的含量点样,经浓缩胶为6%、分离胶为12%SDS-聚丙烯酰胺凝胶(SDSPAGE)电泳分离。通过电转仪将凝胶上的蛋白样品移至PVDF 膜上,新鲜配制封闭液(5%脱脂奶粉)在37℃封闭2 h。分别加一抗caveolin-1(1:1 000)、内参GAPDH(1:2 500)4℃孵育过夜。以PBS洗膜3次,每次8 min。然后加二抗37℃孵育90 min,PBS 洗膜3次。避光配制发光液,将PVDF膜放置于LabWork 凝胶成像曝光室内,吸去膜表面多余水分,均匀将发光液淋于膜上后发光即可,记录实验结果。
1.2.4 双荧光素酶报告实验 为检测miR-124与caveolin-1的靶向结合关系,设计与miR-124 相结合的caveolin-1的3'-UTR序列以及突变序列,并分别将其构建到双荧光素酶报告基因载体pmirGLO上(此过程由上海吉玛公司合成)。取对数生长期的密度为5×104个HEK 293T 细胞接种于24 孔板,培养24 h 达到80%融合度后,向24 孔板中共同转染caveolin-1、miR-124及对照miR-NC 转染质粒,进行共转染。使用双荧光素酶检测试剂盒(Promega)分别检测萤火虫荧光素酶和海肾荧光素酶的活性。
1.2.5 CCK8 细胞增殖实验 为检测不同肝癌细胞的体外增殖能力,取对数生长期的肝癌细胞(1×103个/孔)接种于96 孔板,每孔添加100 µL 培养液,在37℃、5%CO2的湿润环境下,分别培养0、24、48、72、96 h 后,向各孔内加入11µL CCK8 反应液。4 h 后,用酶标仪在450 nm处检测各实验孔吸光度。
1.2.6 平板克隆实验 收集肝癌细胞,并制备成单细胞悬液;将1×103个细胞接种于6孔板中,充分吹打成单细胞悬液。置于37℃、5%CO2的培养箱中培养12 d,每隔3天更换一次培养基;取出后经10%甲醛固定40 min后,滴加0.1%结晶紫染液室温染色20 min,PBS清洗数次并拍照。
1.2.7 细胞侵袭实验 将肝癌细胞加入到有8 µm ECMatrix 凝胶涂层的transwell 小室的上层中。在transwell小室的下层中,加入含有血清的细胞培养基,继续在37℃培养箱中培养细胞。培养24 h 后,取出transwell小室,用棉签轻轻擦去上层未转移细胞。以甲醇固定transwell小室下层的细胞,瑞氏-吉姆萨染色,在显微镜下观察侵袭的肝癌细胞,并计算百分比。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析。每组数据来自至少3个独立实验,数据用表示。采用t检验分析样本之间的差异。配对t检验用于肝癌和癌旁组织间数据的比较。以P<0.05为差异具有统计学意义。
2 结果
2.1 miR-124 和caveolin-1 在肝癌组织及细胞系中的表达
qRT-PCR分析显示,miR-124在癌组织中的相对表达量(7.72±1.05)明显低于癌旁组织(14.03±1.39,t=4.546,P<0.00 1);miR-124在MHCC97H细胞中的相对表达量(1.00)低于MHCC97L细胞的相对表达量(3.11±0.72,t=8.713,P=0.013)。而caveolin-1的表达呈相反的趋势,qRT-PCR结果显示,肝癌组织中caveolin-1水平(12.21±1.21)明显高于癌旁组织(8.06±1.29,t=3.345,P<0.001);MHCC97H细胞中caveolin-1水平(1.00)明显高于MHCC97L细胞(0.38±0.09,t=16.46,P=0.004)。miR-124和caveolin-1的表达与32例肝癌患者临床病理参数的相关性见表1。
2.2 caveolin-1与miR-124的关系
通过生物信息学分析,caveolin-1 可能是miR-124 的潜在靶标。为了证实miR-124 能够与caveolin-1的3'-UTR结合,本研究进行双荧光素酶报告基因实验。结果显示,caveolin-1 与miR-124 存在靶向调控关系(t=18.62,P<0.001,图1A)。特异性上调MHCC97H 细 胞 中miR-124 的 表 达,caveolin-1 的mRNA 和蛋白水平均表达下调(t=9.031,P=0.012,图1B);特异性下调MHCC97L细胞中miR-124水平,caveolin-1 在mRNA 和蛋白水平较对照组显著上调(t=4.468,P=0.047,图1C)。
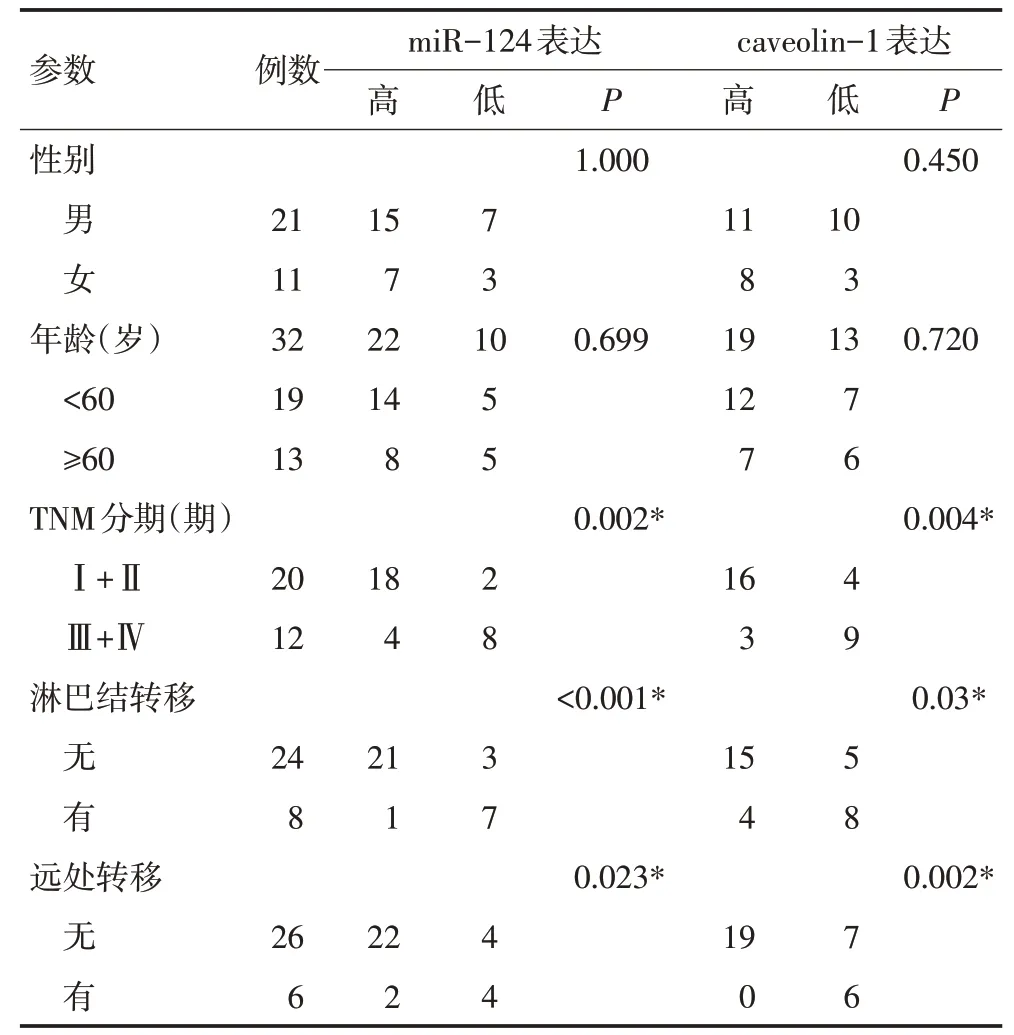
表1 肝癌患者miR-124、caveolin-1表达水平与临床病理特征的关系
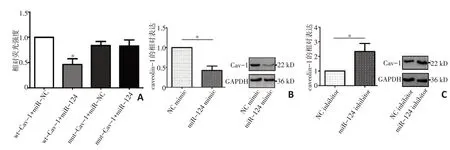
图1 caveolin-1与miR-124的关系
2.3 miR-124 通过靶向调控caveolin-1 介导肝癌细胞的增殖及侵袭
CCK8 分析显示,MHCC97H 细胞转染miR-124 mimic,96 h后,与对照组(OD=1.54±0.12)相比该细胞的增殖能力被抑制(OD=1.0±0.09,NC mimicvs.miR-124 mimic,t=3.279,P=0.035);MHCC97H细胞共转染miR-124 mimic 和caveolin-1,96 h 后,与miR-124 mimic 组相比,该细胞的增殖能力增强(OD=1.44±0.08,miR-124 mimicvs. miR-124 mimic+caveolin-1,t=3.436,P=0.040)。平板克隆实验也显示出相同的趋势(NC mimic 组克隆数:672±61;miR-124 mimic组克隆数:209±32;miR-124 mimic+caveolin-1 组克隆数:475±56)。Transwell 结果显示,MHCC97H 细胞转染miR-124 mimic 后,与对照组(侵袭细胞数:41±8)相比,该细胞的侵袭能力下降(侵袭细胞数:17±3),共转染miR-124 mimic和caveolin-1后,MHCC97H细胞的侵袭能力增强(侵袭细胞数:29±5)。
MHCC97L 细胞被转入miR-124 inhibitor,96 h后,与对照组(OD=1.16±0.17)相比该细胞的增殖能力增强(OD=1.63±0.18,NC inhibitorvs. miR-124 inhibitor,t=3.469,P=0.026);MHCC97L细胞中共转染miR-124 inhibitor和siCaveolin-1,96 h后,该细胞的增殖及侵袭能力受到抑制(OD=1.23±0.16,miR-124 inhibitorvs. miR-124 inhibitor+sicaveolin-1,t=2.896,P=0.044)。平板克隆实验也显示了相同的趋势(NC inhibitor 组克隆数:249±33;miR-124 inhibitor 组克隆数:954±98;miR-124 inhibitor+sicaveolin-1 组克隆数:260±42)。Transwell 结果显示,MHCC97L 细胞转染miR-124 inhibitor后,与对照组(侵袭细胞数:35±6)相比,该细胞的侵袭能力增强(侵袭细胞数:54±8),共转染miR-124 inhibitor和sicaveolin-1后,MHCC97L细胞的侵袭能力下降(侵袭细胞数:33±5)。
2.4 miR-124 和caveolin-1 与临床肝癌患者预后的相关性
采用Kaplan-Meier 法分析miR-124、caveolin-1表达与临床肝癌患者5年生存率的关系。结果显示,肝癌患者中miR-124 低水平组的总生存期低于高水平组(χ2=11.85,P<0.001),miR-124 低水平组5年生存率为20%,高水平组5年生存率为81.81%。高水平caveolin-1肝癌患者5年生存率低于低水平caveolin-1肝癌患者(χ2=8.79,P=0.013),高水平caveolin-1组5年生存率为42.11%,低水平组5年生存率为76.92%。
3 讨论
miRNA 是一类非编码单链的RNA,通常在转录后水平调控基因表达。异常miR-7 通过靶向调控PI3K/Akt 通路,可抑制肝癌细胞的生长及转移过程[6]。miR-26a 能够通过抑制血管生成而延缓肝癌恶性进展[7]。上述研究均证实,调控性miRNA 在肝癌进展中可能发挥重要作用。本研究发现与癌旁组织和低转移肝癌细胞中相比,miR-124在肝癌组织及高转移肝癌细胞中呈低表达,提示miR-124为一类可抑制肝癌恶性进展的重要分子。caveolin-1是一种细胞表面的穴样内陷(caveolae)中的主要膜内在蛋白,参与调控胆固醇转运、细胞内吞以及肿瘤转移等重要生物学过程[8]。本研究检测了caveolin-1 水平,发现其相比于癌旁组织和低转移肝癌细胞,在肝癌组织及高转移性肝癌细胞中呈较高水平。这个结果提示异常的miR-124 和caveolin-1 水平可能与肝癌的发生、发展密切相关。
miRNA 常常结合到靶基因的3'-UTR 区而抑制靶基因功能的发挥[2]。已有文献证实miR-124 能够通过调控BIRC3 表达介导肝癌进展[9]。通过双荧光素酶报告实验,证实了生物信息学预测结果,miR-124通过靶向调控caveolin-1介导肝癌细胞恶性行为的发生。特异性改变肝癌细胞中的miR-124水平,能够显著影响细胞中caveolin-1表达。miR-124参与到肝癌及乳腺癌的恶性生物学行为[9-10]。在本研究中,调控肝癌细胞中miR-124的水平,可显著影响肝癌细胞恶性行为。当共调控细胞中的miR-124 和caveolin-1 后,该细胞的增殖及侵袭能力同样被调控。此外,又进一步分析miR-124 及caveolin-1 是否可作为肝癌预后的独立预测分子。根据对临床患者生存跟踪分析,发现miR-124 和caveolin-1 均可作为潜在的判断肝癌预后的分子标志物。
综上所述,miR-124可能通过靶向调控caveolin-1介导肝癌细胞的恶性行为,本研究旨在为肝癌的诊断及治疗监测寻找潜在的靶标。

