线粒体自噬在肿瘤干细胞中作用的研究进展*
黄基峰 张怡 晏琛
肿瘤干细胞(cancer stem cells,CSCs)是肿瘤细胞中的一群特殊细胞,具有自我复制、多细胞分化和治疗的抵抗能力[1]。CSCs被认为是肿瘤治疗失败、复发及转移的关键原因。自噬是将细胞内受损、变性或衰老的蛋白质以及细胞器运输到溶酶体进行降解的生理过程,在肿瘤的发生发展中起到重要作用[2]。线粒体自噬是一种靶向线粒体的选择性自噬,在维持线粒体稳态中起到重要作用。线粒体自噬是细胞分化过程中的一个固有组成部分,如从受精卵中去除父系线粒体,以及在红细胞成熟和肌肉分化过程中去除多余的线粒体[3]。此外,线粒体自噬还被认为是干细胞分化及细胞重编程的关键调控因素[4]。
异常的线粒体自噬可以导致细胞代谢、细胞分化、炎症调控及DNA损伤修复等生理活动紊乱,上述均与肿瘤的发生和进展密切相关[3]。线粒体自噬一方面可以通过清除受损的线粒体发挥肿瘤抑制作用,另一方面还可以促进肿瘤的存活与治疗抵抗[1,5]。线粒体自噬在CSCs中起到重要调控作用,本文旨在介绍线粒体自噬在CSCs中发挥的作用及其潜在机制。
1 线粒体自噬的启动与调节
线粒体是调节哺乳动物细胞能量代谢、细胞信号和细胞凋亡的重要细胞器[6]。为了维持细胞内稳态,细胞已经进化出复杂的线粒体质量控制系统[6]。线粒体自噬作为线粒体质量控制系统中的一项重要机制,可以通过选择性自噬降解过多或受损的线粒体,以应对各种刺激[7]。自噬是一种重要的分解代谢途径,其降解溶酶体中的蛋白质或其他细胞成分。与传统的非选择自噬不同,线粒体自噬选择性地靶向由线粒体自噬受体标记的线粒体(图1)。这些受体系统主要包括Parkin/PINK1受体系统、微管相关蛋白I轻链3(microtubuleassociated protein 1 light chain 3,LC3)相互作用区(LC3 interaction region,LIR)受体系统(如BNIP3、BNIP3L、FUNDC1)和脂质介导系统(如神经酰胺)[4,7]。

图1 线粒体自噬过程的模式
1.1 Parkin/PINK1
PINK1作为一种丝氨酸/苏氨酸激酶,是目前研究最为广泛的一种线粒体自噬受体蛋白[1]。PINK1在维持线粒体形态、功能以及对受损线粒体的选择性降解中发挥重要作用[8-9]。当线粒体受损时,PINK1积聚在线粒体表面,并将E3泛素连接酶Parkin磷酸化后招募到去极化的线粒体外膜(outer mitochondrial membrane,OMM),OMM上的几种蛋白通过泛素化启动线粒体自噬,泛素化的外膜蛋白募集衔接蛋白并与LC3家族蛋白结合以完成线粒体自噬[8,10]。健康的线粒体可以通过PINK1降解机制避免线粒体自噬启动[11]。目前,已知Parkin由PARK2基因编码,PINK1由PARK6基因编码,其表达受到多种基因产物的调控,具体调控途径仍有待进一步研究[8]。
1.2 BNIP3/BNIP3L
BNIP3、BNIP3L 均属于Bcl-2 蛋白家族成员,是仅含有BH-3 结构域的BH3-only 亚族,介导不依赖PINK1的线粒体自噬[12]。BNIP3 及BNIP3L 为低氧诱导的尾部锚定蛋白,通过羧基末端跨膜区整合入OMM,并将氨基末端延伸到胞质中与LC3 家族蛋白相互作用[3]。在缺氧条件下,缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)可以上调BNIP3及BNIP3L的表达水平,此外P53也能够直接激活BNIP3及BNIP3L表达,进而启动线粒体自噬[13-14]。
1.3 FUNDC1
FUNDC1 为另一种被缺氧激活的线粒体自噬受体蛋白,其是一个定位于线粒体外膜上的三次跨膜蛋白。在低氧刺激下,FUNDC1通过LIR结构域与活化后的LC3相互作用,随后募集自噬体包裹被标记的线粒体,进而调控线粒体自噬。研究表明,FUNDC1与动力相关蛋白1(dynamin-related protein-1,Drp-1)之间的相互作用对缺氧诱导的线粒体自噬至关重要,通过阻断FUNDC1 与Drp-1 相互作用可抑制FUNDC1 诱导的线粒体自噬[3,15]。此外,FUNDC1 对线粒体自噬的调控还受到LIR 结构与周围氨基酸残基磷酸化的严格调节[3,15]。
2 线粒体自噬的生物学作用
线粒体自噬与各种生理过程和疾病有因果关系,参与到心肌缺血损伤、帕金森病、衰老和记忆性自然杀伤细胞的存活等生理病理过程[8,10,16-17]。研究表明,BNIP3介导的线粒体自噬可以通过清除受损的线粒体,对肾脏和心脏缺血再灌注损伤起到保护作用[16,18]。FUNDC1 也可在局部缺血的组织(如心脏)中被激活并介导线粒体自噬,从而避免缺血缺氧应激诱发的细胞凋亡[19]。BNIP3L介导的线粒体自噬是维持红细胞数量和红细胞成熟末期清除线粒体所必需的[20]。研究表明,PINK1及Parkin基因突变导致的线粒体损伤与帕金森病发病有关[8]。此外,抑制PINK1 介导的线粒体自噬可以显著降低干细胞重编程的效率[1],敲除造血干细胞(hemopoietic stem cell,HSC)中PINK1基因的表达会抑制其介导的线粒体自噬从而损害HSC的自我更新能力[11]。
3 线粒体自噬在CSCs中的作用
在肿瘤的发生和进展中,线粒体的调控起到重要作用[21]。作为线粒体质量控制的重要机制,线粒体自噬在肿瘤发生的早期发挥着抑癌作用,然而在已经形成的肿瘤中又可以起到促癌作用[22]。如缺少BNIP3 介导的线粒体自噬会引起受损线粒体积聚、ROS产生过多,最终导致乳腺癌的进展[23]。但也有研究表明,低氧情况下食管鳞状细胞癌细胞中BNIP3表达上调并诱导保护性线粒体自噬[1];肝癌细胞中BNIP3 介导的线粒体自噬起到抗凋亡的促癌作用[24]。虽然近年来越来越多的研究表明线粒体自噬在肿瘤中具有促癌作用,但是针对肿瘤中的特殊群体—CSCs,线粒体自噬发挥作用的具体机制仍有待进一步阐明(图2)。
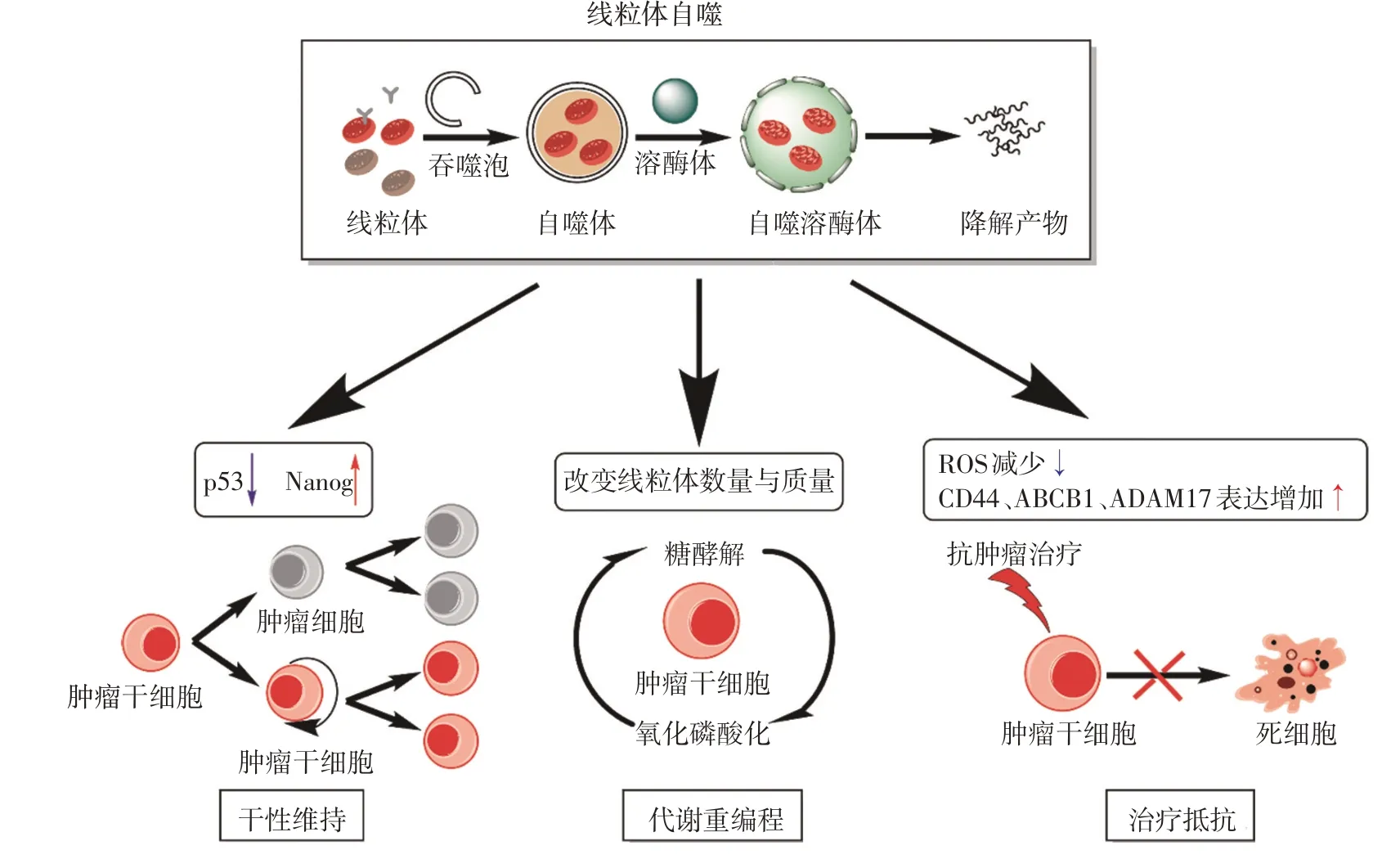
图2 线粒体自噬在肿瘤干细胞中的作用模式
3.1 线粒体自噬与CSCs的干性维持
CSCs被认为是具有干细胞特性(干性)的一类肿瘤细胞,在维持CSCs 的干性中线粒体自噬起到重要作用[25]。如在脑CSCs的干性维持中,脑CSCs通过激活细胞周期素依赖蛋白激酶5(cyclin-dependent kinase 5,CDK5)依赖的线粒体Drp-1 来促进线粒体自噬。线粒体自噬通过清除损伤线粒体、减少细胞死亡,维持脑CSCs 的自我更新和生长[26]。在急性髓系白血病(acute myeloid leukemia,AML)中,线粒体自噬具有维持白血病干细胞(leukemia stem cells,LSCs)干性的促癌作用[27]。通过线粒体自噬,LSCs 获得更低的能量代谢率和ROS 生成量。研究表明,LSCs 通过调控AMP 依赖的蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)途径增加与线粒体裂变相关的线粒体裂变1蛋白(mitochondrial fission 1 protein,FIS1)的表达[27-28]。阻断FIS1基因表达可抑制糖原合成激酶-3β(glycogen synthetase kinase-3β,GSK-3β)活性进而阻断线粒体自噬途径,这使得LSCs 逐渐丧失干性[27],使用GSK-3β 抑制剂靶向AMPK/FIS1/GSK-3β 介导的线粒体自噬轴有可能成为AML根治的策略。
还有研究表明,在肿瘤形成之前,线粒体自噬对正常干细胞可以起到抑癌作用,线粒体自噬缺失导致肝干细胞向CSCs的恶性转变[29-30]。自噬缺失导致肝干细胞功能缺陷,增加受损线粒体和线粒体ROS的积累、抑制DNA的同源重组损伤修复途径,肝干细胞进而发生恶变[30]。但在肿瘤CSCs形成之后,肝CSCs中线粒体自噬可清除与线粒体共定位的抑癌基因p53,阻止磷酸化的p53与转录因子Nanog的启动子结合,Nanog结合转录因子Oct4和Sox2后正常表达,使得肿瘤干细胞维持自行更新能力,从而维持肝CSCs的增殖[1]。线粒体自噬对肝CSCs的促癌作用是p53依赖性的,在p53缺失的肝CSCs中并无类似改变[1,31]。
在CSCs的干性维持过程中,线粒体自噬起到了降解受损线粒体、降低细胞内ROS水平、降解清除线粒体上的抑癌基因等促癌作用。CSCs的干性维持使得肿瘤细胞保存了自我更新与增殖分化能力,促进了肿瘤的进展。同时,研究表明线粒体分裂相关的Drp1和F1S1蛋白参与了线粒体自噬的调控,线粒体动力学的改变在线粒体自噬调控中也发挥重要作用。
3.2 线粒体自噬与CSCs的代谢重编程
线粒体是细胞内的能量代谢工厂,具有产生能量及合成生物分子等功能[6]。研究表明,通过调节线粒体数量与活性进行代谢重编程是CSCs的一个关键特征,此过程调控了CSCs的干性、治疗抵抗以及侵袭转移等能力[6,32]。与正常干细胞依赖氧化磷酸化(oxidative phosphorylation,OXPHOS)作为主要能量来源不同,CSCs 表现出独特的代谢可塑性,即CSCs 可以在OXPHOS 和糖酵解两种代谢表型之间切换,以维持干性、促进肿瘤的生长[33]。在这一过程中,CSCs可能根据细胞生存需求,通过线粒体自噬进行代谢重塑并转化成糖酵解或OXPHOS 表型,完成代谢重编程,进而促进肿瘤进展[4]。
二氯乙酸(dichloroacetate,DCA)是一种已知的抗肿瘤药物,通过抑制丙酮酸脱氢酶激酶将细胞代谢从无氧糖酵解转化为OXPHOS,CSCs 对DCA 的处理相比普通肿瘤细胞更为敏感[34]。DCA处理促进丙酮酸转化为乙酰辅酶A,后者进入三羧酸循环并为线粒体氧化磷酸化提供燃料,随着丙酮酸氧化增强,ROS的产生增多并为线粒体呼吸链转移更多还原当量,形成恶性循环[34]。显著上升的ROS水平伴随着线粒体自噬标记物LC3B-Ⅱ(microtubule-associated protein 1 light chain 3B-Ⅱ)的上调,表明线粒体自噬参与对抗DCA 的CSCs 毒性作用之中。线粒体自噬作为线粒体质量控制方式之一,很可能参与CSCs 对代谢变化的代偿,并保护CSCs 适应代谢转变[34],促进CSCs 存活。线粒体自噬与CSCs 代谢之间的相互影响机制亟需更多研究,通过调控线粒体自噬,有望将调控CSCs代谢作为治疗CSCs的新策略。
3.3 线粒体自噬与CSCs的治疗抵抗
CSCs 被认为是肿瘤的治疗抵抗关键因素之一[2]。研究表明,LSCs 对传统化疗药物存在耐药性,存活的LSCs 为AML 复发的常见原因[27]。线粒体自噬在化疗过程中往往起到细胞保护作用,因此可能成为针对CSCs耐药性的潜在靶点。采用抗肿瘤药物阿霉素刺激大肠癌细胞后,大肠CSCs 中线粒体自噬水平显著上升,而抑制线粒体自噬后可增强阿霉素的敏感性[35]。在化疗过程中,线粒体自噬可帮助CSCs 抵抗由化疗药物导致的细胞凋亡,进而产生化疗耐药性。逆转这一保护机制,可能成为解决CSCs化疗耐药性的途径之一。
还有研究表明,口腔鳞状细胞CSCs 中升高的线粒体自噬水平与对顺铂耐药呈正相关[36-37]。顺铂刺激后产生的耐药FaDu 细胞具有干细胞样特征,在这种肿瘤细胞中观察到较高的自噬通量与线粒体自噬水平,并且这些细胞还高表达CD44、多药耐药性蛋白ABCB1(ATP-binding cassette subfamily B member 1)和解聚素金属酶蛋白17(a disintegrin and metalloprotease 17,ADAM17)[36]。而抑制线粒体自噬导致CSCs干性的丧失及CD44、ABCB1 和ADAM17 的表达降低[36]。上述研究提示,增强的线粒体自噬可通过借助耐药相关蛋白的表达来维持CSCs 的存活,从而促进肿瘤的化疗耐药性形成。
4 展望
CSCs的治疗抵抗以及肿瘤复发为肿瘤治疗中的难点。在CSCs中线粒体自噬发挥促进干性维持、代谢重编程及治疗抵抗等多种作用。因此,在肿瘤中使用靶向调控线粒体自噬的药物可能是改善CSCs治疗抵抗性并清除CSCs的治疗手段。在今后的研究中,需要对线粒体自噬在CSCs起源和治疗抵抗性中的可能机制进行更为深入的研究。

