吲哚菁绿荧光成像在全腹腔镜远端胃癌根治术中的应用*
刘茂兴 邢加迪 徐凯 谭非 杨宏 张成海 张楠 王早早 崔明 苏向前
中国胃癌发病率及死亡率在所有恶性肿瘤中均居前列,每年新发病例占全球的43.9%,其中约90%的患者为进展期[1]。随着内镜检查的普及,早期胃癌的检出率逐年增加。胃癌的病死率与疾病分期密切相关,ⅢB 及Ⅳ期胃癌5年生存率分别为34.8%和16.4%,而早期胃癌5年生存率可超过90%,甚至达到治愈效果[2]。对于进展期胃癌,彻底的淋巴结清扫、安全的手术切缘影响患者的预后。需要手术切除的早期胃癌患者,在保证肿瘤治疗效果的同时更要重视功能的保护从而改善生存质量[3-4]。随着微创外科理念深入人心,近年来全腹腔镜胃癌根治术逐渐推广普及,更多的胃癌患者选择腹腔镜手术方式[5]。在腹腔镜手术中由于缺少手的触觉,对肿瘤的定位远不及开腹手术精确,尤其对于T1~2期胃癌患者,肿瘤未侵及浆膜,单纯依靠肉眼对肿瘤定位更加困难。研究发现术前胃镜纳米碳标记可实现腔镜下肿瘤的精准定位,其淋巴引流示踪可指导胃癌根治术中淋巴结清扫过程,显著提高了淋巴结清扫数量与完整率。然而术前内镜下应用纳米碳标记,一旦刺穿浆膜,会导致腔镜下手术野模糊,无法清晰分辨层次结构,不仅无法定位肿瘤、示踪淋巴结,还会显著增加手术难度[6]。因此,临床上亟待一种高效、便捷的示踪技术,可以帮助术中明确病灶空间位置,判断胃切除线,并使术者可以清楚地对肿瘤周围淋巴组织进行实时、准确定位。近年来吲哚菁绿(indocyanine green,ICG)荧光显像技术逐渐被应用于临床[7]。本研究旨在系统探讨术前胃镜下ICG 标记在近红外荧光腹腔镜远端胃癌根治术中的肿瘤定位作用及淋巴引流导航效果,对该技术应用价值进行较全面地评估与探究。
1 材料与方法
1.1 一般资料
回顾性分析2017年8月至2019年8月北京大学肿瘤医院由同一组外科医生成功完成全腹腔镜远端胃切除术+D2淋巴结清扫的胃腺癌患者134例,收集临床病理资料及手术相关指标。排除术前接受新辅助治疗,多发肿瘤,美国东部肿瘤协作组(ECOG)评分>1分或美国麻醉医师协会(ASA)分级>2级的患者。根据上述标准,共126例患者纳入本研究,其中62例在ICG标记近红外荧光全腹腔镜下完成远端胃癌根治术(观察组),64例行常规全腹腔镜手术(对照组)。
1.2 方法
1.2.1 ICG术前标记方法 ICG溶液配制及注射:1)将25 mg ICG溶于40 mL灭菌注射用水中(0.625 mg/mL),充分混匀。2)进镜后观察并记录肿瘤部位,首先于肿瘤边界与正常黏膜交界处分别选取口侧、肛侧及左右两侧4个象限,分别进行黏膜下注射生理盐水1~2 mL直至黏膜抬举充分。3)将注射针取出,排空管内液体,用注射器吸取2 mL ICG稀释液并充满整个注射针,在镜下分别注射于肿瘤的4个象限(建议在黏膜抬举充分部位注射),每点各注射0.5 mL。4)生理盐水冲洗注射区域,充分吸出残留液体后退镜。观察组T1~2期胃癌患者术前1~26 h、T3~4期胃癌患者于术前1天(20~30 h)在胃镜下行ICG溶液标记,标记前充分告知患者及家属,并签知情同意书。
1.2.2 手术方法 两组患者均行全腹腔镜远端胃癌根治术。观察组:近红外线腹腔镜(Pinpoint荧光腹腔镜,美国Stryker公司)梯度荧光模式下用划线笔标记红染区口侧缘,测量并记录红染区纵轴的最大径(d),距红染区口侧缘(5-d/2)cm进行胃切除,距离幽门2~3 cm离断十二指肠球部。对照组:行术中内镜检查,在腹腔镜监视下定位肿瘤边缘并于浆膜面标记,距离标记处5 cm进行胃切除,距离幽门2~3 cm离断十二指肠球部。淋巴结清扫过程中不断切换近荧光腹腔镜自然光模式与绿色荧光模式及梯度荧光模式,将荧光显影的淋巴结、明显肿大但不显影的淋巴结及其所在组别内的全部淋巴结彻底清扫。切除标本后切缘均送快速病理检查,以判断远、近切缘是否阴性。
1.2.3 标本处理方法 两组标本均由专人取材,其中观察组在腹腔镜荧光梯度模式下取材。充分展平标本,正反面拍照并测量肿瘤与切缘的距离,标记红染区纵轴中点并判断与肿瘤边界的关系。严格按照第4版《日本胃癌治疗指南》进行淋巴结分检,标明所分拣淋巴结所属组别及站别(第一站1、3、4sb、4d、5、6、7 组;第二站8、9、11p、12a 组)[8],根据术中清扫过程及标本完整情况进一步判断淋巴结的完整性,破损淋巴结专门记录组别及枚数,分别按组别送常规石蜡病理检查。
1.3 统计学分析
采用SPSS 22.0 软件进行统计学分析,连续变量资料采用进行记录,采用独立样本t检验进行比较;分类变量采用数量的形式进行记录,采用χ2检验及Fisher 精确检验进行比较。以P<0.05 为差异具有统计学意义。
2 结果
2.1 手术情况
观察组T1~2期胃癌患者40例,对照组T1~2期胃癌患者38 例,两组患者临床资料差异无统计学意义(P>0.05,表1)。两组患者均顺利完成全腹腔镜远端胃癌根治术。观察组中3例患者出现术后并发症,其中胃排空障碍1 例,胰腺炎1 例,术后出血1 例,均经保守治疗康复。对照组中4 例患者出现术后并发症,其中吻合口漏合并腹腔感染1例,术后腹腔出血1例均经二次手术治疗康复;肺部感染1 例,淋巴漏1例,均经保守治疗康复。两组术后并发症发生率差异无统计学意义(P=0.509,表2)。
观察组T3~4期患者22例,对照组T3~4期患者26 例,两组患者临床资料差异无统计学意义(P>0.05,表3)。两组患者均顺利完成全腹腔镜远端胃癌根治术,无中转开腹。观察组中术后出现胃排空障碍1例,对照组中肺部感染1例,淋巴漏1例。两组并发症患者均经保守治疗康复。两组术后并发症发生率差异无统计学意义(P=0.906,表4)。
表1 两组T1~2期患者临床资料的比较 (±s)
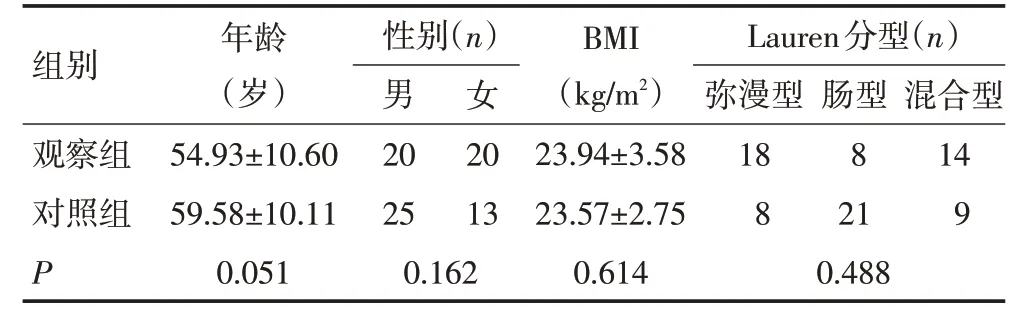
表1 两组T1~2期患者临床资料的比较 (±s)
组别观察组对照组P年龄(岁)54.93±10.60 59.58±10.11 0.051性别(n)男20 25 0.162女20 13 BMI(kg/m2)23.94±3.58 23.57±2.75 0.614 Lauren分型(n)弥漫型18 8 0.488肠型8 21混合型14 9
表2 两组T1~2期患者手术情况的比较 (±s)

表2 两组T1~2期患者手术情况的比较 (±s)
组别观察组对照组P手术时间(min)226.30±57.21 246.50±52.46 0.109术中出血量(mL)34.50±17.09 41.58±26.77 0.166并发症(n)3 4 0.509首次排气时间(d)3.03±0.80 3.03±0.68 0.994首次进食时间(d)6.95±2.21 6.26±0.45 0.064术后住院时间(d)8.10±2.30 8.37±6.95 0.818
表3 两组T3~4期患者临床资料的比较 (±s)
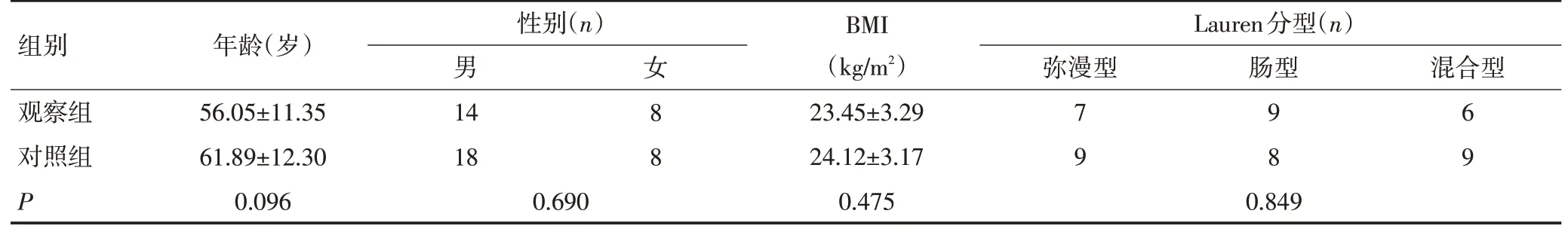
表3 两组T3~4期患者临床资料的比较 (±s)
组别观察组对照组P年龄(岁)56.05±11.35 61.89±12.30 0.096性别(n)男14 18 0.690女 8 8 BMI(kg/m2)23.45±3.29 24.12±3.17 0.475 Lauren分型(n)弥漫型7 9 0.849肠型9 8混合型6 9
表4 两组T3~4期患者手术情况的比较 (±s)

表4 两组T3~4期患者手术情况的比较 (±s)
组别观察组对照组P手术时间(min)231.68±43.19 241.88±55.87 0.492术中出血量(mL)45.46±17.66 58.08±46.74 0.238并发症(n)1 2 0.906首次排气时间(d)3.09±0.68 2.89±0.65 0.291首次进食时间(d)7.46±4.07 6.39±0.64 0.192术后住院时间(d)7.64±1.18 7.42±0.86 0.472
2.2 ICG标记的肿瘤定位作用
观察组40 例T1~2 期胃癌患者均在内镜下顺利完成ICG标记,术中未发现刺穿浆膜导致ICG荧光弥散而标记失败病例,未发现不良反应及过敏病例。腹腔镜荧光模式下ICG由注射点向四周均匀扩散,梯度模式下红色荧光范围呈椭圆形,ICG注射点多位于红染中央部,见图1。术中、术后测量胃标本的浆膜层红色荧光边缘(术中标记线位置)至肿瘤边缘的距离(垂直于手术切线)并记录,见图2,3。两组78 例T1~2 期胃癌患者术中快速病理检查及术后常规病理检查均提示切缘阴性。术中标本测量近端切缘距离,观察组与对照组比较差异无统计学意义[(4.92±1.65)cmvs.(4.76±1.66)cm,P=0.671],见表5。

图1 注射点显影范围
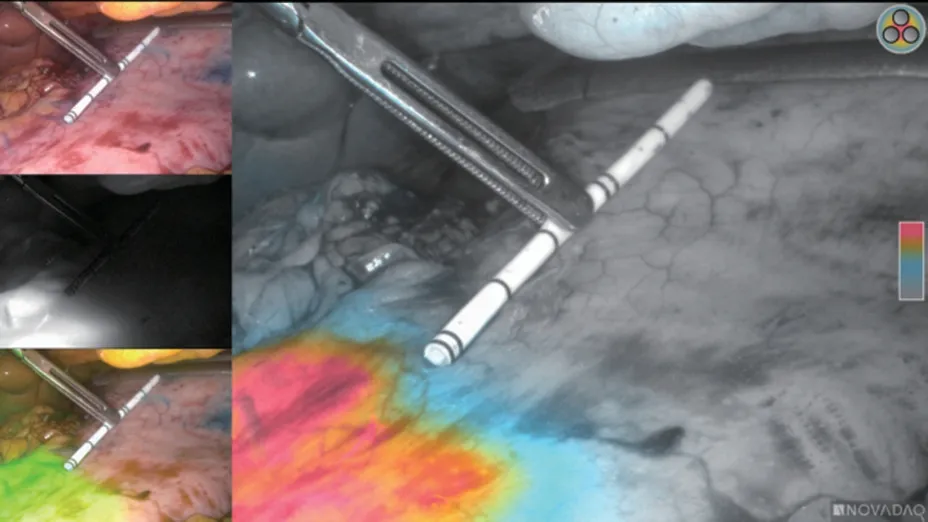
图2 荧光镜梯度模式下切除线测量

图3 荧光镜梯度模式下标本测量
2.3 ICG标记的淋巴结导航清扫作用
荧光腹腔镜在淋巴结清扫过程中可提供清晰的淋巴引流途径,并帮助辨别淋巴结与胰腺、血管等重要结构的关系,见图4,5。观察组22例T3~4期胃癌患者共检出淋巴结700 枚,对照组26 例共检出699枚。观察组平均清扫淋巴结数量略高于对照组(31.82 枚vs. 26.89 枚,P=0.055),两组检出阳性淋巴结数量差异无统计学意义(P=0.489)。两组第一站淋巴结清扫总数差异无统计学意义(P=0.157),观察组第二站平均清扫淋巴结数量高于对照组(11.09枚vs.8.89 枚,P=0.049);观察组破损淋巴结数量低于对照组,差异有统计学意义(P=0.009),见表6。
表5 两组T1~2期患者术后标本及切缘情况比较 (cm,±s)
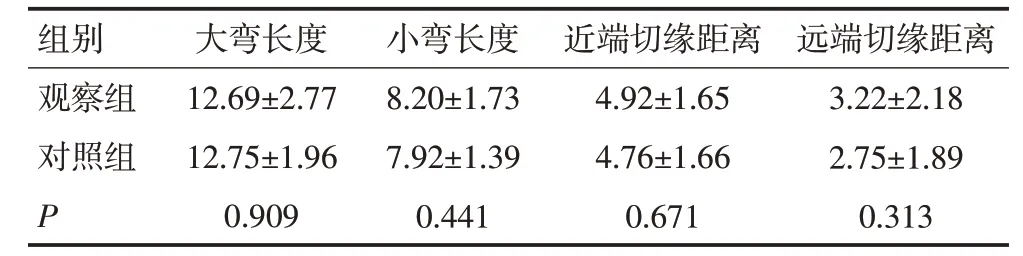
表5 两组T1~2期患者术后标本及切缘情况比较 (cm,±s)
组别观察组对照组P大弯长度12.69±2.77 12.75±1.96 0.909小弯长度8.20±1.73 7.92±1.39 0.441近端切缘距离4.92±1.65 4.76±1.66 0.671远端切缘距离3.22±2.18 2.75±1.89 0.313
表6 两组T3~4期患者术后标本及淋巴结检获情况比较 (枚,±s)

表6 两组T3~4期患者术后标本及淋巴结检获情况比较 (枚,±s)
组别观察组对照组P淋巴结总数31.82±10.32 26.89±6.92 0.055阳性淋巴结数4.50±3.09 4.42±4.00 0.489第一站淋巴结总数20.82±6.61 18.15±6.20 0.157阳性淋巴结3.66±2.59 3.55±3.23 0.542第二站淋巴结总数11.09±6.19 8.89±4.35 0.049阳性淋巴结0.96±0.55 1.23±0.81 0.422破损淋巴结数0.74±0.46 1.27±1.22 0.009

图4 荧光镜下淋巴结显影
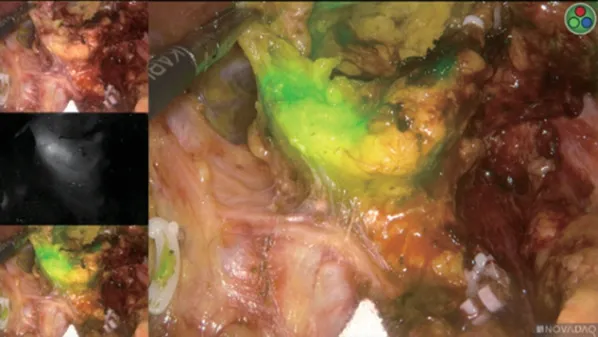
图5 荧光镜下淋巴结清扫
3 讨论
在开放手术中,尤其对于进展期胃癌,肿瘤的边界可通过肉眼以及手的触觉辨别出来。腹腔镜手术中对于分期较早、浆膜面完整的胃癌患者,肿瘤边界的准确定位较为困难。目前判断肿瘤边缘的方法包括术前胃镜下注射印度墨水、放置金属夹,术中胃镜检查等。其中胃镜下注射印度墨水最为常用,无需额外的设备且价格便宜。使用印度墨水时需要注入大量墨水以确保浆膜面可见,但经常引起术区模糊进而影响手术操作。术前内窥镜下置金属夹标记肿瘤边缘的方法需要术中超声检查或X射线检查,若金属夹子脱落移位或由于其他原因无法检测到,将导致定位失败[9]。最可靠的定位方法是术中胃镜检查,可以实时提示肿瘤的准备位置,但是需要内镜医生专门进入手术室操作,导致手术操作时间及麻醉时间明显延长。近年来ICG标记荧光腹腔镜系统开始应用于胃肠外科手术[10]。与印度墨水不同,胃壁的ICG荧光信号可以被近红外摄像机检测,不需要从胃的浆膜面肉眼见到染料。小剂量的ICG就可以实现定位显示的作用,从而避免注射过量引起的模糊显像[11-12]。
本研究所有患者均行全腹腔镜远端胃癌根治术,其中40例在荧光腹腔镜下完成手术,术后标本荧光镜下观察发现肿瘤边界多位于红色荧光核心部位,近端切缘距离为(4.92±1.65)cm,远端切缘距离为(3.22±2.18)cm。38 例患者在普通腹腔镜下完成手术,术中内镜下定位肿瘤的远近切缘,术后标本近端切缘距离为(4.76±1.66)cm,远端切缘距离为(2.75±1.89)cm,两组差异均无统计学意义,提示ICG标记肿瘤定位效果与术中内镜相当,腹腔镜手术中距ICG荧光核心口侧5 cm切断胃壁是安全、可行的。
本研究48 例T3~4 期的胃癌患者均行全腹腔镜远端胃癌D2淋巴结清扫术,其中22例在ICG 标记近红外线荧光腹腔镜下完成手术,26 例患者在普通腹腔镜下完成手术。ICG 组术中不断切换荧光及非荧光模式完成淋巴结清扫过程。荧光腹腔镜在淋巴结清扫过程中可提供清晰的淋巴引流途径,并帮助辨别淋巴结与胰腺、血管等重要结构的关系,避免破坏淋巴结完整性及损伤毗邻脏器。研究结果显示,ICG标记可显著提高淋巴结切除数量,尤其是第二站淋巴结的切除数量;ICG标记可清晰定位淋巴结部位及边界,减少术中淋巴结的破坏,显著提高区域淋巴结清扫的完整性。ICG 荧光显影下可观察淋巴管的走行,较为粗大的淋巴管(胰腺上缘区域,第8、9组淋巴结)可术中准确夹闭,从而减少术后淋巴漏的发生。研究发现术中在荧光模式下部分肿大淋巴结并未显像,然而这些肿大淋巴结中阳性比例较高,有国内研究也发现相同的情况,可能因引流至肿大淋巴结的淋巴管中存在癌栓,ICG无法引流至此所致[11]。因此在清扫淋巴结过程中,ICG示踪只能用于指导和辅助淋巴结的清扫,而不能单纯依赖淋巴结是否显影决定清扫范围。腹腔镜胃癌根治术中应用ICG 具有与传统腹腔镜胃癌根治术相似的近期疗效和术后并发症发生率,且能够获取更多的淋巴结数目,其优势除术中引导淋巴结清扫外,还能通过显影清扫范围内残留淋巴结的数目来评估术者淋巴结清扫的彻底性,尽管目前鲜见相关研究表明ICG显影的淋巴结与转移是否存在关联,也缺乏证据显示ICG荧光成像是否会增加转移淋巴结的检出数目,但淋巴结清扫数目的增加有可能改善胃癌患者远期预后[13]。
综上所述,ICG标记的荧光腹腔镜应用于胃癌的全腹腔镜手术治疗,可以帮助准确定位肿瘤边界,确定胃部安全切除线。同时可以清楚显示淋巴结位置及淋巴管走行,可显著增加进展期胃癌淋巴结清扫数量尤其是第二站淋巴结,并减少术中淋巴结的破坏。ICG 荧光标记技术应用于全腹腔镜胃癌手术值得深入研究并进一步推广。

