肺保护性通气降低高原地区全麻患者肺损伤的临床分析
张 铮, 格桑罗布, 边巴旺堆, 陈 琦
1. 上海和睦家医院麻醉科,上海 200335 2. 西藏自治区日喀则市人民医院麻醉科,日喀则 857000 3. 上海交通大学医学院附属新华医院麻醉与重症医学科,上海 200092
据统计,全世界每年的全麻手术量超过3亿次,机械通气诱发的急性肺损伤是患者全麻术后肺部并发症(postoperative pulmonary complications, PPCs)高发的重要原因。全麻手术有2%~19%的患者发生PPCs[1],PPCs直接影响外科手术患者预后,是导致患者ICU住院时间和总住院时间延长的重要原因[2]。术中肺保护性通气策略(lung protective ventilation strategy, LPVS)最早应用于ICU危重患者,以改善急性肺损伤和急性呼吸窘迫综合征患者的预后。目前研究[3-4]认为,术中使用小潮气量(VT 6 mL/kg)、呼气末正压通气辅之以规律的肺复张,可改善肺顺应性及氧合功能,降低围术期肺损伤程度及PPCs的发生率。高原地区患者因长期处于缺氧环境,肺血管和组织结构均发生适应性的改变[5],目前对高原地区患者肺保护通气策略的研究较少。本研究将保护性肺通气策略用于高原患者机械通气,观察肺保护通气策略是否适用于高原地区患者,降低高原患者机械通气诱发的肺损伤。
1 资料与方法
1.1 一般资料 选取120例患者纳入本随机、前瞻、双盲的临床对照研究。纳入标准:年龄21~49岁;体质指数(BMI)18~24 kg/m2;美国麻醉师协会(American Society of Anesthesiologists, ASA)分级Ⅰ或Ⅱ级的择期上腹部手术患者,术前FEV1/FVC>83%,心功能Ⅰ或Ⅱ级,预计手术时间2~3 h。排除标准:患有严重心血管疾病、心肺功能异常、哮喘、精神疾病、听力障碍者;躯干严重畸形,如脊柱侧弯、胸廓畸形及胸腔内疾病(如纵隔肿瘤、胸部肿瘤等);围术期大出血(出血量>800 mL)、术后再次行急诊手术、手术时间小于2 h或大于4 h;急性上呼吸道感染、慢性阻塞性肺疾病急性发作期;术前2周内接受过机械通气治疗;严重的神经肌肉性疾病;术后需转入ICU以及正在参加其他临床干预试验;患者及家属拒绝。本研究获本院伦理委员会批准(2020RKZRMYYLL003),患者及家属签署知情同意书。
1.2 随机分组 采用随机数字法,将患者随机分为2 组,即对照组(CV组) 和保护性通气组(PV组),每组60例。CV 组为潮气量10 mL/kg,术中的吸入氧浓度60%,术中无PEEP和肺复张,通气频率12 次/ min,吸呼比1∶2;PV 组为潮气量6 mL/kg,术中的吸入氧浓度60%,通气频率12 次/min,吸呼比1∶2,PEEP 6 cmH2O,每30 min进行一次肺复张。肺复张采用持续肺充气法(sustained insufflation, SI),在3~5 s内将平均气道压升高到30~40 cmH2O,持续15~30 s后,再恢复到实施SI之前的压力水平。
1.3 麻醉方法 入手术室后连续监测SpO2、心电图(ECG)、麻醉深度(BIS)、肌松监测等生命体征指标,桡动脉穿刺置管监测并采血样行血气分析。麻醉诱导:静脉注射咪达唑0.04 mg/kg,芬太尼2 μg/kg,丙泊酚1~2 mg/kg,顺式阿曲库铵0.2 mg/kg,待患者BIS值<45,TOF T4/T1<25%时行气管插管,连接麻醉呼吸机行容量控制机械通气。麻醉维持:静脉泵注丙泊酚每小时3~6 mg/kg,顺式阿曲库铵每分钟2~3 μg/kg,每分钟瑞芬太尼0.05~0.2 μg/kg,术中维持BIS 指数在40~50。术毕患者拔管入麻醉后监护室(PACU)。
1.4 观察指标
1.4.1 一般情况 术前记录患者的年龄、性别及BMI。询问心血管病史、吸烟史,记录患者手术中的输液量、失血量、尿量、机械通气时间以及术后住院时间。
1.4.2 术中相关肺功能指标 分别于麻醉诱导插管后5 min(T1)、机械通气后1 h(T2) 、术毕拔管前(T3)记录气道峰压(Ppeak),计算肺顺应性[Cdyn=VT/(Ppeak-Peep)]、计算肺氧合指数(OI=PaO2/FiO2)、肺泡-动脉血氧分压差(A-aDO2)、氧合指数(PaO2/FiO2),记录患者的平均动脉压(MAP)、心率(HR)、SpO2。
1.4.3 血气分析 分别于麻醉诱导插管后5 min (T1)、机械通气后1 h(T2) 、术毕拔管前(T3)抽取患者桡动脉血行血气分析,记录氧分压(PaO2)、二氧化碳分压(PaCO2),计算肺血分流率Qs/Qt。
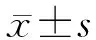
2 结 果
2.1 治疗前的一般情况比较 2组患者性别、年龄、BMI、ASA分级、高血压、心脏病及吸烟史差异均无统计学意义,见表1。2组手术机械通气时间、输液量、失血量及尿量差异均无统计学意义,PV组术后住院天数明显少于CV组。
2.2 不同时点生命体征、呼吸力学和肺氧合功能指标的比较 与CV组比较,PV组T2、T3时Cdyn、OI明显升高(P<0.05),A-aDO2明显降低(P<0.05),2组的MAP、HR、SpO2变化无统计学意义,见表2。
2.3 动脉血气分析的比较 2组各个时点PaO2和PaCO2差异无统计学意义;PV组T3的Qs/Qt值明显低于CV组,见表3。
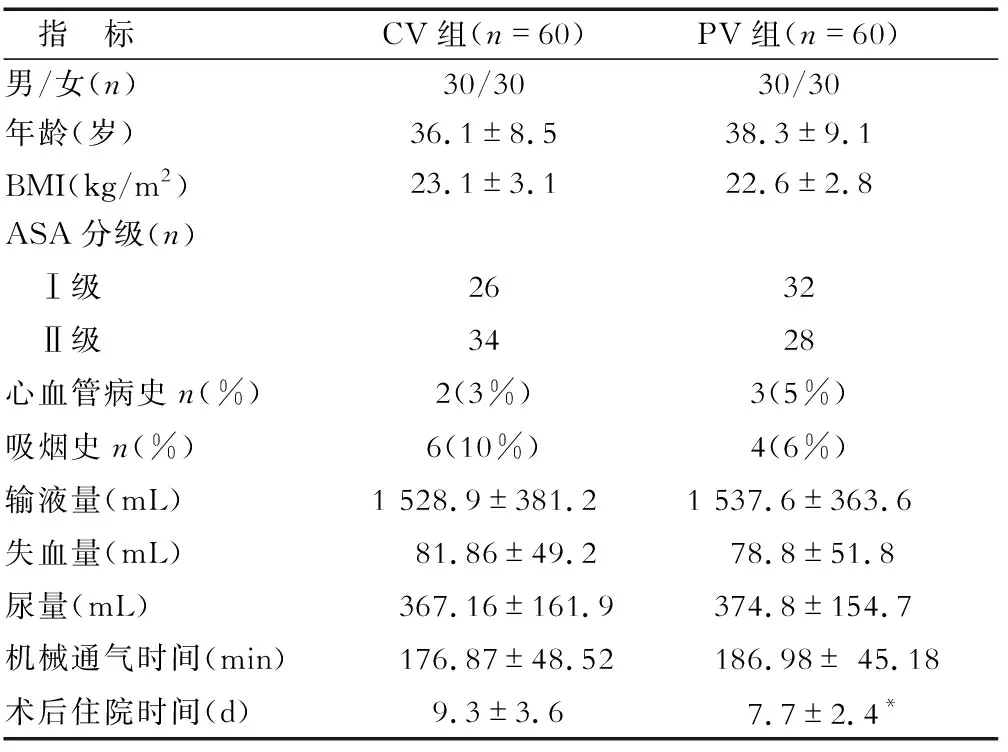
表1 2组患者的一般资料比较
*P<0.05与CV组相比
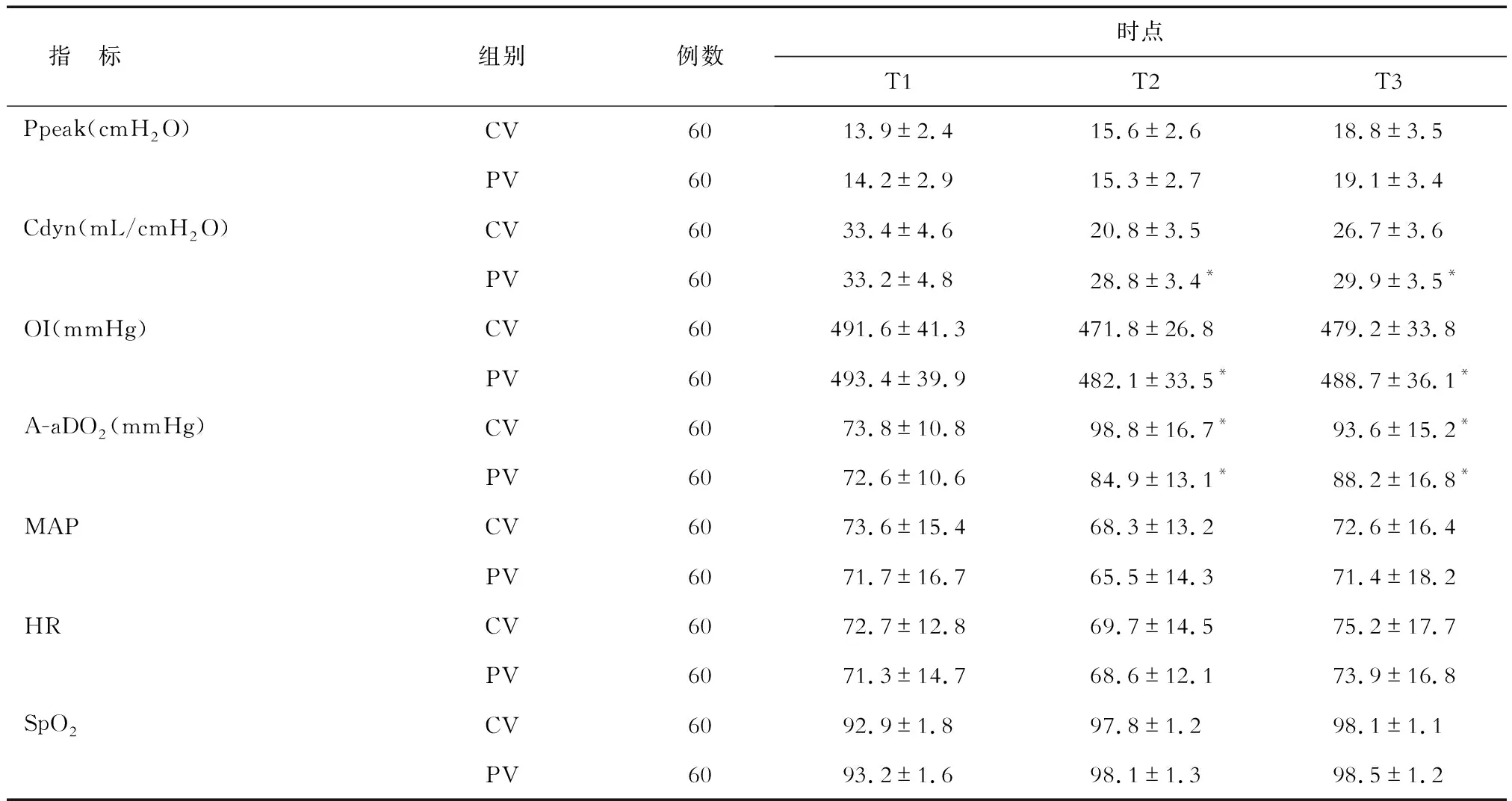
表2 2组患者不同时点生命体征、呼吸力学和肺氧合功能指标的比较
*P<0.05与CV组相比. 1 mmHg=0.133kPa
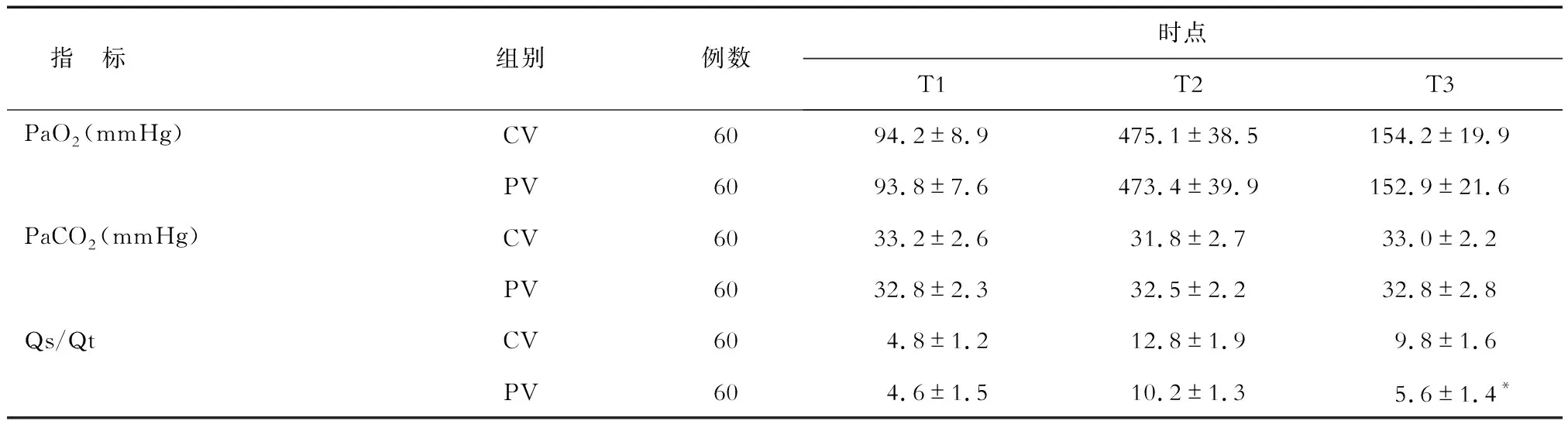
表3 2组患者不同时点动脉血气分析的比较
*P<0.05与CV组相比. 1 mmHg=0.133 kPa
3 讨 论
全麻机械通气诱发的急性肺损伤是全麻患者术后肺部并发症(PPCs)高发的重要原因,术后PPCs是导致患者ICU住院时间和总住院时间延长的重要原因[2]。其发生机制和影响因素有很多,包括肺顺应性、潮气量、平台压、PEEP等[6-7],目前临床上缺乏针对性的预防措施。
高原地区一般指海拔3 000m以上的地区,有特有的地理条件和自然环境,空气稀薄、大气压低、氧分压低,空气中的氧含量为20.93%,海平面的大气压为101.3 kPa(159 mmHg)。高原上的空气含氧百分率和平原不同,单位容积内气体的分子数,低于平原。随着海拔的升高,不仅大气压降低,空气中的氧分压也降低,肺泡氧分压也降低,因此弥散入肺毛细血管内的氧含量减少,故动脉血氧饱和度将随着高度的升高而降低。高原地区患者因长期处于缺氧环境,肺血管和组织结构均发生适应性改变。组织学表现为高原环境可致肺血管丰富,血管壁增厚,肺泡隔厚度增大,导致机体肺顺应性的下降及气道阻力增高[5,8]。高原患者较平原患者肺活量和肺泡容积均显著降低,因此机械通气时高原地区患者肺损伤的风险显著高于平原患者。
本研究结果表明,对于本身已存在肺顺应性下降的高原地区手术患者,术中采用肺保护性通气策略,持续给予肺泡呼气末正压,能在一定程度上增加Cdyn,避免肺泡萎陷,重新扩张萎陷的肺泡,提高肺泡摄氧能力,使得氧合指数明显增加,A-aDO2明显减低。对患者术中以及术后的肺功能都有改善。
传统观念认为,术中应予以大潮气量(VT =10~15 mL/kg)机械通气,通过充分膨胀肺组织,避免潮气量过小所致的术中及术后肺不张、低氧血症、二氧化碳潴留等相关并发症[9]。Setzer等[10]通过动物实验证明,大潮气量机械通气时,实验鼠更易发生严重肺损伤。临床研究[11]表明,小潮气量肺保护性机械通气有益于老年患者的术后肺功能恢复。目前手术中的机械通气常使用LPVS,LPVS可限制机械通气时的潮气量和气道压,从而减轻肺泡过度膨胀。临床研究[12-15]表明,小潮气量通气策略在一定程度上可降低患者PPCs的发生率。其机制可能是通过减少肺泡过度膨胀产生的气道压、肺泡周期性开放或关闭产生的剪切力,降低肺泡表面活性物质丧失,继而减轻肺组织损伤,从而改善患者预后[14,16-17]。研究[18]表明,6 mL/kg潮气量与10 mL/kg的潮气量相比,术中小潮气量通气不增加全麻患者肺不张的发生率,术后肺不张发生率更低。小潮气量通气的同时应复合较高水平的PEEP来改善肺顺应性,能最大程度降低机械通气相关肺损伤的风险,从而改善肺功能[19-20]。全麻诱导期应用PEEP,可有效防止肺不张形成[21]。在减轻患者机械通气相关肺损伤及改善预后方面可能更重要。
本研究各个时点的血气分析结果显示,2组PaO2和PaCO2差异无统计学意义;PV组T3的Qs/Qt值明显低于CV组。Qs/Qt值的公式为Qs/Qt= (CcO2-CaO2) /(CcO2-CvO2),不受血红蛋白含量、氧气消耗量和血红蛋白饱和度等因素的影响。是反映肺内分流情况的重要指标,常用于氧合功能的评估,正常值为5%左右,当>10%时提示患者的肺内分流异常增加[22],2组Qs/Qt随着手术进行而上升,PV组拔管前Qs/Qt值明显低于CV组,提示肺保护性通气能提高患者肺的氧合功能。
综上所述,肺保护性通气能降低高原患者围术期机械通气相关肺损伤的风险,从而改善高原手术患者的预后。

