非小细胞肺癌中TNC、USP22和Ki-67的表达及临床意义
马礼鸿,高 静,王 凯,李婷燕,刘晓丽
非小细胞肺癌是全球最常见的恶性肿瘤之一,其浸润、转移是导致非小细胞肺癌患者治疗失败和死亡的主要原因。肿瘤本质上是一种基因病,肿瘤的浸润、转移是多步骤、多因素参与的复杂多变的生物学过程。细胞外基质与肿瘤生长、转移密切相关,TNC作为细胞外基质的重要组成部分是一种大分子量细胞外基质糖蛋白,有研究表明,TNC可表达于人类多种恶性肿瘤中,且对肿瘤细胞的浸润、转移具有一定的抑制效应[1]。肿瘤标志基因USP22主要是通过对底物靶分子去泛素化修饰发挥重要功能,在肿瘤进展过程中可能起关键作用[2]。Ki-67是单克隆抗体Ki-67的抗原标志物,同时也是现阶段最被认可的肿瘤细胞增殖标志物,其蛋白表达水平和肿瘤恶性程度有关,可作为肿瘤侵袭、转移及预后判断的依据[3]。本组前期实验提示[4],XIAP表达增高可能与肿瘤高度浸润和转移有关,XIAP高表达可能使非小细胞肺癌细胞逃避凋亡机制和生长监控异常增殖,促进非小细胞肺癌的发生、发展。本实验将在前期实验的基础上,采用RT-PCR和免疫组化法联合检测非小细胞肺癌组织中TNC、USP22、Ki-67基因的表达水平,初步探讨非小细胞肺癌的发生和浸润转移机制,为其临床治疗及预后判断提供重要参考价值。
1 材料与方法
1.1 一般资料 收集2017年5月~2018年10月遵义医学院及遵义市第一人民医院病理科存档的手术切除的新鲜非小细胞肺癌组织46例,每份标本留取癌组织和癌旁正常组织,离体后一部分组织快速加入总RNA提取试剂TRIZOL进行后续RT-PCR检测,另一部分组织加入10%中性福尔马林固定进行后续免疫组化试验。其中腺癌26例,鳞状细胞癌20例。男性24例,女性22例;年龄<45岁21例,≥45岁25例;肿瘤直径≤2 cm者18例,>2 cm 28例。按WHO标准,组织学分级:高分化19例,中分化10例,低分化17例;临床分期:Ⅰ+Ⅱ期23例,Ⅲ+Ⅳ期23例;有淋巴结转移者21例,无淋巴结转移者25例。
1.2 主要试剂 一抗兔抗人TNC、USP22、Ki-67均购自Abcam公司;SP免疫组化染色试剂购于北京中杉金桥公司;细胞总RNA提取试剂TRIZOL、c-DNA合成试剂盒和2×taq PCR Master Mix均购自北京天根生物公司。
1.3 免疫组化 免疫组化染色采用SP法,实验操作步骤严格按说明书进行,用阳性非小细胞肺癌切片作为阳性对照,用PBS缓冲液代替一抗作为阴性对照。TNC蛋白结果判定:随机选取5个高倍镜视野,无阳性细胞为0分,阳性细胞占1%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。染色强度:细胞外基质中TNC无表达为0分,局部断线状表达为1分,连线状表达为2分,大量网格状表达为3分。将上述两项得分结果相加:0分为阴性(-),1~2分为弱阳性(+),3~4分为阳性(),>4分为强阳性()。统计学处理时将≥1分归为阳性,记为“+”。USP22蛋白和Ki-67蛋白结果判定:200倍镜下随机选取5个视野,每个视野计数200个细胞,计算阳性细胞占镜下细胞的百分比:阳性细胞数<10%为(-),10%~25%为(+),26%~50%为(),>50%为()。统计学处理时将阳性细胞数≥10%归为阳性,记为“+”。
1.4 RT-PCR 按照TRIZOL试剂说明书提取TNC、USP22、Ki-67在非小细胞肺癌组织中的总RNA。TNC引物序列:上游5′-CTGTCACCGTGTCAACCTGA-3′,下游5′-TATCCCAA CATTCCCCGCTT-3′;USP22引物序列:上游5′-CCATCTTT GTCCGGCCTCC-3′,下游5′-CCAACGCCTTGCATTTTC CA-3′;Ki-67引物序列:上游5′-CTTTGGGTGCGACTTGAC GA-3′,下游5′-TTCTGCCATTACGTCCAGCG-3′;β-actin引物序列:上游5′-CACCACACCTTCTACAATGAGC-3′,下游5′- GTGATCTC CTTCTGCATCCTGT-3′。反应条件:94 ℃预变性5 min;94 ℃变性25 s,52 ℃退火30 s,72 ℃延伸30 s,33次循环;72 ℃终延伸5 min。使用2.0%琼脂糖凝胶对PCR产物进行电泳分析。
1.5 统计学分析 应用SPSS 18.0软件进行统计学分析,两组之间的差异采用χ2检验,采用Spearman秩相关性比较,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 TNC、USP22及Ki-67蛋白在正常肺组织和非小细胞肺癌组织中的表达 TNC蛋白主要表达于非小细胞肺癌巢周围细胞外基质、基膜,呈细条状棕黄色或棕褐色区(图1A、B),在肺腺癌和鳞状细胞癌中的阳性率分别为73.07%(19/26)和75.00%(15/20),差异无统计学意义(P>0.05,表1)。USP22蛋白主要表达于非小细胞肺癌细胞胞核,呈棕黄色或棕褐色颗粒(图1C、D),在肺腺癌和鳞状细胞癌中的阳性率分别为69.23%(18/26)和70.00%(14/20),差异无统计学意义(P>0.05,表1)。Ki-67蛋白主要表达于非小细胞肺癌细胞胞核,部分细胞胞质也呈阳性反应并呈棕黄色或棕褐色颗粒(图1E、F),在肺腺癌和鳞状细胞癌中的阳性率分别为61.53%(16/26)和75.00%(15/20),差异无统计学意义(P>0.05,表1)。
2.2 TNC、USP22及Ki-67蛋白表达与非小细胞肺癌临床病理特征的关系 TNC蛋白高表达与非小细胞肺癌患者年龄、性别、肿瘤大小和组织学分类无关(P>0.05),与非小细胞肺癌淋巴结转移、分化程度和临床分期相关(P<0.05,表1)。USP22和Ki-67蛋白高表达均与非小细胞肺癌淋巴结转移、分化程度和临床分期呈正相关(P<0.05),与患者年龄、性别、肿瘤大小和组织学分类均无关(P>0.05,表1)。
2.3 TNC、USP22及Ki-67 mRNA在肺腺癌和肺鳞状细胞癌组织中的表达 肺腺癌和肺鳞状细胞癌中TNC、USP22和Ki-67 mRNA表达均增强,与正常对照组相比差异有统计学意义(P<0.01);而肺腺癌组和肺鳞状细胞癌组相比,TNC、USP22及Ki-67 mRNA的表达强度差异均无统计学意义(P>0.05,图2)。
3 讨论
TNC是细胞外基质中具有独特六臂结构的寡聚糖蛋白,在胚胎期一过性高表达,至机体发育成熟表达减弱,具有创伤修复、调节肿瘤细胞增殖、分化等作用。研究显示TNC在多种恶性肿瘤如乳腺癌、肠癌、非小细胞肺癌及前列腺癌等肿瘤中均高表达,且表达强度与肿瘤浸润转移有关。最近有关TNC在非小细胞肺癌中的研究已有报道,2014年葛忠虎等[5]展开了TNC在非小细胞肺癌中的病理研究,并分析得出TNC表达与非小细胞肺癌的分类、肿瘤直径和病理分级无关,与TNM分期、有无胸膜浸润及淋巴结转移有关,推测TNC表达可能有助于非小细胞肺癌的侵袭和转移。然而,关于TNC在非小细胞肺癌中过表达与其浸润转移的机制却知之甚少。2015年Tang等[6]发现TNC可与细胞表面黏附分子整合素αvβ3结合,激活αvβ3-KRAS-rALB-NFκB信号通路并促进肺肿瘤的浸润转移。2017年Gocheva等[7]提出通过CRISPR介导的内源基因转录激活,可增加TNC表达水平,促进肺腺癌细胞的转移扩散,且TNC表达越高肺腺癌的预后越差。本实验检测了TNC在肺腺癌和肺鳞状细胞癌中的表达,并分析其表达与非小细胞肺癌患者年龄、性别、肿瘤大小、淋巴结转移、分化程度、临床分期以及组织学分类的相关性。RT-PCR和免疫组化结果均显示TNC在肺腺癌和肺鳞状细胞癌中表达差异无统计学意义,提示TNC表达与非小细胞肺癌组织学分类无关。同时本实验结果表明,TNC高表达与非小细胞肺癌患者年龄、性别、肿瘤大小无关,而与淋巴结转移、分化程度及临床分期有关,且分化程度越高、临床分期越早TNC表达越强,这一结论与葛忠虎等[5]在非小细胞肺癌中的研究结果一致,表明TNC表达增强对于非小细胞肺癌的浸润转移具有一定的抑制效应。本实验亦发现TNC主要表达于非小细胞肺癌巢周边细胞外基质及基膜,提示间质中TNC的聚集可能是抑制非小细胞肺癌细胞浸润转移的重要屏障,这一结论已经在乳腺导管癌、结直肠癌、前列腺癌等恶性肿瘤的研究中得到证实。可见,检测TNC表达对判断非小细胞肺癌患者的恶性程度及预后有重要意义。
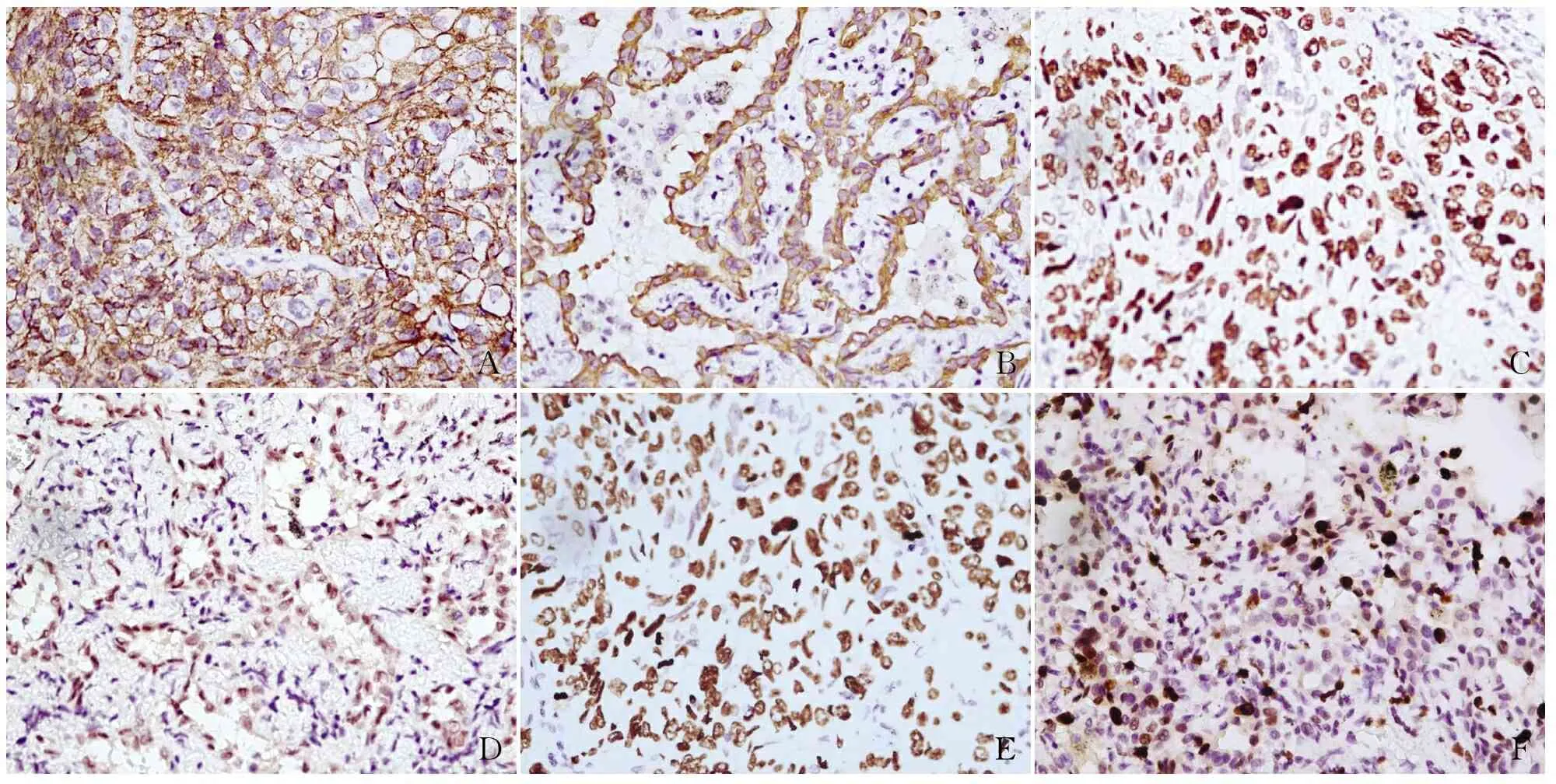
ABCDEF
图1 TNC、USP22及Ki-67蛋白在非小细胞肺癌组织中的表达,SP法:A.TNC在肺鳞状细胞癌中高表达,定位于细胞外基质、基膜;B.TNC在肺腺癌中高表达,定位于细胞外基质、基膜;C.USP22在肺鳞状细胞癌中高表达,定位于细胞核;D.USP22在肺腺癌中高表达,定位于细胞核;E.Ki-67在肺鳞状细胞癌中阳性,定位于细胞核;F.Ki-67在肺腺癌中阳性,定位于细胞核
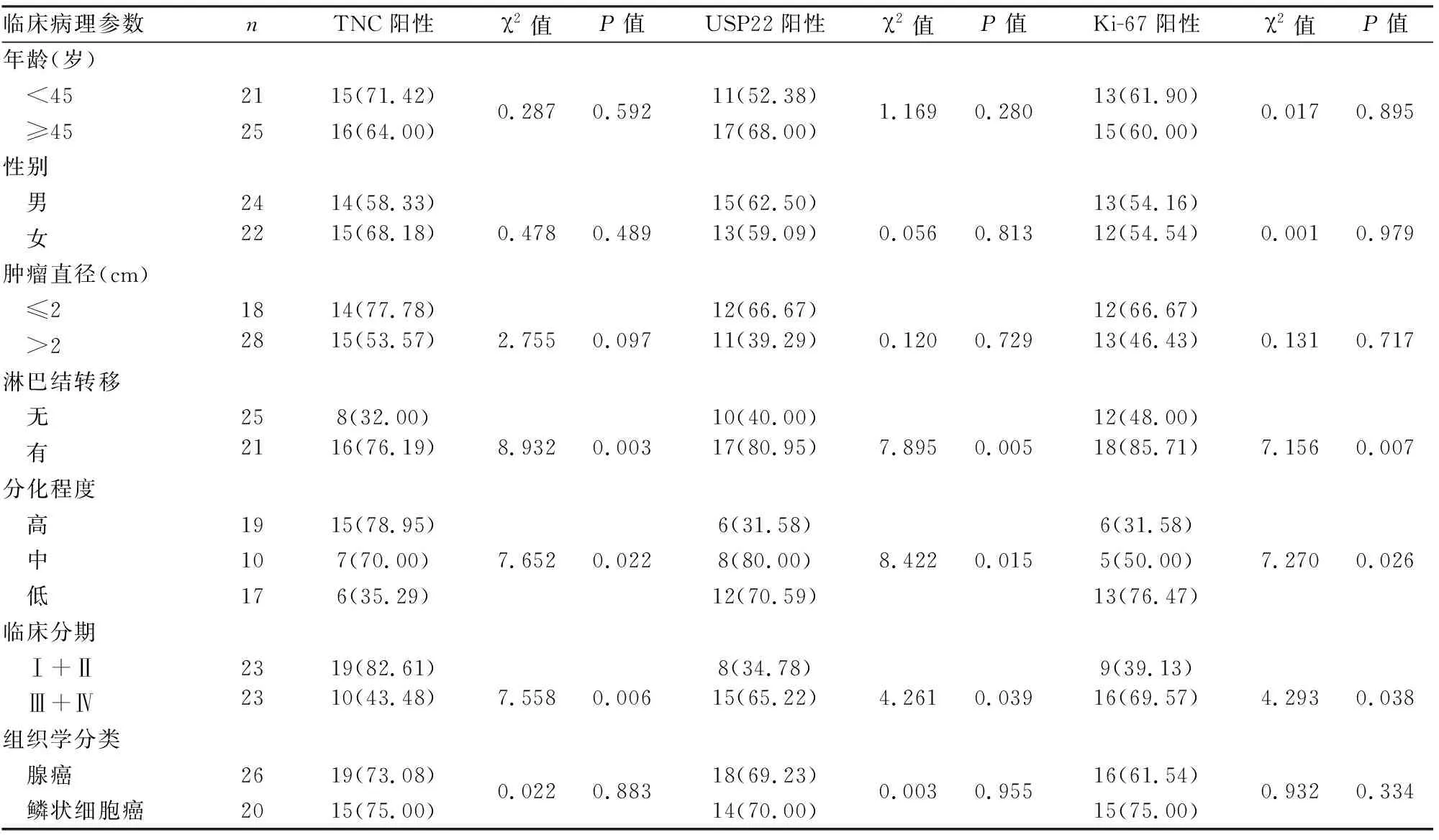
表1 TNC、USP22及Ki-67蛋白表达与非小细胞肺癌临床病理特征的关系[n(%)]
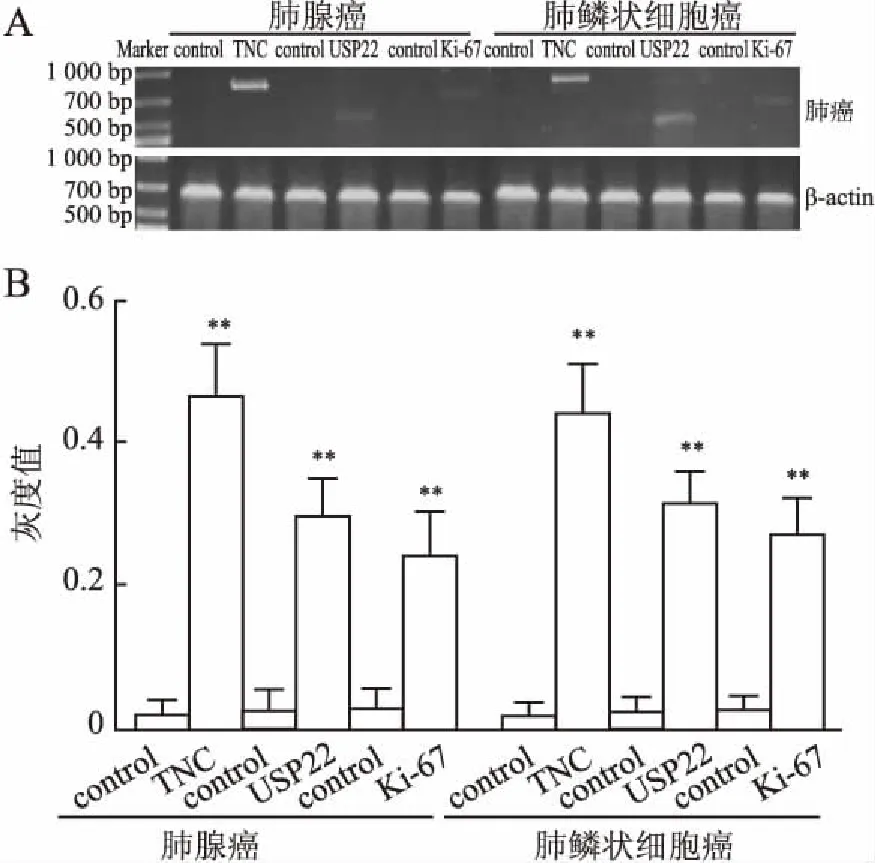
图2 TNC、USP22及Ki-67 mRNA在肺腺癌和肺鳞状细胞癌组织中的表达:A.RT-PCR的典型电泳结果;B.3次独立实验的单因素方差检验;与对照组相比,**P<0.01
USP22是一种调控肿瘤发生、发展的去泛素酶,研究报道USP22与人转录复合物SAGA(human Spt-Ada-Gcn5-acet-yltransferase)的亚单位结合,促使SAGA乙酰化染色体上的组蛋白(H2A、H2B),激活基因的转录,促进细胞由G1/S、G2/M期过渡,促使肿瘤发生、发展及转移[8]。USP22可促进多种恶性肿瘤细胞增殖,为肿瘤预后不良基因。Xiao等[9]发现USP22高表达可促进鼻咽癌细胞活力和增殖,miR-34B可通过靶向调控USP22抑制鼻咽癌细胞增殖。Okamoto等[10]通过敲除USP22基因,降低USP22的表达,抑制恶性胸膜间皮瘤细胞的体外增殖。Zhang等[11]研究证实USP22在骨肉瘤中高表达,下调USP22基因表达后,可抑制骨肉瘤细胞增殖并阻滞细胞周期。本组中RT-PCR和免疫组化结果均提示,与正常对照组相比,非小细胞肺癌组织中USP22蛋白和mRNA表达均增强,差异有统计学意义,并且淋巴结出现转移、分化程度越低、临床病理分期越晚时,USP22表达越强。提示USP22高表达可能使非小细胞肺癌细胞增殖调控受到影响,从而导致非小细胞肺癌细胞异常增殖。本实验中,中分化组USP22的阳性率显著高于低分化组,可能是由于样本量不足,还需要后期增加每组样本量继续进行深入分析。可见USP22高表达是非小细胞肺癌发生的重要机制之一。
细胞增殖失控是恶性肿瘤发展的标志,Ki-67是一种反应细胞增殖活性的特异性核抗原。近来研究表明,Ki-67在肿瘤的发生、发展、侵袭和转移中起关键性作用。关于非小细胞肺癌中Ki-67表达与临床病理特征的关系已被广泛研究,且争议颇多。袁艳龙等[12]对79例非小细胞肺癌组织和20例肺良性病变组织分析发现Ki-67表达与非小细胞肺癌分化程度、临床分期及淋巴结转移明显相关,而与患者性别、年龄、肿瘤大小、病理类型等无明显相关性。Wen等[13]对5 600例非小细胞肺癌患者进行Meta分析,证实在亚洲非小细胞肺癌患者中Ki-67高表达与患者年龄和淋巴结转移无关,与患者性别、临床分期、分化程度显著相关。Warth等[14]对1 065例非小细胞肺癌患者进行回顾性分析,发现Ki-67增殖指数与组织学亚型有关。本实验中Ki-67在非小细胞肺癌中高表达与淋巴结转移、分化程度和临床分期呈正相关,与患者年龄、性别、肿瘤大小和组织学分类无关,与袁艳龙等[12]在非小细胞肺癌中的研究结果一致,而与Wen等[13]的研究结果不完全一致。原因可能是由于此次非小细胞肺癌标本量不足,仍需加大样本量深入探讨。
本实验亦发现USP22与Ki-67的表达呈正相关,提示USP22与Ki-67两者可能在非小细胞肺癌中相互作用,共同促进细胞增殖,这一结论已经在食管鳞癌中得到证实[8]。但仍需进一步实验证实非小细胞肺癌中两者之间的关系。随着对肿瘤浸润转移研究的逐渐深入,有效的将TNC与USP22及Ki-67的指标联合检测,并探讨三者在非小细胞肺癌浸润转移中的相互作用机制,有望为非小细胞肺癌的治疗及预后提供新思路。

