胃癌中MCU的表达及对胃癌细胞转移的作用
王潇飞,程 光,马艳君,董丽儒,张 爽,宋旭东
随着癌转移机制研究的不断深入,线粒体钙稳态与恶性肿瘤的发展关系备受重视。线粒体钙单向转运蛋白(mitochondrial calcium uniporter, MCU)是钙流入线粒体、控制细胞能量代谢、产生活性氧和程序性细胞死亡的主要介质[1]。目前研究认为,MCU与肿瘤大小和淋巴浸润相关,并提示有助于肿瘤生长和转移的发生;推测MCU通过HIF-1α影响VEGF的表达,抑制MCU的表达显著降低乳腺癌细胞侵袭和迁移能力[2]。本实验进一步探讨人胃癌组织中MCU表达以及对胃癌细胞侵袭和迁移的影响,为MCU能作为诊治的新靶点提供依据。
1 材料与方法
1.1 临床资料 收集2015~2018年华北理工大学附属医院病理科存档的60例胃癌手术切除标本和20例新鲜胃癌标本,所有病例均由副主任级别以上病理医师确诊。本实验使用的临床组织样本均获得患者知情同意。
1.2 细胞株 人胃癌细胞株MGC-803购于上海中乔新舟生物公司。
1.3 抗体及试剂 一抗MCU小鼠单克隆抗体(Santa Cruz Biotechnology Inc)、HIF-1α、TGF-β、E-cadherin兔多克隆抗体(Proteintech Inc)、β-actin兔多克隆抗体(北京博奥森公司);RPMI 1640培养基、青链霉素、胰蛋白酶-EDTA消化液(HyClone公司);胎牛血清(FUMENG GENE Inc);线粒体膜电位检测试剂盒(JC-1法)(北京索莱宝公司),总蛋白提取试剂盒(南京凯基公司),Transwell小室(Corning Inc),Alexa Fluor 594标记山羊抗小鼠IgG(北京中杉金桥公司),Lipofectamine 2000 Transfection Reagent(Invitrogen Inc),ECL超敏发光液(Thermo Fisher Scientific Company),Cell counting KIT-8(同仁化学研究所),Spermine小分子诱导剂(Cayman Chemical company),Matrigel基质胶(BD)。
1.4 方法
1.4.1 细胞培养和CCK-8实验 人胃癌细胞株MGC-803复苏,37 ℃ 5%CO2完全培养基培养,3天传1代。在细胞对数生长期时,收集细胞并计数、进行实验。CCK-8实验:按照每孔2 000个细胞接种到96孔板,细胞贴壁稳定24 h后,给予不同剂量的Spermine(12.5、25、50、100、200 μmol/mL),每组复4孔,继续培养48 h,每孔加入CCK-8溶液10 μL,继续培养3 h,取出用酶标仪测定在450 nm处的吸光度并计算增殖倍数。
1.4.2 siRNA MCU转染 参照Lip2000转染试剂盒说明进行操作。Opti-MEMR Ⅰ无血清培养基适量,稀释Lip2000及MCU siRNA和Control siRNA,将稀释后的Lip2000与siRNA混匀,其中siRNA转染的浓度是100 nmol/L,将Lip2000-siRNA形成的复合物于室温环境中孵育20 min。取生长至对数期的MGC-803细胞胰酶消化后制成单细胞悬液,以每孔8×105个细胞接种于6孔板,RPMI 1640完全培养基(含血清不含抗生素)培养,细胞达50%生长融合度时,弃掉培养液,Lip2000-siRNA形成的复合物加入到细胞培养板中,混合均匀后于培养箱中常规孵育24 h,更换培养基(含血清和抗生素),继续培养24 h,收集细胞检测各组细胞中MCU的蛋白表达。本实验使用的干扰MCU序列为:hMCU siRNA-2正义链5′-GAAUUUGGGAGCUGUUUAUTG-3′;hMCU siRNA-2反义链5′-AUAAACAGCUCCCAAAUU CTG-3′。文中以siRNA MCU表示。
1.4.3 免疫组化 免疫组化染色采用SP法。石蜡包埋胃癌组织和癌旁组织切片,经二甲苯脱蜡,梯度乙醇水化,蒸馏水浸洗,抗原修复后,一抗4 ℃孵育过夜,PBS冲洗3次,二抗37 ℃孵育1 h,PBS冲洗3次,DAB显色,复染,梯度乙醇脱水,二甲苯透明,中性树胶封固,400倍光镜下观察蛋白表达情况并拍照。应用Image-Pro Plus 6.0图像处理系统测量各组蛋白的平均光密度。
1.4.4 免疫荧光 新鲜胃癌组织和癌旁组织冷冻切片,经95%乙醇固定,PBS水洗,1%Triton-100,37 ℃孵育15 min,PBS水洗3遍,山羊血清工作液封闭30 min,一抗4 ℃孵育过夜,PBS冲洗3次,荧光二抗37 ℃避光孵育1 h,PBS冲洗3次,抗衰减DAPI染核,荧光显微镜下,400倍光观察荧光表达并拍照。应用 Image-Pro Plus 6.0 图像处理系统测量各组蛋白的平均光密度。
1.4.5 线粒体膜电位 细胞对数增长期,接种六孔板,每孔5×105个,根据实验分为对照组、Spermine组、siRNA MCU组,干预48 h,PBS洗涤。加入1 mL培养基工作液和1 mL JC-1 染色工作液,充分混匀。细胞培养箱中37 ℃孵育20 min。37 ℃孵育结束后,吸除上清,用JC-1染色缓冲液(1×)洗涤2次。加入2 mL细胞培养液。荧光显微镜下观察拍照,使用IPP 6.0软件分析[3]。
1.4.6 Transwell实验 预先用Matrigel包被Transwell小室,将细胞接种于上室(每室5×105个细胞),上室用无血清培养液,下室用含血清工作液培养,培养48 h后,4%多聚甲醛固定10 min,棉签拭去上层未转移的细胞,结晶紫对下层细胞染色并计数。
1.4.7 划痕实验 首先在6孔板背面画2~3条横线。根据实验分为对照组、Spermine组、siRNA MCU组,以每孔接种6×105个细胞。待细胞铺满后,用20 μL枪头垂直于横线划痕。PBS洗涤并加入无血清的培养基,于0 h和48 h使用倒置显微镜拍照,使用IPP 6.0软件分析。
1.4.8 Western blot 应用全蛋白提取试剂盒,提取前30 min配裂解液,4 ℃放置5 min,剧烈震荡30 s,共5个循环,离心去除细胞碎片及杂质,分装蛋白,应用蛋白含量检测试剂盒检测OD值,100 ℃ 10 min煮蛋白,上样进行SDS-PAGE电泳。采用ECL化学发光显影剂,曝光。应用Image J软件测量条带灰度值,以β-actin作为内参,不同时间点以两者灰度值比值表示相对蛋白量。
1.5 统计学分析 所有数据采用SPSS 17.0软件进行统计学分析,两样本均数的比较用t检验,多个样本均数的比较用方差分析,率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
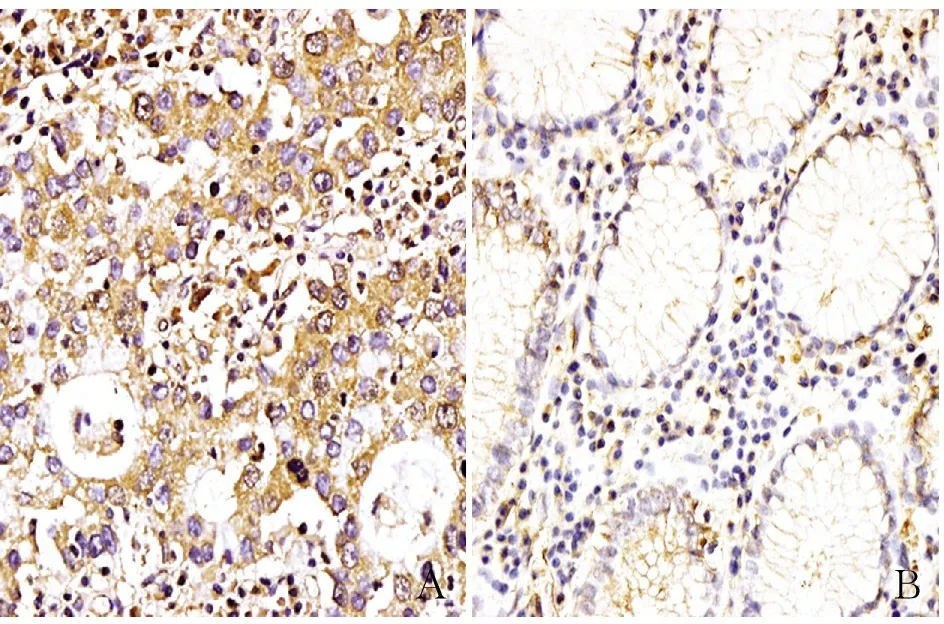
2.1 免疫组化和免疫荧光检测胃癌组织和癌旁组织中MCU蛋白的表达 MCU表达定位于细胞质,以棕黄色为阳性,免疫组化和免疫荧光结果均表明,胃癌组织中MCU阳性率为72.5%(58/80例);癌旁组织中MCU阳性率为22.5%(18/80例),两组相比差异有统计学意义(P<0.01,图1、2)。
2.2 Western blot法检测胃癌组织和癌旁组织中MCU蛋白的表达 统计结果显示,胃癌组织中MCU的表达显著高于癌旁组织,差异有统计学意义(P<0.05,图3)。
AB
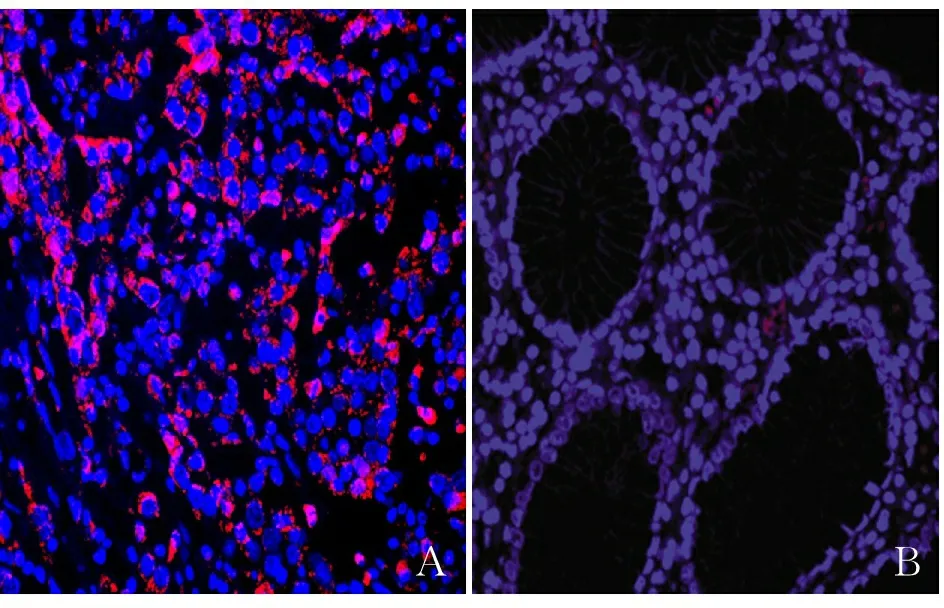
图1 胃癌(A)组织和癌旁组织(B)中MCU蛋白的表达,SP法
图2 胃癌(A)组织和癌旁组织(B)中MCU蛋白的表达,免疫荧光
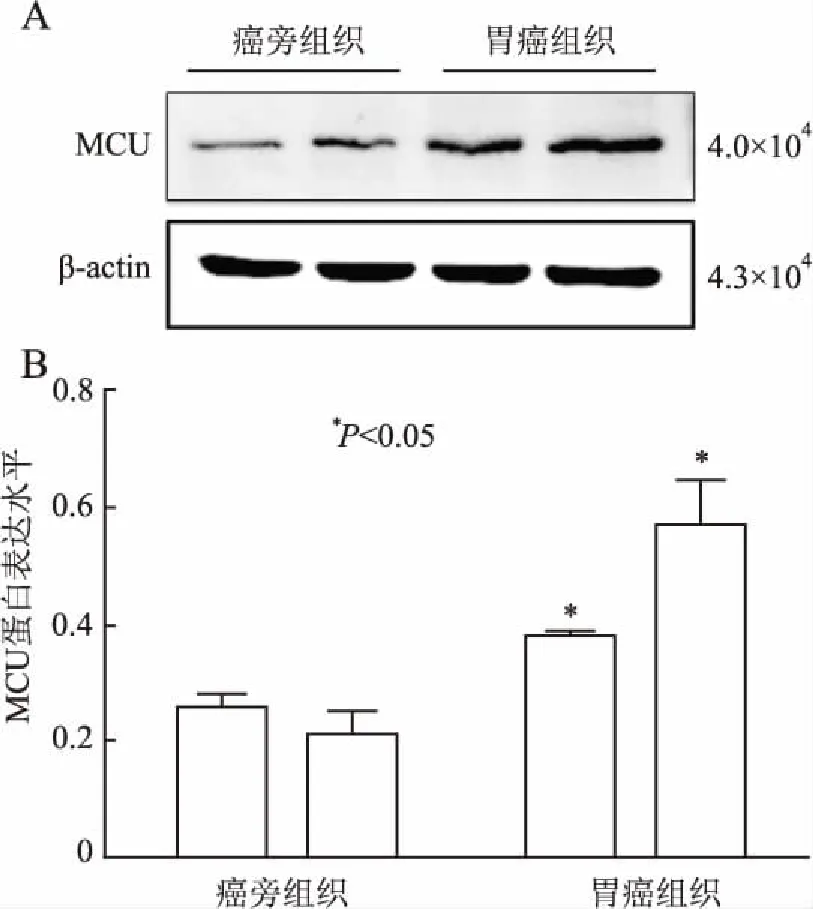
图3 Western blot法检测胃癌和癌旁组织中MCU蛋白的表达
2.3 CCK-8实验检测Spermine对MGC-803细胞增殖的影响 应用CCK-8实验检测不同浓度的Spermine对MGC-803细胞增殖的影响,结果显示MGC-803细胞增殖率随着诱导剂浓度的增加逐渐降低(图4)。本实验选择25 μmol/mL作为干预因素进行下一步实验。
2.4 不同siRNA序列对MGC-803胃癌细胞MCU蛋白表达的影响 将针对MCU干扰靶向siRNA序列转染MGC-803细胞,Western blot法检测转染48 h后各组细胞中MCU的蛋白表达,结果显示,2条siRNA均能降低MCU的表达,与对照组和Control siRNA组相比,差异有统计学意义(P<0.01,图5),选择抑制效果显著的siRNA MCU-2序列作为实验对象。
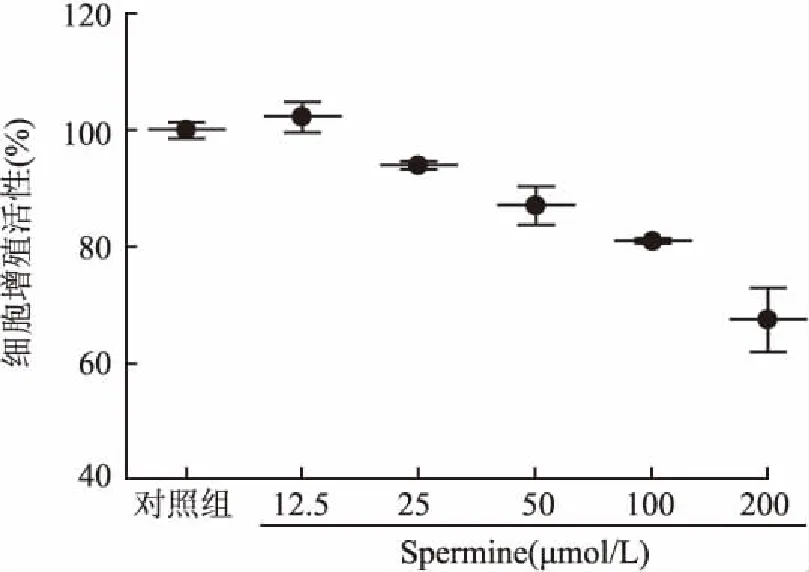
图4 MCU诱导剂Spermine对MGC-803细胞增殖的影响
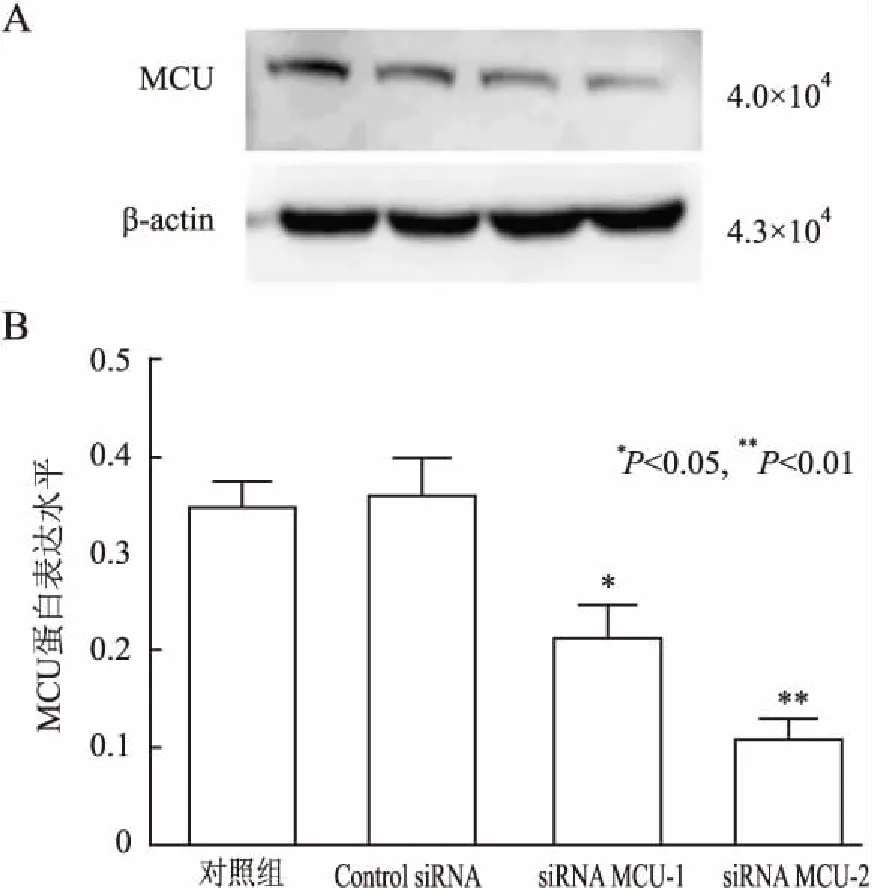
图5 siRNA MCU对MGC-803细胞MCU蛋白表达的影响
2.5 MCU对MGC-803胃癌细胞线粒体膜电位的影响 利用JC-1法检测不同分组中MGC-803细胞线粒体膜电位的影响,结果显示,Spermine能够显著增加MGC-803细胞线粒体膜电位,且荧光强度较为聚集、细胞形态长梭形,与对照组相比,差异有统计学意义(P<0.05);siRNA MCU组显著降低线粒体膜电位,与对照组相比荧光强度显著减弱,差异有统计学意义(P<0.05,图6)。
2.6 Transwell和细胞划痕实验检测MCU对MGC-803胃癌细胞侵袭和迁移能力的影响 Spermine能够显著增加MGC-803细胞侵袭和迁移的细胞数量,与对照组相比,差异有统计学意义(P<0.01);siRNA MCU组能够显著降低MGC-803细胞侵袭和迁移能力,与对照组相比,差异有统计学意义(P<0.01,图7)。
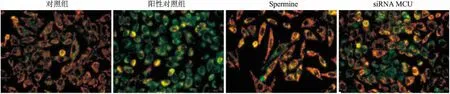
图6 不同分组对MGC-803胃癌细胞线粒体膜电位的影响
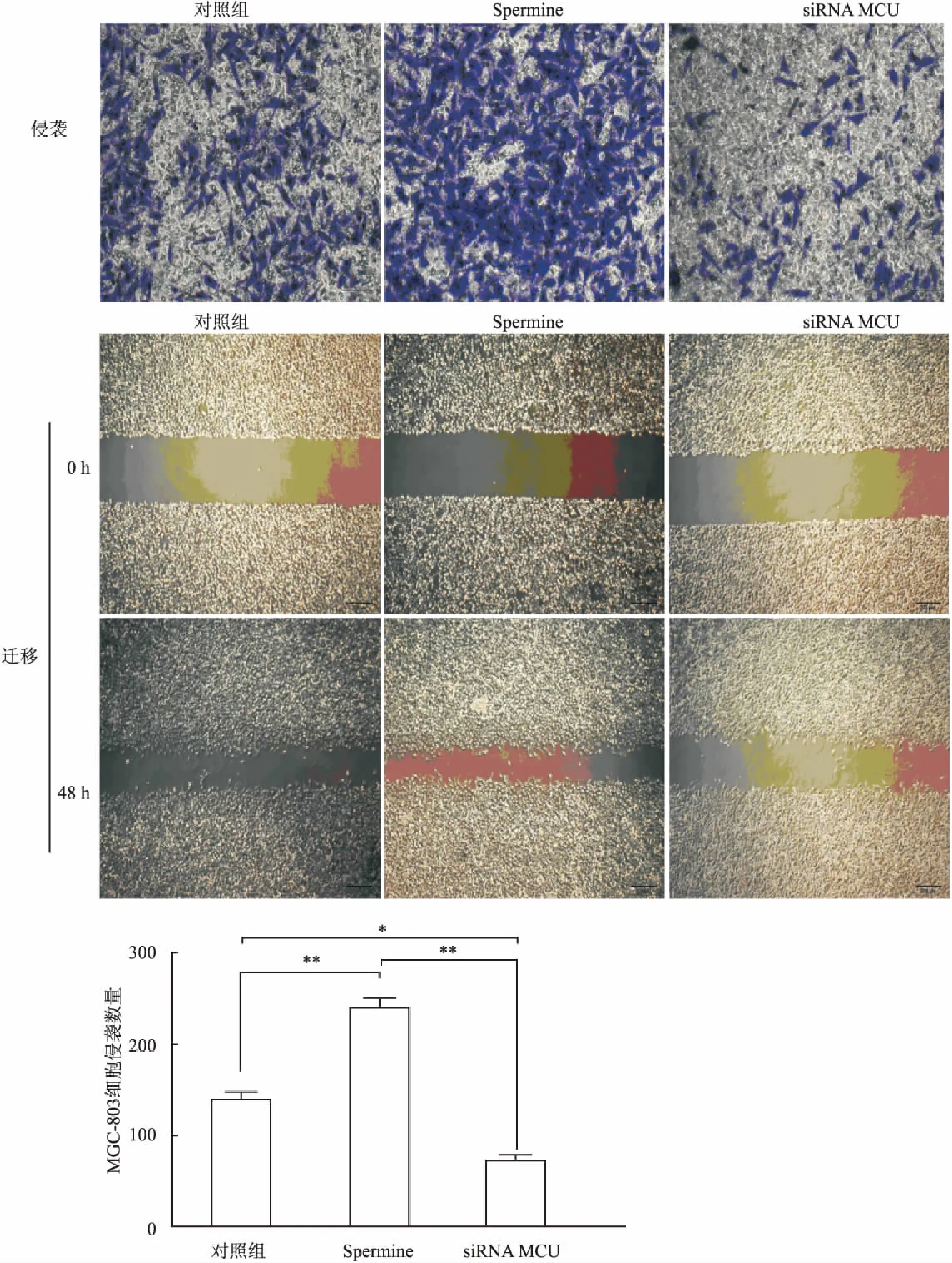
图7 MCU对MGC-803胃癌细胞侵袭和迁移能力的影响
*P<0.05,**P<0.01
2.7 Western blot法检测MCU对MGC-803胃癌细胞HIF-1α、TGF-β、E-cadherin蛋白表达的影响 统计分析结果显示,Spermine组能促进HIF-1α、TGF-β表达和降低E-cadherin蛋白的表达,与对照组相比,差异有统计学意义(P<0.05);siRNA MCU干扰后显著降低HIF-1α、TGF-β表达和上调E-cadherin蛋白表达,与对照组和Spermine组相比,差异有统计学意义(P<0.05,图8)。
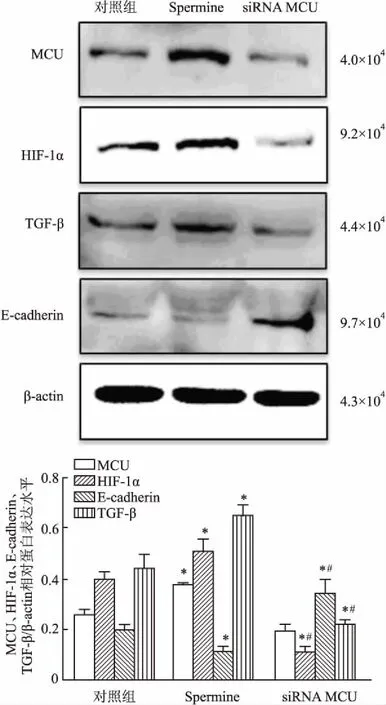
图8 MCU对MGC-803胃癌细胞中HIF-1α、TGF-β、E-cadherin蛋白表达的影响与对照组相比,*P<0.05;与Spermine组相比,#P<0.05
3 讨论
线粒体在癌症生物学中依赖多种分子发挥促癌作用[4]。线粒体发挥促癌的过程中,MCU通过调控线粒体钙离子水平影响癌细胞的转移[5]。根据人类蛋白质图谱(www.proteinatlas.org)多数癌组织中MCU的表达存在差异[6]。MCU调节细胞存活率、代谢、基本细胞构建和免疫等功能,不仅影响癌症的进展,还影响治疗效果。MCU通过线粒体内膜将钙转运到线粒体基质影响癌细胞的增殖和凋亡[7]。虽然,以往研究结果表明MCU参与多部位癌转移的过程,但是在胃癌细胞转移中的作用并不清楚。
本组实验结果表明,MCU在胃癌组织中高表达,并能促进胃癌细胞的侵袭和迁移。MCU通过调节线粒体膜电位影响癌症的发展。Arduino等[8]的研究结果显示,通过使用MCU特异性抑制剂能对血液恶性肿瘤发挥治疗作用。Wiel等[9]的研究结果表明,IITPR2通过MCU通道导致线粒体钙积累,影响线粒体膜电位、活性氧积累和癌细胞的衰老。本实验利用JC-1法进行检测,结果表明MCU的诱导剂Spermine能够显著增加线粒体膜电位的钙离子累积,而siRNA MCU干扰组能显著降低线粒体膜电位。结果提示MCU对于胃癌细胞的线粒体膜电位具有调节作用。
在癌症研究中MCU的作用仍存在争议。研究表明,在某些癌症中特定的Ca2+通道调控机制不同,导致发挥的作用也不尽相同。先前的研究结果揭示,高表达的MCU能够促进乳腺癌细胞的转移,且预后较差[10]。在结肠癌研究中,RIPK1与MCU相互作用,通过增加线粒体钙摄取和能量代谢促进癌细胞的增殖和转移[11]。也有研究表明,促进MCU的表达能显著抑制癌细胞的侵袭和迁移[12]。本实验通过Transwell和细胞划痕实验表明,应用MCU诱导剂Spermine后,胃癌细胞侵袭和迁移能力显著增强;而干扰MCU表达后,胃癌细胞侵袭和迁移能力显著降低。该结果表明MCU在胃癌细胞中存在促癌转移的作用。
上皮-间充质转化(epithelial-mesenchymal transition, EMT)与钙离子摄取密切相关[13]。众所周知,EMT是癌转移过程中的关键环节。在EMT过程中,HIF-1α和TGF-β信号被认为发挥着关键的作用[14-15]。然而,MCU对EMT及其相关信号因子的关系略有不同。有研究结果表明,在TGF-β诱导乳腺癌细胞侵袭和转移过程中MCU存在调控作用[16]。也有研究结果显示,在三阴型乳腺癌中发现MCU表达与肿瘤大小和淋巴结浸润有关,提示MCU通过调节HIF-1α促进乳腺癌的进展[2]。本实验应用Spermine能够显著增加胃癌细胞侵袭和迁移能力,并且促进HIF-1α和TGF-β蛋白的表达水平,干扰MCU后两者表达显著降低并伴有E-cadherin表达的增加。
本实验检测了胃癌组织和癌旁组织中MCU的表达,结果显示MCU在胃癌组织中的表达显著高于癌旁组织。在线粒体膜电位的检测中,MCU能够调节胃癌细胞中线粒体钙离子的摄取。MCU能促进胃癌细胞的侵袭和迁移,通过诱导和干扰MCU表达发现能影响HIF-1α和TGF-β的表达,表明MCU在促进胃癌细胞的过程中,对HIF-1α和TGF-β的表达具有调节作用。但是本实验并未对HIF-1α和TGF-β表达进行干预,来进一步探讨MCU的详细作用机制,未来将进一步阐述。
综上所述,本实验揭示了MCU在胃癌组织中的表达水平以及促进胃癌细胞侵袭和迁移的作用。MCU能影响胃癌细胞中HIF-1α和TGF-β的表达。本实验对MCU在癌症中的作用提出了一些新参考,也为防治胃癌转移提出新依据。

