EGFR基因扩增在食管鳞状细胞癌中的预后价值
朱 娜,蒋冬先,侯英勇
食管癌是中国最常见的恶性肿瘤之一,其中鳞状细胞癌是食管癌最常见的组织类型。患者在诊断时常已处于晚期,因此预后极差。尽管手术治疗、放疗、化疗不断在进展,但5年生存率仍不足20%。近些年,分子靶向治疗已经成为一种重要的治疗方法。表面生长因子受体(epidemal growth factor receptor, EGFR)家族包含4个成员,EGFR、ErbB2/HER-2、ErbB3/HER-3和ErbB4/HER-4,作为酪氨酸激酶受体,在细胞信号传导、控制细胞增殖和分化中起重要作用。EGFR或HER-2基因扩增和过表达在食管癌中经常发生,食管鳞状细胞癌主要表现为EGFR基因扩增,而食管腺癌主要表现为HER-2基因扩增。根据EGFR基因在肿瘤细胞生物学中的作用和在食管鳞状细胞癌中的表达情况,EGFR基因很可能是食管鳞状细胞癌很重要的治疗靶点之一。但根据目前的研究,EGFR基因改变情况需要更大宗的数据分析,其与食管鳞状细胞癌临床病理特征之间的相关性及预后的关系仍不明确。因此,本实验旨在探讨EGFR基因扩增在食管鳞状细胞癌中的意义。
1 材料与方法
1.1 材料 收集2007~2010年复旦大学附属中山医院胸外科诊治的504例食管鳞状细胞癌患者。所有患者在手术前均未接受放、化疗。所有患者均签署书面知情同意书。
1.2 方法 标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,制作组织芯片(tissue microarray,TMA)。4 μm厚切片,行HE染色和FISH检测。临床病理相关因素包括患者性别、年龄、吸烟史、肿瘤部位(食管上段、中段及下段)、肿瘤直径(以3.3 cm为界限分两组)、分化程度(高、中、低)、脉管侵犯情况、神经侵犯情况、肿瘤浸润深度、淋巴结转移情况及临床分期(分Ⅰ+Ⅱ、Ⅲ+Ⅳa两组)。双色EGFR探针中红色信号探针为EGFR探针,特异性定位在EGFR基因座(7p12),绿色信号探针为7号染色体着丝粒探针(7p11.1-q11.1)。具体操作步骤类似于之前报道的HER-2-FISH过程[1]。
连续计数至少100个肿瘤细胞EGFR信号,可分为6种类型:(1)二倍体:>90%肿瘤细胞拷贝数≤2;(2)低三倍体:10%~40%肿瘤细胞拷贝数≤3;(3)高三倍体:≥40%肿瘤细胞拷贝数≤3;(4)低多倍体:10%~40%肿瘤细胞拷贝数≥4;(5)高多倍体:>40%肿瘤细胞拷贝数≥4;(6)基因扩增:EGFR基因簇状扩增,或EGFR/CEP7≥2,或≥10%肿瘤细胞拷贝数≥15。EGFR基因FISH阳性被定义为EGFR高多倍体或基因扩增[2-3]。
1.3 随访 504例患者均获得完整随访资料。随访资料来自于病历记录、电话随访以及家访。随访时间截至2015年11月。无瘤生存期(disease-free survival, DFS)和总生存期(overall survival, OS)指从手术切除时间到第一次肿瘤复发时间(或最近随访时间)和死亡时间。
1.4 统计学分析 χ2检验用于单因素分析,不同评分系统的一致性通过Kappa进行测量,统计学差异通过McNemar检验进行分析。使用Kaplan-Meier分析计算DFS和OS。Log-rank检验用于比较生存分析中作为变量函数的DFS和OS,并用于识别差异的显著性。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征与分组 504例食管鳞状细胞癌中,男女比约5 ∶1。以中下段食管鳞状细胞癌为主。以中~低分化为主(96.2%)。肿瘤直径以3.3 cm为界值,直径<3.3 cm病例稍多于直径≥3.3 cm的病例数。脉管、神经侵犯的病例数明显少于未侵犯的病例数。根据肿瘤的浸润深度,以T2、T3为主,即癌组织多侵及肌层及外膜层。54.0%的病例未见淋巴结转移。
按照AJCC第8版食管癌分期数值,将肿瘤分期分为Ⅰ+Ⅱ(55.6%)及Ⅲ+Ⅳa(44.4%)两组。根据生存时间分段,将患者分为小于24个月及大于24个月两组。
2.2 食管鳞状细胞癌中EGFR基因扩增与临床病理特征的关系 EGFR-FISH阳性共61例(12.1%),EGFR-FISH扩增共32例(6.3%)(图1,表1)。
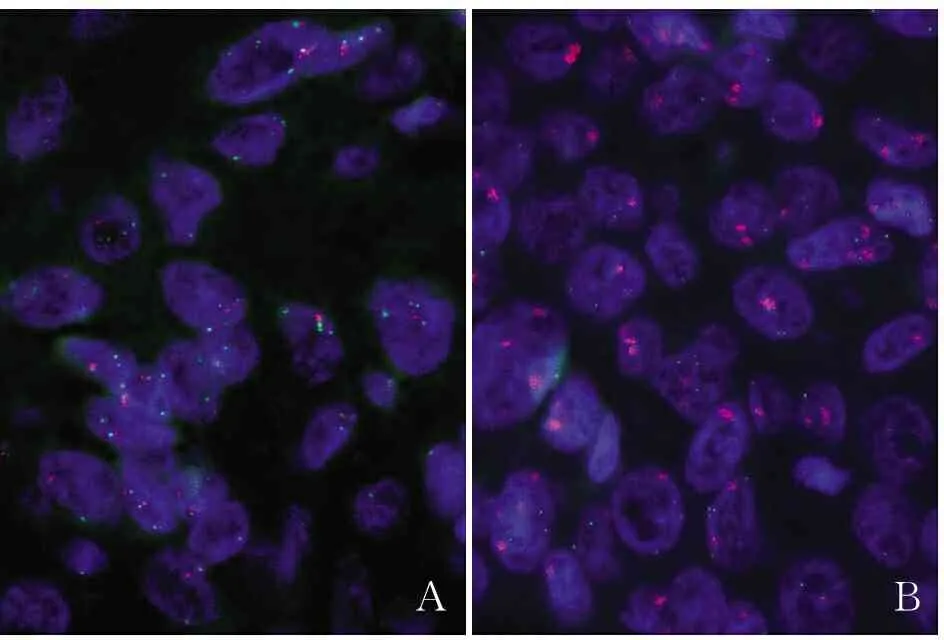
AB
图1 A.EGFR高多倍体:肿瘤细胞内红绿色信号比增加(70%肿瘤细胞拷贝数约≥4);B.EGFR基因扩增:肿瘤细胞内见簇状扩增红色信号(红色信号代表EGFR基因,绿色信号代表CEP7)
2.3 食管鳞状细胞癌中EGFR基因扩增与预后的关系 504例食管鳞状细胞癌患者EGFR-FISH不同检测结果分别在全部患者、Ⅰ+Ⅱ期患者、Ⅲ+Ⅳa期患者、生存期小于24个月患者及生存期大于24个月患者等5种不同人群的DFS及OS中进行预后分析。其中EGFR-FISH阳性与扩增结果对比,在全部患者、Ⅲ+Ⅳa期患者及生存期小于24个月的患者中未显示明显差异,而在Ⅰ+Ⅱ期患者及生存期大于24个月的患者中差异有显著性(表2)。EGFR-FISH扩增在全部患者、Ⅰ+Ⅱ期患者及生存期大于24个月的患者中DFS及OS差异有显著性(图2)。

表1 504例食管鳞状细胞癌中EGFR-FISH结果与临床病理特征的相关性
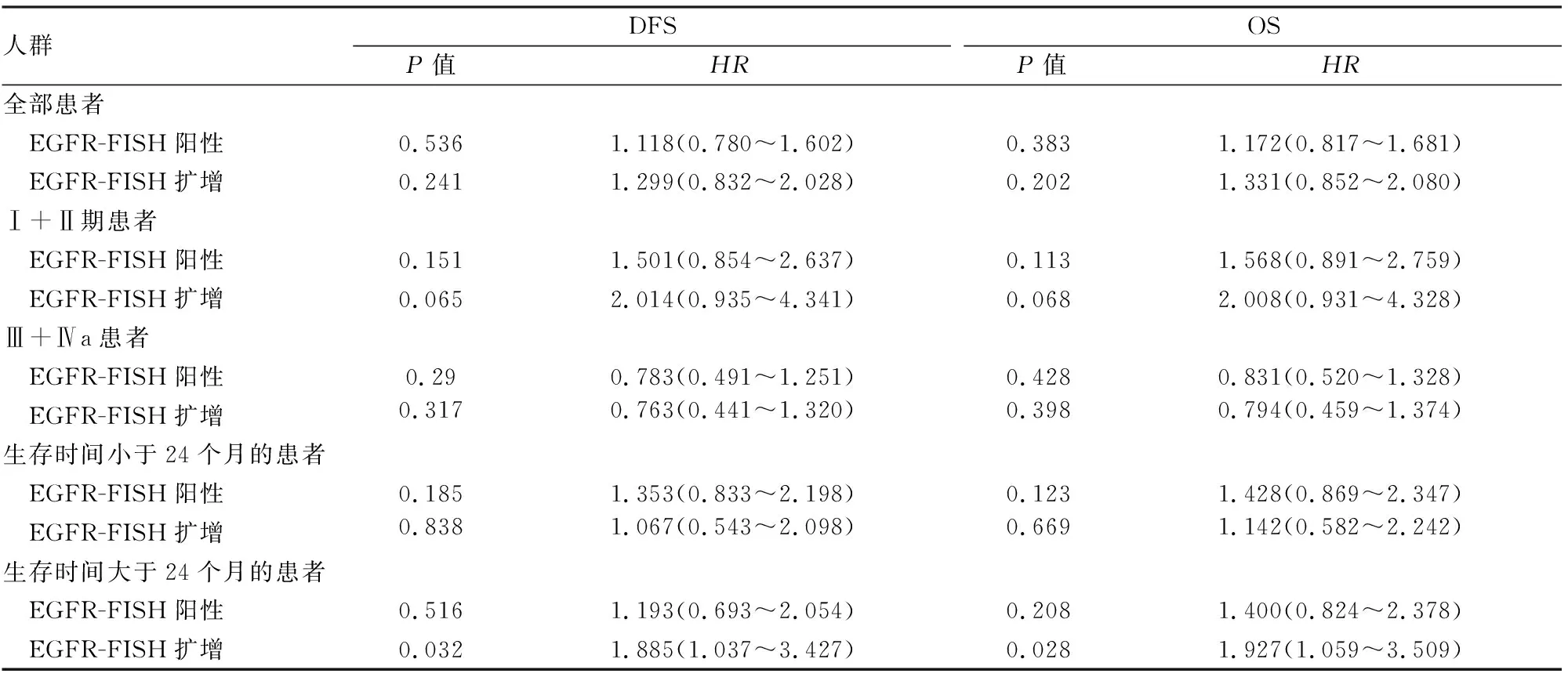
表2 504例食管鳞状细胞癌患者EGFR-FISH检测结果在不同人群中的预后意义

图2 EGFR基因扩增组与非扩增组在总人群(A、B)、Ⅰ+Ⅱ期患者(C、D)及生存时间大于24个月的患者(E、F)中的总生存期和无瘤生存期的生存曲线;0代表EGFR-FISH非扩增组;1代表EGFR-FISH扩增组
3 讨论
中国属于食管癌高危区,鳞状细胞癌是主要的组织学类型。男女间的发生率具有很大的地区差异,在中国主要以男性为主。吸烟是食管鳞状细胞癌发生的一个主要危险因素。食管癌主要位于食管中1/3段,随后依次为下1/3段和上1/3段,有数据显示位于上段和中段的鳞状细胞癌比下段的鳞状细胞癌更具有侵袭性。TNM分期、肿瘤的分化程度及位于食管的位置都作为预后分组因素。此研究数据显示的食管鳞状细胞癌的临床特征与其流行病学调查结果一致,且样本量大,因此通过本组实验分析能充分、准确展示EGFR基因在食管鳞状细胞癌中的作用。
EGFR基因改变在癌中主要分为两类:一类是EGFR基因第18~21号外显子的位点突变,主要发生在亚洲肺腺癌[4];另一类是EGFR基因扩增和蛋白的过表达[5]。EGFR基因在食管鳞状细胞癌中主要是基因拷贝数的改变[6-8],罕见基因位点突变[1,9]。关于EGFR基因扩增与过表达之间的关系在近期很多文献中进行了讨论,两者存在相关性(P<0.01),其中存在基因扩增者均有EGFR蛋白过表达[5]。文献报道显示,具有EGFR扩增和过表达的食管鳞状细胞癌受益于西妥昔单抗治疗[10]。本组实验主要应用FISH技术探索EGFR基因拷贝数的改变在食管鳞状细胞癌中的价值。首先,本组实验用FISH检测EGFR基因变化情况与之前文献报道过的数据一致,包括二倍体、低三倍体、高三倍体、低多倍体、高多倍体及基因扩增[7]。其中EGFR-FISH高多倍体及基因扩增具有较高的比例(12.1%)。文献报道中食管鳞状细胞癌的样本量相对不足(多不足100例),而本组实验共获取504例食管鳞状细胞癌标本,相比更能反映EGFR基因改变在食管鳞状细胞癌中的真实情况。其次,文献中指出EGFR基因扩增状态与患者肿瘤浸润深度、淋巴结转移情况呈正相关,提示EGFR基因拷贝数的增加与肿瘤的浸润、转移等行为密切相关[11]。本组实验利用FISH技术探索EGFR基因拷贝数改变,其中EGFR-FISH阳性包括高多倍体和基因扩增,在探索EGFR基因改变在食管鳞状细胞癌中的价值时,着重分析EGFR-FISH阳性与EGFR-FISH扩增两组。
在EGFR-FISH与临床病理因素的相关性分析中,EGFR-FISH阳性与肿瘤的浸润深度具有一定的相关性,根据TNM分期,EGFR-FISH阳性更常发生于T2、T3中,不出现在T4中,但显著无统计学意义。其他临床病理特征,包括年龄、性别、吸烟史、肿瘤部位、肿瘤大小、分化程度、脉管神经侵犯、淋巴结转移情况及临床分期均无明显相关性。
与EGFR-FISH阳性组不同,EGFR基因扩增与肿瘤浸润深度并无相关性,但在年龄、性别、吸烟史、肿瘤部位、肿瘤大小、分化程度、脉管神经侵犯、淋巴结转移等临床病理特征中,两组相似,均与上述临床病理特征无相关性。然而,EGFR基因扩增与临床分期密切相关,EGFR基因扩增更容易发生于III+IVa期的食管鳞状细胞癌患者。无论DFS或OS,EGFR基因扩增在全部患者及Ⅰ+Ⅱ期患者中均具有更差的预后,尤其是在生存期超过24个月的患者中差异有统计学意义(P<0.05)。
因此,在食管鳞状细胞癌中具有一定比例的EGFR-FISH扩增。EGFR-FISH扩增与临床病理特征密切相关,是食管癌中有价值的预后因子,而且相对EGFR-FISH阳性而言,EGFR-FISH扩增似乎更适合作为临床实践中的参考值。EGFR基因扩增联合其他基因的改变在食管癌中的价值也值得进一步探讨。

