喉鳞状细胞癌中ZNF750的表达及与预后的关系
郭林芝,王 丽,曹红艳,刘青华,闫玲艳,菅晓婷,吴月琴,李灵敏
喉鳞状细胞癌是头颈部最常见的恶性肿瘤之一[1],治疗主要包括手术、放疗和化疗,由于肿瘤具有较强的侵袭性和转移能力,患者术后生存率低,预后较差[2]。寻找与喉鳞状细胞癌侵袭、转移相关的生物学指标,不仅有助于判断预后,而且可以为喉鳞状细胞癌生物学治疗靶点的选择提供依据。ZNF750是ZNF家族中的一员,含有典型的C2H2锌指结构域。ZNF750基因编码的蛋白,通常在复层扁平上皮细胞中表达,是上皮细胞分化的重要调控因子,对增殖相关基因及分化相关基因分别起抑制及促进作用[3]。有研究显示其与食管癌等多种肿瘤的发病及预后密切相关,Lawrence等[4]对肿瘤组学测序数据进行生物信息学分析,发现在头颈鳞状细胞癌中ZNF750的突变显著;Zhang等[5-6]证实食管鳞状细胞癌和口腔鳞状细胞癌中ZNF750是一种肿瘤抑制基因;低表达ZNF750的食管鳞状细胞癌患者预后较差[7];高表达ZNF750的食管鳞状细胞癌患者对放、化疗的敏感性高[8]。目前,ZNF750在喉鳞状细胞癌发病机制中的生物学功能尚不清楚,本实验检测ZNF750在喉鳞状细胞癌中的表达,探讨其与喉鳞状细胞癌临床病理特征的关系及意义。
1 材料与方法
1.1 临床资料 收集2009年1月~2012年1月山西省肿瘤医院手术切除的115例喉鳞状细胞癌标本和56例癌旁正常喉组织标本;另收集6对新鲜喉鳞状细胞癌组织及配对癌旁正常喉组织。所有患者均有完整的临床资料,术前均未接受放、化疗,且术后病理切片均由病理科两位以上病理医师确诊为喉鳞状细胞癌。电话随访患者每3个月1次,随访日期从手术日期开始到患者死亡或术后5年止。
1.2 主要试剂 兔多克隆抗ZNF750抗体购自Proteintech公司,即用型快捷免疫组化EnVision试剂盒购自福州迈新公司。
1.3 方法
1.3.1 免疫组化法检测ZNF750的表达 115例喉鳞状细胞癌标本和56例癌旁正常喉组织标本,均经10%中性福尔马林固定,石蜡包埋,4 μm厚切片。切片常规脱蜡至水,3%H2O2室温孵育10 min,枸橼酸钠缓冲液(pH 6.0)高压修复2 min,晾至室温,10%BSA室温封闭20 min,滴加ZNF750抗体(1 ∶200),4 ℃冰箱过夜。滴加二抗37 ℃ 40 min,DAB显色,苏木精复染,常规脱水、透明、封固;镜下观察、拍照。
1.3.2 Western blot法检测ZNF750的表达 将6对新鲜喉鳞状细胞癌组织和癌旁正常喉组织研碎加入细胞溶解液提取蛋白。用BCA蛋白试剂盒检测提取的组织溶液蛋白浓度,将等量的总蛋白进行电泳分离,转移至PVDF膜,然后用脱脂奶粉封闭,洗膜后放入抗ZNF750抗体(1 ∶500)溶液中,4 ℃摇床过夜。洗膜后放入二抗中孵育,再洗膜,显影。显影后的胶片用Image J软件扫描分析。
1.4 结果判读 ZNF750蛋白阳性信号定位于细胞核,根据细胞染色强度计分:无着色为0分、弱着色为1分、中等着色为2分、强着色为3分;根据阳性细胞所占百分比计分:0~29%为1分、30%~59%为2分、>60%为3分。两者得分相加:≥3分为高表达,<3分为低表达。每张切片分别取5个不同视野进行观察后取平均值。
1.5 统计学分析 采用SPSS 22.0软件对数据进行统计学分析。采用t检验、χ2检验、Kaplan-Meier生存曲线及Cox比例风险回归模型对ZNF750蛋白表达、临床病理特征、总生存期、预后因子的单-多因素分析进行分析,P<0.05为差异有统计学意义。
2 结果
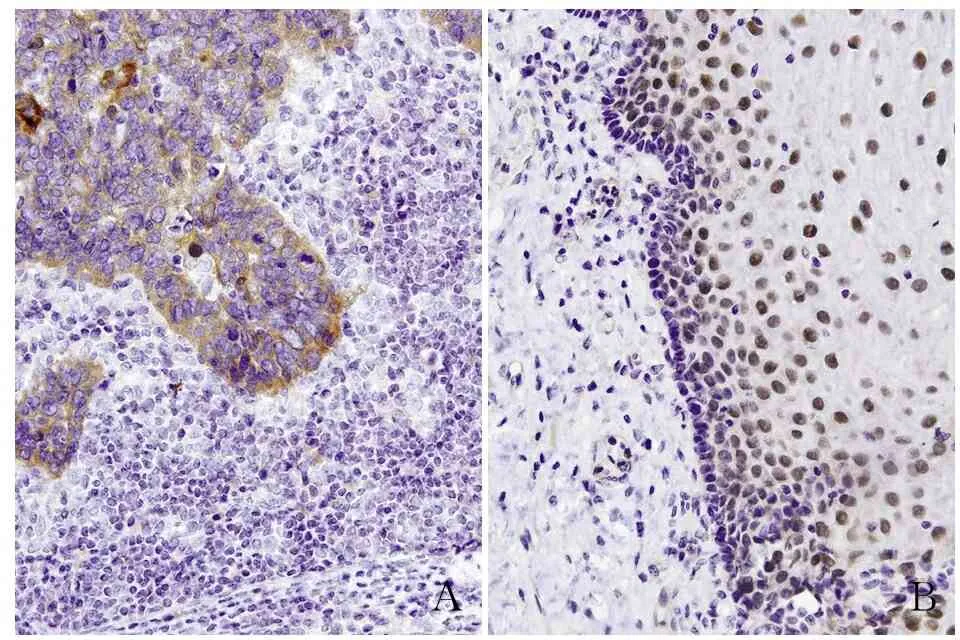
2.1 喉鳞状细胞癌中ZNF750的表达 采用Western blot法检测6对新鲜喉鳞状细胞癌组织及癌旁正常喉组织中的ZNF750蛋白,结果显示ZNF750在喉鳞状细胞癌组织中的蛋白水平明显低于癌旁正常喉组织,差异有统计学意义(P<0.05,图1);免疫组化法检测115例喉鳞状细胞癌组织及56例癌旁正常喉组织石蜡切片,结果显示:ZNF750在喉鳞状细胞癌组织中的表达明显低于癌旁正常喉组织,差异有统计学意义(P<0.05,图2)。

图1 Western blot法检测喉鳞状细胞癌组织和癌旁正常喉组织中ZNF750的表达
2.2 喉鳞状细胞癌中ZNF750表达与临床病理特征的相关性 ZNF750低表达与喉鳞状细胞癌临床TNM分期、淋巴结转移明显相关(P<0.05);ZNF750低表达与患者性别、年龄、吸烟、饮酒及分化程度差异无统计学意义(表1)。
2.3 喉鳞状细胞癌中ZNF750表达与预后的关系 Kaplan-Meier生存曲线结果表明,ZNF750低表达患者的总生存率低于高表达患者(P<0.05,图3),高表达患者5年生存率为78.0%,低表达患者5年生存率为47.3%。单因素分析表明,肿瘤TNM分期、淋巴结转移、ZNF750低表达是影响患者预后的重要因素(P<0.05)。多因素分析表明,ZNF750低表达是喉鳞状细胞癌患者独立的预后因子(P<0.05,表2)。
AB
图2 ZNF750在喉鳞状细胞癌组织(A)和癌旁正常喉组织中(B)的表达,EnVision两步法
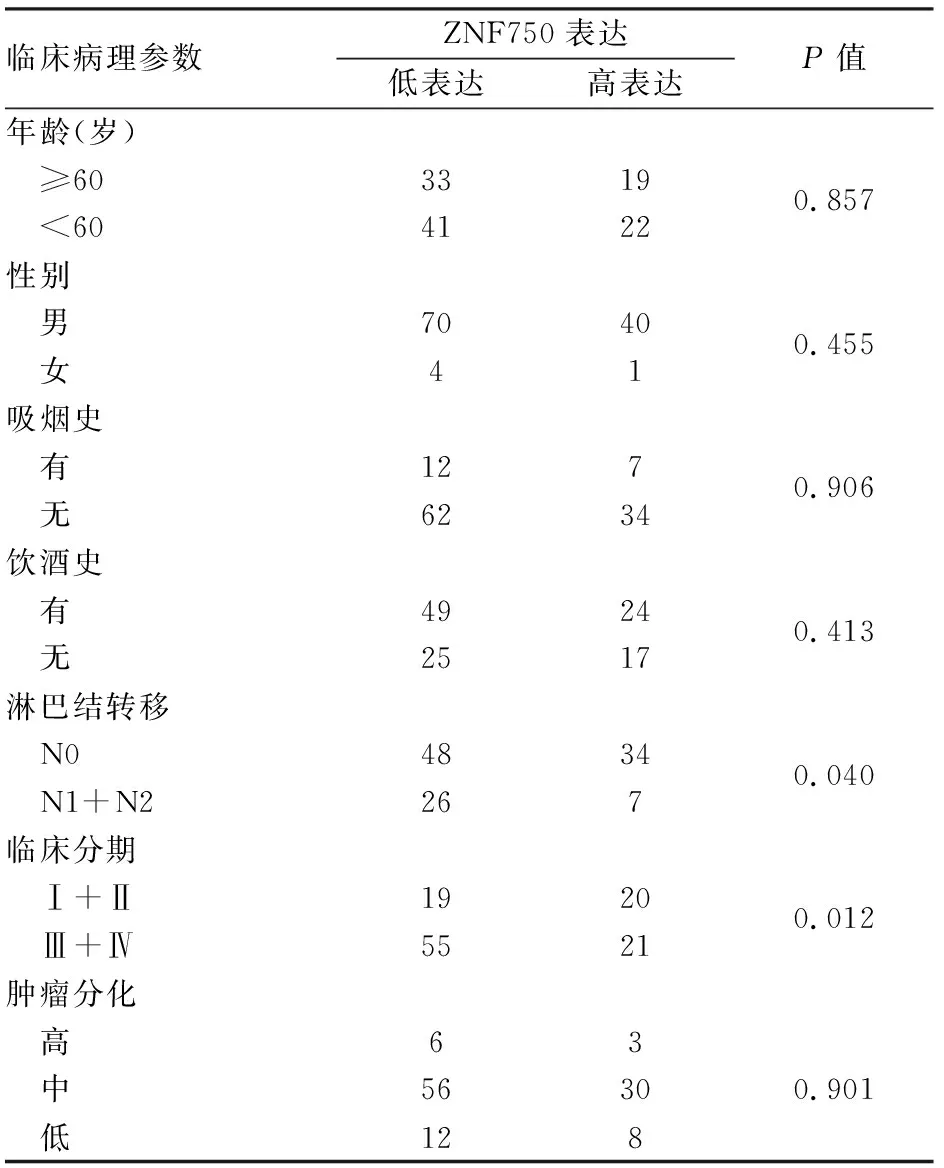
表1 ZNF750表达与喉鳞状细胞癌临床病理特征的相关性

图3 喉鳞状细胞癌ZNF750低表达和高表达患者的生存曲线

表2 喉鳞状细胞癌临床特征与总生存期的单因素与多因素分析
3 讨论
ZNF750基因定位于17q25.3,是编码723个氨基酸的蛋白质,主要表达于复层扁平上皮组织,是角质形成细胞分化的重要调节因子,调节角质形成细胞的终末分化。
文献报道,与正常组织相比ZNF750的表达水平在鳞状细胞癌患者中明显降低[9],ZNF750突变与上皮来源的恶性肿瘤发生、发展有关。ZNF750在鳞状细胞癌中常发生突变,突变点主要位于C2H2锌指结构域,提示锌指结构域在介导ZNF750的抑癌活性中起重要作用[3]。ZNF750通过C2H2锌指结构域与靶基因作用,抑制增殖相关基因(RBBP8、HOMER3)的表达,激活分化基因(PPL、PKP1)的表达[10]。本实验通过Western blot法和免疫组化法对喉鳞状细胞癌和癌旁正常喉组织中ZNF750蛋白表达进行检测,结果显示:ZNF750在喉鳞状细胞癌组织中的蛋白水平明显低于癌旁正常喉组织,提示ZNF750蛋白表达减少与喉鳞状细胞癌的发生有关。目前,ZNF750缺失导致肿瘤发生的机制尚不明确。有研究显示,ZNF750作为一种转录因子,与靶基因RCOR1和CTBP1/2相互作用,抑制增殖相关基因的表达;与靶基因RCOR1、KLF4和CTBP1/2相互作用,激活分化基因的表达[10]。因此,当ZNF750突变后,无法抑制细胞过度增殖,同时细胞分化受损可能是导致肿瘤发生的原因之一。
本实验对ZNF750表达与喉鳞状细胞癌临床病理特征的相关性进行分析,结果显示,ZNF750低表达与临床TNM分期、淋巴结转移显著相关。生存分析结果显示,ZNF750低表达是喉鳞状细胞癌患者预后不良的独立的危险因素,ZNF750低表达患者的总生存率低于高表达患者。以上结果提示,ZNF750低表达与肿瘤的发展及转移密切相关,与Otsuka等[7]的研究结果一致,可能是ZNF750调节一组参与细胞迁移、增殖和黏附的基因,特别是ZNF750直接诱导长链非编码RNA(lncRNA)的表达,lncRNA影响细胞的增殖、周期、凋亡等,与肿瘤的发生、发展密切相关[11];并抑制LAMC2的表达,从而调节癌细胞的增殖和迁移[12]。
总之,本实验结果显示喉鳞状细胞癌组织中ZNF750表达明显减少,ZNF750低表达与喉鳞状细胞癌TNM分期、淋巴结转移及预后有关;提示ZNF750可能是一种新的预后生物标志物,对其调控可能成为喉鳞状细胞癌生物治疗的重要靶点之一。

