社区肺炎链球菌感染药敏分析及分子生物学分型*
向 蓉,黄雪珍,莫和国,徐 宁
南方医科大学附属小榄医院检验科,广东中山 528415
肺炎链球菌是革兰阳性菌、α溶血的兼性厌氧菌。可引起侵袭和非侵袭性疾病,如社区获得性肺炎、中耳炎、脑膜炎和败血症等[1]。在20世纪80年代以前,青霉素是治疗肺炎链球菌感染的一线用药,由于耐青霉素肺炎链球菌的产生,到了20世纪90年代,一线用药改为红霉素。然而,随着抗菌药物的广泛使用,大环内酯类耐药的菌株趋于流行。根据相关报道,肺炎链球菌对β内酰胺类和大环内酯类药物的耐药率居高不下,多重耐药菌约占60%[2-3]。为探讨肺炎链球菌的耐药表型、耐药机制,本研究对184 株肺炎链球菌临床分离株进行了研究。
1 材料与方法
1.1菌株来源 收集、复苏本院2014年1月至2016年12月分离的184株肺炎链球菌菌株,已经剔除重复菌株。菌株来源于痰液标本120株,血液标本31株,脓液标本12株,分泌物标本11株,其他标本10株。
1.2菌株鉴定及耐药分析 所有菌株均经过Vitek 2鉴定,用GP68卡做肺炎链球菌药敏分析。药敏结果判断参考美国临床和实验室标准化协会(CLSI )2016年标准。检测的抗菌药物包括青霉素类(青霉素G、阿莫西林)、头孢菌素类(头孢曲松)、氟喹诺酮类(左氧氟沙星、莫西沙星)、糖肽类(万古霉素)、碳青霉烯类(厄他培南、美罗培南)、大环内酯类(红霉素)、氯霉素类(氯霉素)、恶唑烷酮类(利奈唑胺)、磺胺类(磺胺甲噁唑)、林可酰胺类(克林霉素))药物及四环素。质控菌株为肺炎链球菌ATCC49619。用纸片扩散(K-B)法检测大环内酯类和林可酰胺类药物耐药菌株表型,所用药物为红霉素和克林霉素,由OXOID (UK)公司提供。根据美国临床和实验室标准化协会(CLSI)2016判断标准:红霉素K-B法抑菌圈直径>20 mm为敏感(S),16~20 mm为中介(I),<16 mm为耐药(R);克林霉素K-B法抑菌圈直径>18 mm为S,16~18 mm为I,<16为R。MLSB型(大环内酯类、林可酰胺类药物和链阳霉素B耐药)指对红霉素耐药,对克林霉素中介或耐药。M型(大环内酯类药物耐药)指仅对红霉素耐药,对克林霉素敏感。
1.3耐药基因检测 PCR方法检测耐药基因erm(B)、mef(A)。试剂盒由宝生物工程(大连)有限公司合成,具体检测方法见李静等[4]的报道。基因引物见表1。
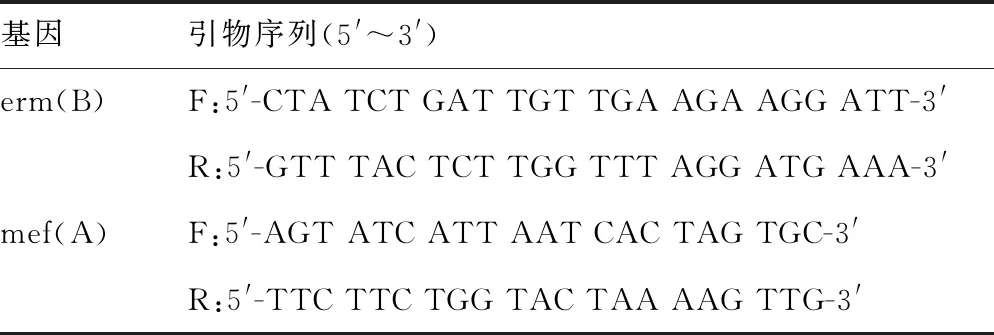
表1 大环内酯类抗菌药物耐药基因检测引物
注:F为上游引物;R为下游引物。
1.4统计学处理 微生物鉴定及药敏数据使用WHONET5.6软件导出,计数资料以例数或率进行描述统计。
2 结 果
2.1肺炎链球菌的药敏情况 耐药表型为MLSB型的菌株有172株(93.5%),未检测到耐药表型为M型的菌株,见表2。

表2 184株肺炎链球菌对常见抗菌药物敏感性结果(%)
2.2肺炎链球菌的耐药基因检测 PCR分析结果显示168株(91.3%)只含有erm(B)基因,3株(1.6%)只含有mef(A)基因,1株(0.5%)既含有erm (B )又含有mef(A)基因。所有耐药表型为MLSB型的菌株均含有erm(B)基因,见表3。耐大环内酯类肺炎链球菌中,有89株(51.7%)对青霉素G耐药,有23株(13.4%)对青霉素G敏感。

表3 184株肺炎链球菌的耐药基因型
注:cMLSB为固有耐药;iMLSB为诱导耐药。
3 讨 论
细菌耐药是指细菌对药物的敏感性下降或者药物对细菌无作用,此时往往需要联合多种药物进行治疗。随着药物的联合应用,多重耐药菌也随之增多。本地区肺炎链球菌对红霉素耐药率为93.3%,对克林霉素耐药率为100.0%,高于文献[5]报道的74.9%和71.7%。对四环素耐药率为87.4%,略微高于林倍州等[6]报道的广东地区的78.9%。四环素耐药基因与erm基因可能存在于同一转座子,因此,肺炎链球菌产生红霉素耐药性的同时可能产生四环素耐药性[7]。本研究结果显示,肺炎链球菌对万古霉素、利奈唑胺的敏感率为100.0%,对左氧氟沙星与氯霉素的敏感率也在95.00%以上。本研究结果显示,本地区大环内酯类药物对肺炎链球菌感染的治疗几乎无效。根据肺炎链球菌对红霉素与克林霉素的耐药性可分为不同的耐药表型[8],即MLSB型与M型。MLSB型又可分为cMLSB型(固有耐药,即对红霉素与克林霉素均耐药)和iMLSB型(可诱导耐药,即对红霉素耐药,对克林霉素抑菌圈减小,出现D环现象)。MLSB型是由erm(B)和(或)mef(A)基因引起。M型仅对红霉素耐药,对克林霉素敏感,只是由mef(A)基因引起。本研究中耐药表型为MLSB型的菌株有172株,其中cMLSB型有165株,iMLSB型有7株,耐药表型为M型菌株有0株。
肺炎链球菌对大环内酯类耐药的主要耐药机制包括:核糖体作用位点的改变,主动外排机制增强,编码核糖体蛋白L4、L22和(或)rRNA235的基因变异等[9]。由erm(B)编码rRNA235的甲基化,导致出现MLSB表型。根据甲基化基因的上游调节序列的不同[10],MLSB表型可分为cMLSB型和iMLSB型。MLSB型对大环内酯类药物高水平耐药(MIC≥64 mg/L)。大环内酯类药物泵外排基因mef于1996年被发现,主要包括mef(A)(最早发现于化脓链球菌)和mef(E)(最早发现于肺炎链球菌)。mef(A)和mef(E)在肺炎链球菌中非常常见。研究表明mef(A)外排泵的特异性底物是十四元环和十五元环大环内酯类药物,mef调节的大环内酯类药物耐药表型是M型[11]。M型通常对大环内酯类药物低水平耐药(MIC为1~32 mg/L)。
本研究中erm(B)基因检出率为91.3%,说明由erm(B)编码的cMLSB耐药表型是中山地区的主要表型。mef(A)基因的检出率为1.6%,但未能检测出M表型,这是因为由mef(A)介导的低水平耐药被由erm(B)介导的高水平耐药掩盖所致[12]。
有报道称,mef(A)和erm(B)基因的流行有明显的地域差异,也可随时间、年龄不同而变化[13]。本研究结果与成都[14]、温州[15]等地区的报道不同,也可能是样本量太小或者入选人群不同而产生的偏倚所致。 进一步研究应当加大样本量,增加入选人群,并动态监测耐药率与耐药基因的变化以更好地了解肺炎链球菌在本地区的流行情况。
综上所述,本地区肺炎链球菌对红霉素与克林霉素的耐药率较高;耐药表型以erm(B)编码的cMLSB耐药表型为主,主要以靶位点的修饰为主,也与泵外排机制有关,耐药基因有地域差异。由于各地区医疗环境、抗菌药物使用习惯等的不同,导致肺炎链球菌对红霉素与克林霉素的耐药基因型和耐药表型检出率有地域差异,因此需要积累数据,动态监测当地耐药菌株流行情况,协助临床合理使用抗菌药物,控制耐药率。

