短梗大参多酚的提取及体外抗氧化性研究
(西南科技大学生命科学与工程学院,四川绵阳 621010)
短梗大参(Macropanaxrosthornii),属五加科(Araliaceae)、大参属(Macropanax),又名七角风、七叶莲、节梗大参,是我国特有的一种小乔木或者常绿灌木,在四川、江西、湖北、贵州、广西、广东、湖南、甘肃、福建等地均有分布[1]。文献记载该植物的根、皮具有驱风除湿、化瘀生新的功效,临床可用于治疗骨折、风湿关节炎、创伤性损伤、婴儿营养不良等疾病[2]。短梗大参的树枝韧皮部含有丰富的膳食纤维和多酚,风味清香,在西昌当地有直接食用的习惯。
多酚是具有多个酚羟基化合物的次生代谢产物,广泛分布于植物的根、皮、叶中,它具有多种生物活性功能,如抗氧化[3-4]、抑菌[5-6]、美容养颜[7]等。多酚常见的提取方法有溶剂提取法、超声波辅助提取法、微波辅助提取法和超临界流体萃取法[8-11]。与传统的溶剂提取法相比,超声波辅助提取能够缩短反应时间和减少溶剂使用量,增加植物中活性物质的溶出量和提取效率;但超声过程中产生的空化效应能使多酚发生氧化,导致活性丧失。超临界流体萃取法对设备的要求高、成本昂贵,在现阶段不适合用于大规模的实际生产。
目前,国内大部分的研究着眼于短梗大参的生理学、植物学方面的特性,关于短梗大参多酚的相关报道几乎没有。因此,本研究通过对短梗大参多酚提取工艺进行优化和抗氧化性测定,以期为短梗大参保健食品的初步应用提供参考。
1 材料与方法
1.1 材料与仪器
短梗大参 2019年3月采自四川省凉山州西昌市(树皮的水分、灰分、纤维素含量分别为4.5%、10.6%和15.7%);没食子酸 上海迈坤化工有限公司;福林-酚 合肥博美生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) Phygene(飞净)生物科技有限公司;水杨酸 天津致远化学试剂有限公司;抗坏血酸 天津北联精细化学有限公司;无水乙醇、甲醇、无水碳酸钠、30% H2O2等 均为国产分析纯。
DHG-9620B恒温鼓风干燥箱 上海琅玕实验设备有限公司;标准检验筛 浙江上虞华丰五金仪器有限公司;HSJ-4 A数显恒温磁力搅拌水浴锅 金坛科析仪器有限公司;5840R高速冷冻离心机 Eppendorf中国有限公司;UV 2400型紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司。
1.2 实验方法
1.2.1 工艺流程 新鲜短梗大参树皮→切碎→干燥(50 ℃恒温烘干)→粉碎→过筛(60目)→筛下物→加入提取剂→恒温水浴振荡(150 r/min)→离心(5000 r/min、10 min)→定容至50 mL→总酚测定
1.2.2 标准曲线的绘制 参考康超等[12]的方法,采用福林酚法制作标准曲线。精确称量0.0050 g没食子酸标准品,用60%乙醇溶液溶解、并定容至10 mL,得到浓度为0.5 mg/mL没食子酸标准液。用移液枪分别量取0.2、0.4、0.6、0.8、1.0 mL的没食子酸标准溶液于10 mL离心管,加入1 mL Folin-Ceocalteu试剂,混匀静置3 min后加入3 mL 10% Na2CO3溶液,并用蒸馏水补齐至5 mL,40 ℃水浴20 min后在760 nm处测定吸光值,同时做空白对照调零。以没食子酸的质量浓度为横坐标、吸光度值为纵坐标,绘制标准曲线,得到回归方程y=9.185x+0.004(R2=0.9995)。
1.2.3 提取液中总酚含量测定 用移液器移取1.0 mL短梗大参提取液,按1.2.2的方法处理后测定吸光度值,并由标准曲线求得提取液中的总多酚含量,结果以每1 g短梗大参中当量没食子酸的含量(mEq GA/g)来表示:

式(1)
式中:C为短梗大参多酚质量浓度,mg/mL;V为提取液体积,mL;n为稀释倍数,m0为短梗大参质量,g。
1.2.4 单因素实验 准确称取0.500 g短梗大参树皮粉末于50 mL 烧杯中,按料液比1∶20 (g/mL)加入提取溶剂,在40 ℃恒温水浴下振荡60 min后于5000 r/min离心10 min,取上清液定容至50 mL。量取0.2 mL提取液,稀释5倍后置于试管中,测定多酚的提取量,操作步骤同1.2.2。
1.2.4.1 提取溶剂对短梗大参总酚提取量的影响 固定料液比1∶20 (g/mL)、提取温度40 ℃、提取时间60 min,设定提取溶剂为水、无水乙醇、60%甲醇、60%乙醇,研究提取溶剂对短梗大参总酚提取量的影响。
1.2.4.2 乙醇体积分数对短梗大参总酚提取量的影响 固定料液比1∶20 (g/mL)、提取温度40 ℃、提取时间60 min,设定乙醇体积分数为40%、50%、60%、70%和80%,研究乙醇体积分数对短梗大参总酚提取量的影响。
1.2.4.3 料液比对短梗大参总酚提取量的影响 固定乙醇体积分数60%、提取温度40 ℃、提取时间60 min,设定料液比为1∶10、1∶20、1∶30、1∶40和1∶50 (g/mL),研究料液比对短梗大参总酚提取量的影响。
1.2.4.4 提取温度对短梗大参总酚提取量的影响 固定乙醇体积分数60%、料液比1∶30 (g/mL)、提取时间60 min,设定提取温度为30、40、50、60、70 ℃,研究提取温度对短梗大参总酚提取量的影响。
1.2.4.5 提取时间对短梗大参总酚提取量的影响 固定乙醇体积分数60%、料液比1∶30 (g/mL)、提取温度50 ℃,设定提取时间为40、50、60、70、80 min,研究提取时间对短梗大参总酚提取量的影响。
1.2.5 正交试验 在单因素实验的基础上,以乙醇体积分数、料液比、提取温度和提取时间为试验因素,总酚提取量为响应值,采用L9(34)正交表进行正交试验,其因素水平表如表1所示。
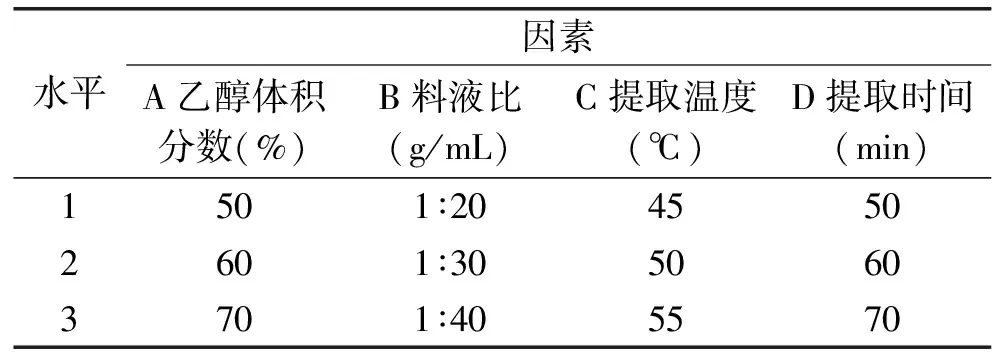
表1 正交试验因素水平表Table 1 Factors and levels table of orthogonal test
1.2.6 抗氧化活性的测定
1.2.6.1 DPPH自由基清除率的测定 参考盛周煌等[13]的方法,具体如下:准确称取0.0060 g DPPH,用无水乙醇溶解并定容到200 mL,得到浓度为75 μmol/L的DPPH溶液,避光保存备用。取1 mL不同浓度梯度的短梗大参多酚提取液于试管中,加入4 mL DPPH溶液,摇匀后在暗处避光放置反应30 min,于波长517 nm处测吸光度值A1。用等量无水乙醇代替DPPH,和样品液反应测吸光度值A2,空白组以等量提取溶剂代替样品液,和DPPH反应后测得吸光度值A0,阳性对照用VC代替提取液。 DPPH自由基清除率的计算如式2所示:
式(2)
式中:A1为1 mL 样品液+4 mL 75 μmol/L DPPH溶液的吸光度值;A2为1 mL 样品液+4 mL无水乙醇吸光度值;A0为1 mL 提取溶剂+4 mL 75 μmol/L DPPH溶液吸光度值。
1.2.6.2 羟基自由基清除率的测定 羟基自由基清除能力是抗氧化剂还原力、供氢能力和活性氧清除能力的综合体现,其大小反映了抗氧化剂延缓氧化诱导期开始的能力[14]。羟基自由基清除率的测定参考Zhou等[15]的方法,并加以修改,向25 mL试管中依次加入1.0 mL 6 mmol/L FeSO4溶液、2.0 mL去离子水或不同浓度样液、1.0 mL 6 mmol/L H2O2溶液,混匀并静置10 min后加入0.60 mL 6 mmol/L水杨酸乙醇溶液,混匀、静置10 min后于510 nm处测定吸光值A0、Ai,同时将H2O2用去离子水代替,测得吸光值Am,阳性对照用VC代替提取液。羟基自由基清除率计算如式3所示:
式(3)
式中:A0为1.0 mL 6 mmol/L FeSO4+1.0 mL 6 mmol/L H2O2溶液+0.6 mL 6 mmol/L水杨酸-乙醇溶液+2.0 mL去离子水的吸光度值;Ai为1.0 mL 6 mmol/L FeSO4+1.0 mL 6 mmol/L H2O2溶液+0.6 mL 6 mmol/L水杨酸-乙醇溶液+2.0 mL样品液的吸光度值;Am为1.0 mL 6 mmol/L FeSO4+1.0 mL 去离子水+0.6 mL水杨酸-乙醇溶液+2.0 mL样品液的吸光度值。
1.2.6.3 半清除浓度(EC50)值的计算 利用SPSS 21.0软件进行回归分析,在软件参数设置中,观测值汇总选择100%,模型选择Logit,响应频率为清除率,协变量为浓度,选择对数底为10的转换,分析处理即可得到EC50值。
1.3 数据处理
每个试验点平行重复3次,结果以平均值±标准差(Mean±SD)的形式表示。数据显著性(P<0.05)分析采用SPSS 21.0,图形的绘制采用Origin软件。
2 结果与分析
2.1 单因素实验结果分析
2.1.1 提取溶剂对总酚提取量的影响 从图1可以看出,不同的提取溶剂对短梗大参多酚的提取效果有所不同,其中60%甲醇对短梗大参多酚的提取效果最好,60%乙醇和水次之,无水乙醇的提取效果最差,这与郑翠萍等提取苦菜多酚的结果(提取效果:乙醇>甲醇>丙酮>水)相反,可能是原料的差异引起[16]。就本次试验而言,60%甲醇和60%乙醇对短梗大参多酚的提取量分别是0.272和0.265 mEq GA/g,差异不显著(P>0.05),出于操作安全和成本的综合考虑,选择60%乙醇溶液作为短梗大参多酚的后续提取溶剂。

图1 提取溶剂对总多酚提取量的影响Fig.1 The effect of different solventon extraction yield of total polyphenols
2.1.2 乙醇体积分数对总多酚提取量的影响 从图2可以看出,多酚提取量呈现先上升后下降的趋势。乙醇体积分数在40%~60%时,短梗大参多酚提取量随着乙醇体积分数增加而升高,60%乙醇溶液提取时提取量最大;当乙醇体积分数高于60%时,多酚提取量随乙醇体积分数的增加逐渐下降,可能是醇溶性物质、色素等在乙醇体积分数较高时溶解度较高,多酚和乙醇-水分子的结合被这些物质抑制。同时,植物的细胞结构也会因乙醇体积分数过高发生失水现象,通透性变低,多酚的渗出受到影响,导致多酚提取量下降[17-18]。

图2 乙醇体积分数对总多酚提取量的影响Fig.2 The effect of volume fraction ofethanol on extraction yield of total polyphenols
2.1.3 料液比对总多酚提取量的影响 如图3,料液比在1∶10~1∶30 (g/mL)区间时,短梗大参多酚的提取量随着提取溶剂用量的增加而升高,料液比为1∶30 (g/mL),短梗大参多酚的提取量最高,为0.318 mEq GA/g,原因可能是固液间的质量浓度梯度是提取物发生转移的动力,溶剂用量的增加有利于提高质量浓度梯度,提取物的溶出因此得到增加[18],但当料液比达到某一极限时,溶液和原料中的多酚达到平衡状态,多酚的渗出受到抑制。料液比过高会增加后续的浓缩以及纯化成本,所以选择1∶30 (g/mL)的料液比较为适宜。

图3 料液比对总多酚提取量的影响Fig.3 The effect of ratioof material to liquidon extraction yield of total polyphenols
2.1.4 提取温度对总多酚提取量的影响 如图4所示,在一定温度范围内,总多酚提取量随温度增加而增加,原因可能是随着温度升高,颗粒充分溶胀,分子运动加剧,结合的多酚类化合物易于溶出;另外一方面,过高的温度会破坏多酚的结构,或使多酚发生氧化[19-20]。因此选择50 ℃作为之后因素的固定条件。

图4 提取温度对总多酚提取量的影响Fig.4 The effect of temperatureon extraction yield of total polyphenols
2.1.5 提取时间对总多酚提取量的影响 从图5可以看出,总多酚提取量随提取时间的变化呈现先逐渐上升再平缓下降的趋势。提取时间在40~70 min时,多酚提取量随着时间的增加而升高,提取时间越长,多酚提取量越高。在70 min时多酚提取量最高,为0.322 mEq GA/g;在60 min时多酚提取量为0.318 mEq GA/g,与70 min下的提取量无显著性差异(P>0.05);在80 min时,多酚提取量下降,可能是长时间的提取破坏了多酚结构。因此选择提取时间60 min作为较优水平。
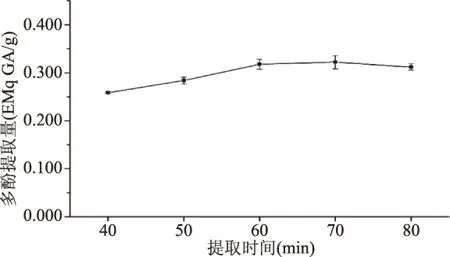
图5 提取时间对总多酚提取量的影响Fig.5 The effect of time on extraction yield of total polyphenols
2.2 正交试验结果
2.2.1 极差分析结果 以单因素试验为基础,设计L9(34)正交表进一步优化工艺参数。通过EXCEL和SPSS软件进行分析,利用极差分析法和方差分析法确定最优工艺条件,结果如表2。
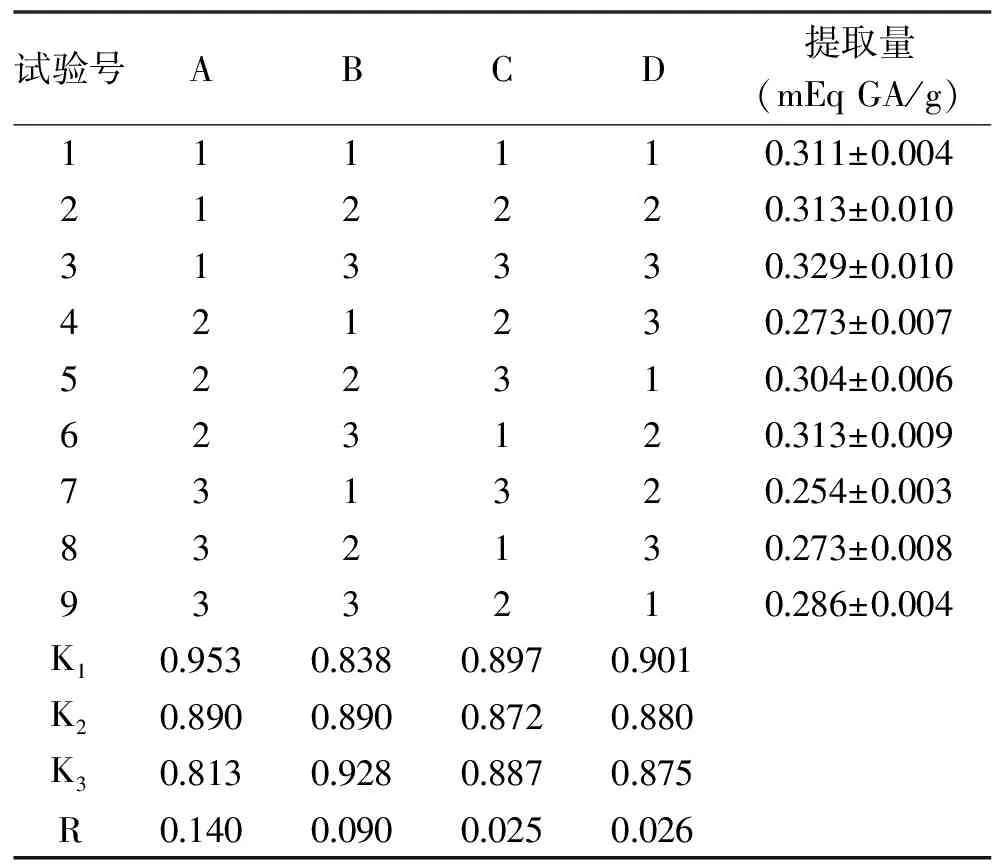
表2 正交试验结果Table 2 The results of orthogonal test
根据极差值R的大小,对因素进行主次排序,R值越大,表明该因素对多酚提取量的影响越大。由表2比较本试验中4 个因素的R值,主次从大到小的排序为乙醇体积分数>料液比>提取时间>提取温度。
2.2.2 方差分析结果 由表3可知,乙醇体积分数、料液比、提取时间对短梗大参多酚提取量都具有显著(P<0.05)的影响,实验范围内的提取温度无显著(P>0.05)影响。综合极差分析结果得出,短梗大参多酚提取的最优条件为A1B3C1D1,即乙醇体积分数50%、料液比1∶40 (g/mL)、提取温度45 ℃、提取时间50 min为理论上提取短梗大参多酚的最优工艺条件,此组合未在正交表组合里,需做验证试验,用于判断理论最佳组合是否最优。在上述最佳水平组合条件下,重复提取3次,多酚提取量为(0.320±0.02) mEq GA/g,说明最佳工艺条件具备可行性、且重现性好,为提取短梗大参多酚的最优工艺条件。

表3 正交试验的方差分析Table 3 Analysis of variance for the orthogonal test
2.3 抗氧化活性试验结果
2.3.1 短梗大参多酚对DPPH自由基的清除效果 从图6中可看出,短梗大参多酚对DPPH自由基的清除率随着溶液的质量浓度升高而增加,并且呈现一定的量效关系。在质量浓度在12.5~87.5 μg/mL时,短梗大参多酚对DPPH自由基的清除率略高于等量的VC溶液,继续增加质量浓度,多酚样品与VC对DPPH自由基的清除率基本相当。利用SPSS计算出短梗大参多酚和VC对DPPH自由基清除的EC50,分别是43.4和60.6 μg/mL,说明短梗大参多酚具有良好的DPPH自由基清除效果。
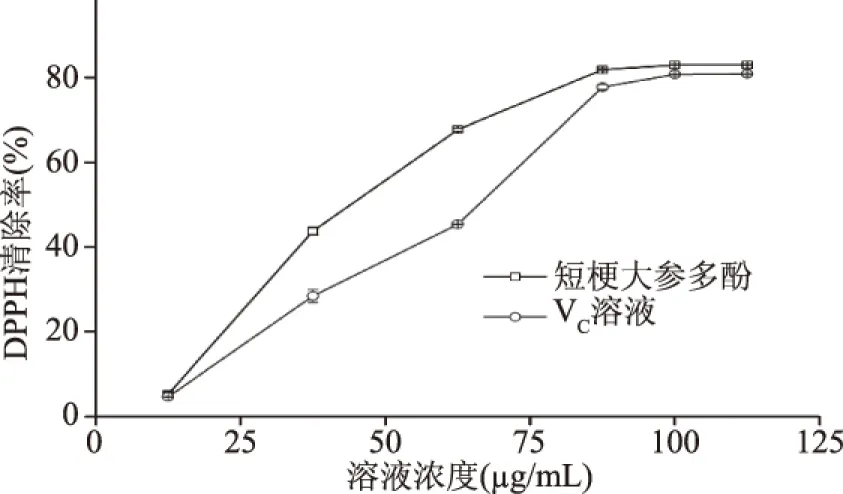
图6 短梗大参多酚对DPPH自由基的清除作用Fig.6 Scavenging effect of polyphenols extractedfrom Macropanax rosthornii on DPPH free radical
2.3.2 短梗大参多酚对羟基自由基清除效果 如图7所示,短梗大参多酚和VC对羟基自由基的清除率都随着质量浓度升高而增加,在质量浓度12.5~100 μg/mL的区间时,多酚样品液与VC的清除率并无显著差异(P> 0.05),两者的EC50值分别为37.6 和43.7 μg/mL。
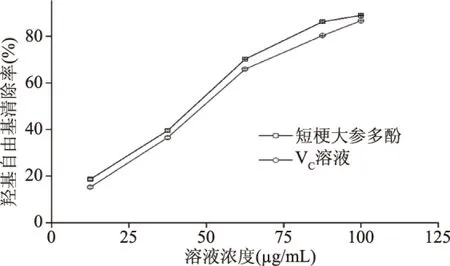
图7 短梗大参多酚对羟基自由基的清除作用Fig.7 Scavenging effect of polyphenols extractedfrom Macropanax rosthornii on hydroxy radical
3 结论
单因素和正交试验优化得出短梗大参多酚的最佳提取工艺参数为乙醇体积分数50%、料液比1∶40 (g/mL)、提取时间50 min、提取温度45 ℃,在该工艺条件下多酚提取量为(0.320±0.02) mEq GA/g。短梗大参多酚对DPPH和羟基自由基均具有良好的清除效果,其EC50值分别为43.4和37.6 μg/mL,与VC的EC50值60.6和43.7 μg/mL相比,短梗大参多酚活性略强于VC。此文仍采用传统的浸提法,在保护多酚活性不受影响的前提下,尚需开发短梗大参多酚的高效提取方法。本实验得到的样品为粗提物,尚需进一步的分离纯化以提高有效成分的活性,若作为工业用抗氧化剂,还需开展相关毒性实验。

