无导线心脏起搏现状
关 付, 李广平, 2
(1. 首都医科大学附属北京世纪坛医院 心内科,北京 100038;2. 天津市心血管病离子与分子机能重点实验室,天津医科大学第二医院心脏科,天津心脏病学研究所,天津 300211)
目前全球每年起搏器置入数量超过一千万,大多为传统起搏器,即皮下置入起搏器脉冲发生器连接经静脉置入的电极导线。但传统起搏器面临的一些局限和不足值得关注。起搏器患者发生并发症的概率约10%,其中大多与电极导线或起搏器囊袋相关。电极导线多导致急性期并发症如气胸或上肢深静脉血栓形成等,也偶有慢性并发症如中心静脉阻塞,三尖瓣关闭不全以及感染等。即使是单腔起搏器,其并发症风险虽然比双腔起搏器低,却也有1/40患者在术后3个月内发生严重的并发症需要外科干预,其一半以上与电极导线有关[1]。
目前新兴的无导线心脏起搏(leadless cardiac pacing, LCPs),通过精细的递送系统将无导线起搏器置入右心室,很大程度上克服了上述传统起搏器的局限性和不足。在外观上,无导线起搏器的无线设计精巧,无需外科切口制作皮下囊袋[2]。1979年文献中首次报道了经颈静脉递送导管,经导管将无导线起搏器置入完全性房室传导阻滞的猪右心室,并维持了2个月的起搏治疗。之后的20年里研究者们陆续做临床前试验,进一步证实了无导线单腔起搏的可行性。目前无导线起搏有两种基本设计,一种是心内膜下起搏电极和皮下能量传输器两部分元件的组合,另一种是脉冲发生器和起搏电极组合为一个元件。目前有两家商业化的无导线起搏器,即Micra(Medtronic, Minneapolis, Minnesota) 和Nanostim (St. Jude Medical, St. Paul, Minnesota)[3]。
鉴于近年来无导线起搏在单腔起搏、双腔起搏以及左心室起搏方面有很多临床应用,尤其在单腔起搏以及左心室起搏方面的研究和优势凸显,本文拟就无导线起搏器的应用进展做一综述。
1 无导线起搏器在右心室单腔起搏中的应用
无导线右心室单腔起搏是一体化设计,即脉冲发生器和感知/起搏电极合为一体,完全去掉了电极导线、囊袋制作以及系统内连接元件。术者以患者股静脉为入路,将设备送入右心室间隔部位,获得稳定持续的感知和起搏参数后释放固定。如前所述,目前临床上有两种无导线起搏器已经正式应用,即Nanostim LCP(St. Jude Medical, Inc., St. Paul, Minnesota)和Micra Transcatheter Pacing System (TPS) (Medtronic, Inc., Minneapolis, Minnesota)。图1显示了TPS的保护鞘、固定机制和双极感知和起搏特性, 而图2示例了TPS置入[4]。装置可经导管回收。
LEADLESS研究(Nanostim Safety and Performance Trial for a Leadless Cardiac Pacemaker System, LEADLESS)首次对LCPs临床效果和安全性进行了多中心临床研究。入选患者均具备单腔右心室起搏(VVI/VVIR)适应证,即:①永久性心房颤动伴房室传导阻滞(AVB)(包括心房颤动伴慢心室率);②正常窦性心律下存在Ⅱ度或Ⅲ度AVB,体力活动少或预期寿命短者;③窦性心动过缓伴不规律停搏或电生理检查无法解释的晕厥。排除标准包括起搏器依赖、明显肺动脉高压或三尖瓣置换术后、起搏器/ICD电极置入术后或下腔静脉滤网置入者。共有33例患者入选,平均手术时间是(28±17)min,94%(33例中31例)无任何并发症。术后随访3个月和1年,起搏阈值、阻抗和感知保持稳定,未发生起搏装置相关的并发症,无电池提前耗竭或过感知、感知不良等,且19例患者达到充分的频率适应[5]。

图1 经导管置入无导线起搏器的固定机制。Micra在退出保护鞘时,暴露齿爪,但末端与递送鞘管接口处连接 a.为退保护鞘,暴露齿爪;b.为齿爪完全反折暴露,Micra仍在鞘内;c.示退鞘,Micra系着于递送导管接口

图2 无导线起搏器的置入 a.递送鞘和起搏器置于右心室心尖;b.齿爪暴露,阳极与心肌接触;c.起搏器末端与递送鞘管连接时进行位点测试(牵拉试验)。RAO:右前斜投照体位
在无导线单腔右心室起搏的安全性和有效性方面,LEADLESS Ⅱ和TPS研究(Micra Transcatheter Pacing Study, TPS)中也进行了进一步评估。LEADLESS Ⅱ研究共纳入526例患者,Nanostim-LCP置入成功率95.8%,术后6个月随访,电池平均寿命是15年,器械相关严重不良事件发生率6.7%,其中包括器械脱位后静脉回收(1.7%),心脏穿孔(1.3%),以及起搏阈值增加后需要经静脉回收及重置(1.3%)[6]。同样,TPS试验中来自19个国家的56个中心的共725名患者术后随访结果显示,术后6个月起搏阈值低且稳定,无1例装置脱位,而主要并发症如心脏损伤、静脉穿刺并发症及血栓栓塞等较对照组无显著增加[7]。近年来临床上大量研究已经证实了无导线单腔右心室起搏的长期有效性、安全性以及可回收性[8]。对于临床上有单腔起搏适应证而又不适合经静脉置入传统起搏器的患者,这足以作为医生选择替代治疗的有利依据。但关于无导线起搏能否替代传统经静脉起搏或心外膜起搏的前景问题,尚需更加充分的实验证据支持。
无导线起搏器最明显的优势是无静脉电极导线[9]。脉冲发生器的感知电极的整体结构体积小,一体化的设计使得整个操作无需外科切口或皮下囊袋,减少了切口相关并发症,当然也更加美观。除了体积小,在电池续航时间上LCP与传统经静脉单腔起搏器相当。LCP采用高密度单氟化锂碳电池, 遥测采用节能的传导技术而非感应技术。电池剩余寿命通过特定算法精确预测,能够在提示起搏器电池耗竭需更换时依旧保障6个月的正常功能。LCP和TPS均可以在特定条件下进行MRI(Magnetic Resonance Imaging, MRI)检查。对于操作本身,常用的股静脉途径置入无导线起搏器时放射球管距离术者较远,可减少术者放射线的暴露。由于其在设计和置入方法上的优势,对于股静脉入路无法应用者亦可经颈内静脉入路成功置入[10]。不仅如此,对于目前临床上合并其他心脏血管有创性治疗的患者,如股静脉滤器置入术后或三尖瓣置换术后患者,目前均有Micra成功置入经验[11-12]。
2 无导线起搏器在双腔起搏中的应用
上述的LCP和TPS无导线起搏仅局限于单腔右心室起搏。对于大多数有双腔起搏适应证的患者,右心室起搏比率减低会有更多获益。在心脏再同步化治疗适应证人群,单腔无导线起搏并不适宜[13]。因此,双腔无导线起搏的需求和获益更加值得关注,由此衍生了多部位无导线起搏。
图3所示,多部位无导线起搏的概念是双腔无导线起搏协同工作[14]。为了达到同步化,这些装置需建立无线连接。典型的无导线双腔起搏工作模式为:心房的无导线起搏器刺激右心房后,将同步信息输送到心室的无导线起搏器,后者接收信息并形成房室传导延迟,产生一个心脏周期的激动。无导线起搏每次要消耗5~10 mV的能量,因此对电池容量的要求比较严格,所以这种房室连接需要节能以免影响电池寿命。传统心脏置入装置在体内的无限数据连接通常采用射频遥测和诱导偶联技术。对比而言,原电池(伽凡拟电池)偶联的体内连接是在两个置入器械之间进行信息传输,组织(心肌和血液)将作传导介质,电流在组织内扩散至另一个装置接收[15]。该起搏器的安全性和多位点起搏的可行性已经在体内进行了测试并达到较满意结果。在3例体外试验中,该工作原型起搏器达到了稳定的双腔DOO模式起搏。图4中ECG显示了无导线双腔起搏模式下心房和心室的起搏信号。类似双心室起搏也在左心室和右心室的检测中得到较好结论。
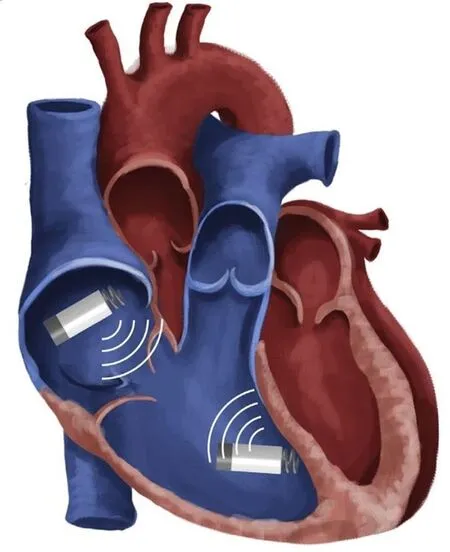
图3 双腔无导线起搏器。右心房、右心室分别置入无导线起搏器,二者通过无线连接而达到工作同步化
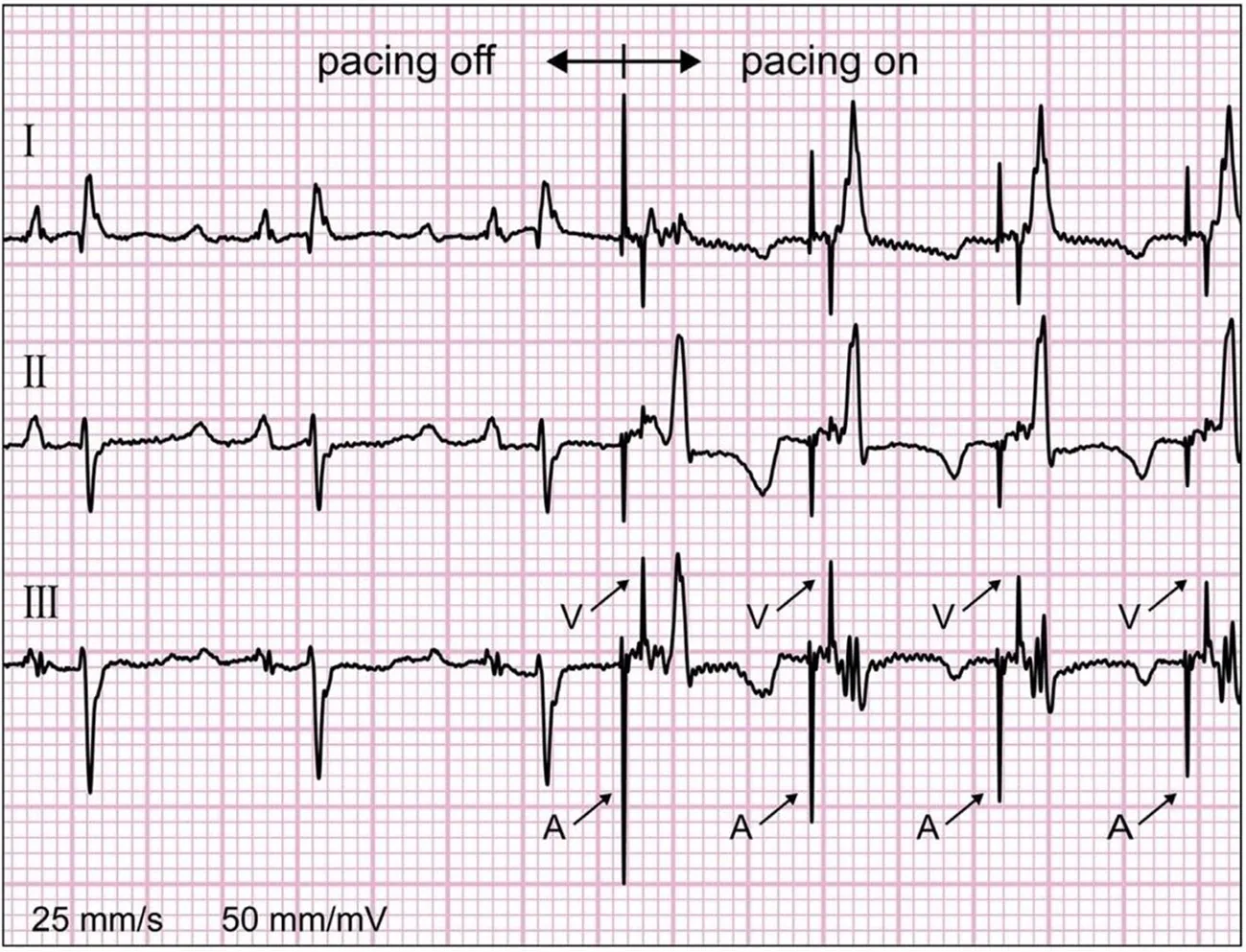
图4 双腔无导线起搏器工作时记录到的体表心电图。右心房右心室分别置入无导线起搏器后双腔起搏记录的心电图,自身心率98次/min,双腔DOO起搏频率为120次/min,其AV间期为50ms。箭头指示为A(心房)和V(心室)起搏信号
目前无导线连接技术的关键在于整合。装置需要导管辅助下置入,所以心脏空间限制是技术上的主要困难。目前基本设计显示电极距离越远、表面积越大,电极的信号衰减越低。商业化无导线起搏器的电极距离(Nanostim: >10 mm; Micra: 18 mm)比较乐观,这样可以避免周围组织因素对起搏参数和感知信息的干扰。另外,低频信号可以阻止传统无线传输(如蓝牙、紫蜂)的非正常侵入造成的干扰。设想一下,该无线双腔起搏模式再加上一个左心室的无导线起搏,无导线起搏概念可以延伸至心脏再同步化治疗中。但是双腔无导线起搏器仍然需要进一步的深度测量和研究,目前仅有3例动物模型成功案例,可见这种实验原型起搏器在心内膜起搏的长期工作需要进一步证实。相对而言,目前有一些单腔无导线起搏Nanostim和Micra联合全皮下ICD(implantable cardioverter defibrillator, ICD)的报道。如果将其列入双腔无导线起搏(除颤)治疗范畴,则双腔无导线起搏治疗已有临床可行性证据。临床上有治疗成功的案例,如2017年报道的Micra联合全皮下ICD置入,患者自发室速后Micra支持下ICD完成有效除颤,这足以证实该技术的前景[16]。
3 无导线起搏器在左心室起搏中的应用
2001年发表的MUSTIC(Multisite Stimulation in Cardiomyopathy, MUSTIC)研究显示了CRT(cardiac resynchronization therapy)使症状性心衰伴左心室射血分数减低、QRS时限延长的患者获益。研究提出CRT通过协调左右心室收缩以及房室传导时间来改善左心室收缩功能、逆转负性重塑,明显减低心力衰竭相关住院率及死亡率,并改善患者生存率和生活质量[17]。通过冠状窦(coronary sinus, CS)电极进行左心室心外膜起搏是CRT的首选方法,但30%~40%的患者却对这种传统的CRT无反应[18]。CRT反应是多因素决定的,其中包括了适应证的选择、器械程控、合并症以及心力衰竭的药物治疗等。8%~10%的CRT适应证患者存在解剖异常,包括没有合适的CS靶点、上腔静脉堵塞、膈神经刺激或瘢痕区起搏导致的阈值异常升高等,这些都会导致CRT反应不佳甚至不得不放弃传统CRT治疗。在CARE-HF研究(Cardiac Resynchronization-Heart Failure study)中首次置入CRT患者就有12%存在左心室电极无法植入问题,这其中50%是由于无法找到CS或合适靶静脉,而且即便是CS电极置入成功也无法达到收缩最延迟部位存活心肌而无法获益于双室起搏[19]。在冠状静脉起搏失败患者中,可以尝试外科心外膜电极置入以及穿间隔的方法,虽然方法有效但是亦要警惕其并发症和死亡率增加的风险。
基于上述问题,无导线左心室心内膜起搏在心脏再同步化治疗领域逐渐显现优势。无导线左心室起搏(WiSE-CRT, EBR Systems, Sunnyvale, California)意为将小型无导线起搏电极经股动脉置入左心室心内膜,这一操作简便且无需长期抗凝。WiSE-CRT在左心室心内膜置入接收电极,通过皮下置入肋间的脉冲发生器来传输超声波进行无导线起搏。WiSE-CRT需要与同时安装的传统右心室起搏器配合工作组成双心室心内膜起搏(BiV ENDO)才能发挥CRT功能。WiSE-CRT感知右心室起搏后,传输声能到达左心室电极引起左心室起搏,从而完成右心室和左心室的几乎同步起搏。WiSE-CRT(Wireless Stimulation Endocardially for CRT)研究证实了无导线超声介导左心室心内膜起搏的可行性[20]。研究中,入选患者均已置入起搏装置如起搏器或ICD,并符合以下条件:①之前冠状窦电极置入失败;②之前冠状窦电极成功置入但是临床无反应或③需要升级成CRT。装置细节和置入过程如图5所示[21]。首先经导管置入左心室起搏电极后再行外科皮下置入脉冲发生器。WiSE-CRT装置需要同时置入标准的起搏器、经静脉ICD或传统CRT装置达到同步化双室起搏。传输器和电池包膜的外面有感知电极,用以感知置入起搏器的右心室起搏脉冲。当右心室起搏脉冲被感知后,WiSE-CRT系统即刻触发超声波转化接收转换为电能,起搏左心室。整个过程几乎同时发生,足以达到双室起搏(右心室起搏脉冲的感知时间和左心室起搏的时间延迟差仅为3~5ms)。从有效性看WiSE-CRT的结果很好,在术后6个月随访中患者左心室功能得到明显改善,且无需终身抗凝,70%患者术后心功能得到明显改善。虽然最初进行到第17例时心包压塞发生3例,导致其安全性遭到质疑,但经过后续技术设备改良结果乐观。
如上所述,经过不断探索,为避免置入过程中递送鞘管对左心室心内膜面的损伤,起搏器的递送系统设计得到不断改进。在SELECTIVE-LV研究(Safety and Performance of Electrodes Implanted in the Left Ventricle)中,递送鞘管远端设计的球囊装置可以大大减少对左心室心内膜的创伤。对于传统CRT左心室电极无法置入的患者,SELECTIVE-LV研究结果如下:①左心室无线起搏置入成功率高(97%);②85%患者术后心力衰竭临床综合评分改善;③52%患者术后6个月心脏超声显示CRT超反应(左心室收缩末容积减低≥15%)。在PROSPECT(Predictors of Response to CRT)研究中,69%患者临床综合评分得到改善,56%患者左心室收缩末容积缩小>15%[22]。另外在SELECTIVE-LV研究中,也有再同步化治疗后心脏电重构的证据,可能与CRT超反应相关。该试验中无术后心包积液病例,也没有术中相关的即刻不良事件发生,证实了WiSE-CRT系统的临床可行性。可见,对于需要CRT升级、或从未接受CRT治疗或已接受CRT治疗后无反应的患者,他们有CRT适应证却由于上述原因无法置入传统左心室电极,左心室无导线起搏治疗在这类人群中的应用有广阔前景。
图5 左心室内膜下无导线起搏器 a~b.逆向递送鞘管输送起搏电极至左心室内膜并定位后释放;c.起搏电极的实际照片和尺寸;d~f.示无导线起搏装置,以及整个装置置入术后1天拍摄的后前位及侧位X线影像,虚线圈内为无导线左心室起搏电极
如前所述,在临床研究中获益的患者均是传统CRT无反应或者由于解剖因素不能进行传统左心室电极置入者。值得关注,心内膜下左心室起搏的前景灵活,尤其在选择避开瘢痕组织以及膈神经刺激等靶点方面心内膜左心室起搏更有优势。心内膜下起搏在心肌激活模式上更加接近生理性起搏,因此在改善血流动力学及缩窄QRS时限方面较心外膜起搏具有更多临床获益,且左心室心内膜起搏减低心室复极化离散度,与心外膜起搏比较亦可更好的减少心律失常发生[23]。CRT无反应的因素并非单一,但至少无导线起搏器会有助于解决其中左心室电极置入困难、左心室瘢痕或冠状窦解剖异常等相关的问题,从而增加CRT手术成功率。WiSE CRT系统可谓走向无导线CRT的第一步,紧接着出现的新型心律调节系统(Boston Scientific Inc, USA)也已经开始临床试验应用,这一系统是由抗心动过速左心室无导线起搏与皮下除颤器通过无线连接协调工作组成[24]。总之,无导线双心室起搏心内膜与传统CRT孰优孰劣,目前的研究结果仍很乐观。
4 总 结
目前的一体化无导线起搏器最主要的局限性是只能提供单腔起搏,即右心室单腔起搏,其频率适应功能的可靠性和安全性尚需要长期随访。作为新兴技术,我们需要专业的培训机制以期达到置入技术的精细化和正规化。如果考虑其长期的性能和未来拔除的需要,无导线起搏器固定机制仍需进一步探索优化。对于大多数窦房结功能障碍的患者,无导线右心室单腔起搏器因为需要从双腔起搏/感知获益所以并不适宜[25]。随着多腔起搏(房室和双室)逐渐发展,无导线多腔起搏从原型变成临床应用所面临的挑战也在增加,比如器械之间的通讯以及固定机制(在组织结构特殊的右心房)等。毋庸置疑,心脏起搏器的未来方向仍是最小化,无导线起搏器作为这一阶段的变革性技术,不论从安全性角度还是从远期起搏和感知功能上都应优于传统起搏器,故仍需进一步技术性探索和临床随机试验来迎接尚未解决的问题。

