石墨烯/二氧化锰复合材料的制备及其电化学性能的研究
李静梅,张 辉
(沈阳化工大学 材料科学与工程学院, 辽宁 沈阳 110142)
电动汽车市场的兴起和便携式电子产品的日益增长,刺激了人们对高性能储能设备的需求,介于传统电容器和电池之间的超级电容器(又名电化学电容器)作为一种新型储能装置,具有优良的功率密度、快速充放电速率、长的循环使用寿命以及低维护成本等优点[1-4],成为满足人们迫切需求和缓解能源危机的一个重要突破口.近些年来,将石墨烯用于超级电容器电极材料的研究日益增加[5-7].新型碳材料石墨烯具有优异的电化学性能,这主要归因于其超高的理论比表面积(2 600 m2/g)远高于其他碳材料,如果比表面积的有效释放加上石墨烯优良的电导率将有利于双电层的形成和电荷的快速移动[8-9],使其成为一种很好的储能材料.然而石墨烯的不可逆团聚大大降低了其比表面积,严重限制了其在超级电容器中的应用.目前可以通过复合、表面改性、修饰等手段优化石墨烯的结构,克服其缺陷以实现性能的有效发挥.赝电容电极材料二氧化锰具有较高的理论比电容量、储量丰富、价格低廉、环境友好[10]等优点成为一种极具吸引力的电极材料,但二氧化锰导电性差的本征性缺陷极大地降低了其比电容量从而限制了它的商业化应用.为了实现材料结构性能最优化,可考虑以石墨烯作为高导电性的基体,引入纳米级二氧化锰制备复合电极材料,克服二者缺陷,并利用协同效应增强材料的性能.目前制备石墨烯/二氧化锰复合材料的方法主要有化学共沉淀法[11-12]、水热法[13-15]、浸渍法[16-17]、物理超滤法[18]、电化学沉积法[19]、微波辅助法[20]等.其中水热法具有操作简单、安全、条件易控制、产物结构性能较好以及适合大规模生产应用等优点.因此本文采用水热法,以氧化石墨烯(GO)分散液、高锰酸钾和硫酸锰为前驱体,合成了石墨烯/二氧化锰(RGO/MnO2)复合材料,并系统研究了GO/硫酸锰的配比、水热反应的时间与温度、pH对二元复合材料的结构、形貌和电化学性能的影响.
1 实验部分
1.1 氧化石墨烯的制备
用双氧水和浓硫酸对天然鳞片石墨粉进行预处理制备化学膨胀石墨(CEG)[21],以此为原料采用改进Hummers 法制备氧化石墨烯,过程如下:1 g CEG,0.5 g 硝酸钠,40 mL浓硫酸依次加入到250 mL 的三口烧瓶中,冰浴磁力搅拌30 min;然后缓慢加入4 g 高锰酸钾,继续反应30 min,随后升温至35 ℃反应2 h;用分液漏斗加入46 mL去离子水,并升温至80 ℃继续反应15 min;反应结束后,移出水浴冷却10 min 加入280 mL去离子水,滴加双氧水搅拌至无气泡冒出,静置分层,倒出上清液,沉淀离心,用稀盐酸洗涤3遍,再用去离子水洗至近中性;最后的产物在真空烘箱中55 ℃烘干,研磨成粉备用.
1.2 石墨烯/二氧化锰复合材料的制备
称量30 mg 的氧化石墨烯超声2 h 分散在30 mL 的去离子水中,得到1 g/L 氧化石墨烯分散液.按照m(氧化石墨烯)∶m(硫酸锰)=1∶0.5、1∶1、1∶2、1∶3、1∶4、1∶5、1∶7、1∶8称取相应量的硫酸锰,加入氧化石墨烯分散液中搅拌1 h.按照n(硫酸锰)∶n(高锰酸钾)=3∶9(以下同)称量相应量的高锰酸钾,将其溶于10 mL去离子水中,搅拌均匀,并缓慢加入到氧化石墨烯/硫酸锰混合溶液中磁力搅拌10 min,随后倒入50 mL不锈钢反应釜的聚四氟乙烯内衬中,在一定温度(100 ℃、120 ℃、140 ℃、160 ℃、180 ℃)下反应不同时间(2 h、4 h、6 h、8 h、12 h、15 h).反应结束后自然冷却至室温,用去离子水反复洗涤,并在55 ℃真空烘箱中干燥24 h,研磨成粉待用.研究pH的影响时,通过1 mol/L盐酸和氨水调节混合溶液的pH值至1、4、7和9,其他反应条件相同.
1.3 材料的表征
采用傅里叶红外光谱仪(NEXUS-470)和粉末X射线衍射仪(D8-Advance)分析样品的结构和成分;采用扫描电子显微镜(JEOL JSM-6360LV)和X射线能谱(EDS)观察不同反应条件下样品形貌的变化及其表面元素分析.
1.4 电化学性能测试
工作电极的制备:将石墨烯/二氧化锰复合材料、导电炭黑和PTFE乳液按照质量比85∶10∶5的比例混合,乙醇为溶剂,混合成泥状涂抹在1 cm×1 cm 的泡沫镍上,55 ℃烘箱干燥2 h,然后用压片机在10 MPa 压力下进行压片.
通过瑞士万通电化学工作站测试分析材料的电化学性能.测试体系为三电极:对电极为铂片电极,参比电极为饱和甘汞电极,电解液为1 mol/L 的Na2SO4溶液.CV曲线测试的电势窗为-0.2~0.8 V,EIS谱图测试频率为100 kHz~0.01 Hz.
2 结果与讨论
2.1 水热反应条件对石墨烯/二氧化锰复合材料结构形貌的影响
图1为氧化石墨烯(GO)和不同反应条件下制备的RGO/MnO2复合材料的红外光谱图.
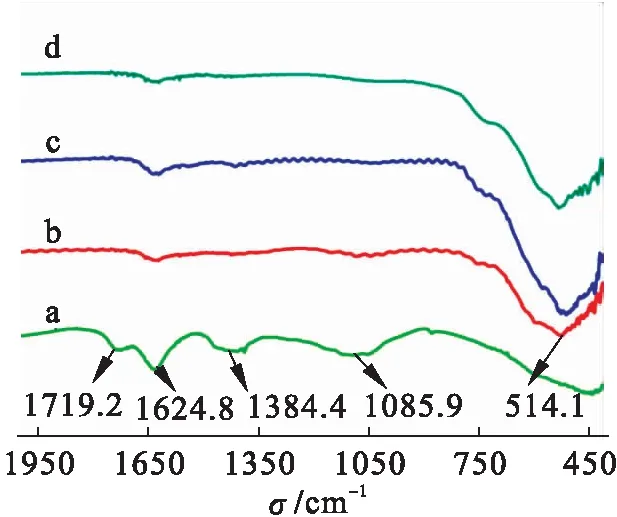
图1 氧化石墨烯和不同反应条件下制备的RGO/MnO2复合材料的红外光谱
a为GO的红外光谱图,在1 719.2、1 624.8、1 384.4和1 085.9处出现特征吸收峰,分别对应于羰基或羧基的C==O的伸缩振动、苯环中C==C的骨架振动、C—O—C的伸缩振动以及C—OH的伸缩振动,这表明氧化石墨烯片表面分布大量的含氧官能团.MnO2在514.1处出现一个较宽的吸收峰,对应于Mn—O的伸缩振动.在b[m(GO)∶m(硫酸锰)=1∶4,水热反应时间8 h、温度140 ℃,pH=2.4]、c[m(GO)∶m(硫酸锰)=1∶4,水热反应时间12 h、温度140 ℃,pH=2.4]和d[m(GO)∶m(硫酸锰配比)=1∶4,水热反应时间12 h、温度140 ℃,pH=9]条件下合成的石墨烯/二氧化锰复合物的红外图谱中,氧化石墨烯的特征峰大大减少,出现了二氧化锰的特征吸收峰,说明经过水热反应氧化石墨烯表面的大部分含氧官能团被去除,复合材料为石墨烯和二氧化锰混合物.
图2是还原石墨烯、氧化石墨烯和 δ-MnO2的XRD图谱,由衍射图谱可知:氧化石墨烯在2θ为11.4° 时出现一个尖锐的特征吸收峰,对应于(002)晶面,其层间距(0.77 nm)远大于石墨的层间距(0.34 nm),说明氧化石墨烯表面含有大量官能团;经过水热还原的石墨烯在23.6° 左右出现一峰宽较大的衍射峰,对应的d值为0.38 nm;水热合成的MnO2在12.2°、24.6°、37.4° 和65.9° 出现4个吸收峰,对应于 δ-MnO2的标准PDF卡片.
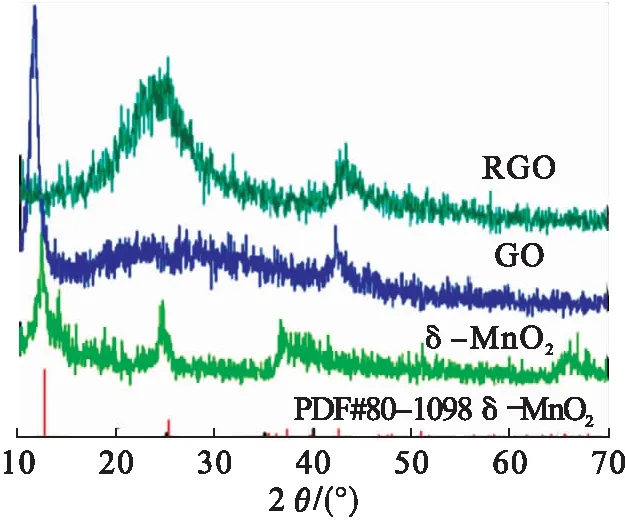
图2 RGO,GO和 δ-MnO2的XRD衍射图谱
图3为不同反应条件下合成的石墨烯/二氧化锰复合材料的XRD谱图.从图3可以看到:氧化石墨烯在11.4°的特征吸收峰消失,表明氧化石墨烯被还原,其结构发生变化,但复合材料中并未出现石墨烯的特征吸收峰,而出现了二氧化锰的特征吸收峰,结合红外谱图分析可推测石墨烯表面可能被大量二氧化锰包覆.
图3(a)为水热反应温度140 ℃,反应时间12 h,pH=9,不同GO/硫酸锰质量比的石墨烯/二氧化锰的XRD图谱.当原料的质量比为1∶0.5、1∶1和1∶2时,生成了石墨烯/MnCO3和石墨烯/MnO(OH)复合物;当质量比1∶3和1∶4时,出现了 δ-MnO2的特征吸收峰;继续增加锰源至质量比为1∶5和1∶7时出现了 α-MnO2的吸收峰;当质量比达到1∶8时,δ-MnO2相消失,出现MnO(OH)相.上面的分析说明在氧化石墨烯/二氧化锰水热反应体系中,低质量浓度的二氧化锰处于亚稳态,在水热过程中会转变成另一种物相,随着二氧化锰质量浓度、K+质量浓度的增加,二氧化锰的数量和片层尺寸逐渐增大趋于稳定.
图3(b)为GO/硫酸锰质量比为1∶4,水热反应温度140 ℃,pH=9,不同反应时间的石墨烯/二氧化锰的XRD图谱.由图3(b)可知:水热反应2 h时生成了 δ-MnO2,延长反应时间到4 h,出现了α-MnO2,继续反应到8 h和12 h时 α-MnO2相消失,只存在 δ-MnO2相.以上结果说明最初生成的 δ-MnO2热稳定性较差,随着水热反应时间的延长,δ-MnO2向 α-MnO2转变,最后又转变为 δ-MnO2,这可能是受氧化石墨烯还原过程中石墨烯片结构和体系压力的影响.
图3(c)为GO/硫酸锰质量比为1∶4,水热反应时间12 h,pH=9,不同反应温度的石墨烯/二氧化锰复合材料的XRD图谱.由图3(c)可知:当反应温度为100 ℃、120 ℃和140 ℃时均生成了石墨烯/δ-MnO2复合物,继续升温至160 ℃和180 ℃时 δ-MnO2逐渐转变为 α-MnO2和MnO(OH).上述分析表明:该水热反应条件下生成的复合材料在一定温度范围内(100~140 ℃)的热稳定性较好;继续升温到180 ℃,MnO2的晶型发生转变,甚至部分被还原成MnO(OH),这可能与水热反应体系的物相和压力随温度升高而不断变化以及氧化石墨烯的进一步还原有关.
图3(d)为GO/硫酸锰质量比为1∶4,水热反应温度140 ℃,反应时间12 h,不同pH值的石墨烯/二氧化锰复合材料的XRD图谱.不添加pH值调节剂时,氧化石墨烯/硫酸锰混合体系的pH值为2.4,水热合成得到石墨烯/δ-MnO2复合材料;用1 mol/L盐酸调节pH值至1时合成了石墨烯/α-MnO2复合材料;滴加氨水调节pH值到4和7时,MnO2以 δ 相和 α 相共存;继续增加pH值到9时,复合材料中的二氧化锰全部为 δ 相.以上结果说明二氧化锰的晶型随着体系pH值的变化而变化,碱性环境更利于 δ-MnO2的合成.

图3 不同反应条件制备的RGO/MnO2复合材料的XRD衍射图谱
图4是GO/硫酸锰质量比分别为1∶4、1∶5和1∶7时石墨烯/二氧化锰复合物的SEM图.GO/硫酸锰质量比为1∶4时,低倍镜下[图4(a)]可以看到石墨烯片表面被大量的二氧化锰包裹;高倍镜下[图4(b)]可以看到二氧化锰呈片层状分布在石墨烯表面,进一步放大可以看到二氧化锰片层相互聚集堆叠团簇成近似纳米花状,这与水热合成的单相 δ-MnO2形貌相似.GO/硫酸锰质量比为1∶5和1∶7时,低倍镜下[图4(c)、图4(e)]可以发现随着原料比例的增加,石墨烯表面逐渐出现棒状二氧化锰颗粒,且棒状颗粒逐渐增多;在高倍镜下[图4(d)、图4(f)]可以进一步清楚看到石墨烯片表面分布着片状二氧化锰和棒状二氧化锰,这一形貌的变化与前面的XRD衍射图谱分析结果相一致.
图5为GO/硫酸锰质量比为1∶4,水热反应温度140 ℃,pH=9,水热反应时间分别为2 h、8 h和12 h的石墨烯/二氧化锰的SEM图.由图5可以看出:当反应时间为2 h时生成了片状MnO2,其片层尺寸大小不一,尺寸分布较宽,较小的片层在石墨烯表面团聚成一堆,且分布不均匀;随着反应时间延长到8 h和12 h,可以明显发现MnO2片层尺寸变大,分布较均匀且片层堆叠形成纳米花状,这种形态增加了MnO2的比表面积,有利于电荷的储存.
图6为GO/硫酸锰质量比为1∶4,水热反应温度140 ℃,反应时间12 h不同pH值下的石墨烯/二氧化锰复合物的SEM图.

图4 不同GO与硫酸锰质量比的RGO/MnO2复合材料的SEM照片

图5 不同反应时间的RGO/MnO2的SEM照片
从图6可以看出:当pH值为4时MnO2呈碎片状分布在石墨烯片表面,这些片层尺寸较小且相互团聚,降低了材料的比表面积,不利于电荷储存;pH值为7时可以发现片状MnO2间出现大量棒状MnO2,此时MnO2的晶型由 δ 晶型部分转变为 α 晶型,与上述的XRD结果一致;当pH值为2.4和9时MnO2片层尺寸增大,堆叠成大片纳米花,有利于电子的储存.结合XRD分析推测MnO2结构和形貌的变化可能由于形成的MnO2晶核表面的电荷极性随pH值的变化而变化[22],当pH值为1时MnO2晶核质子化带正电吸附MnO4-离子,MnO4-离子与溶液中的Mn2+反应并沿着其优先吸附的方向进行各项异性生长,当pH值增大到9时,二氧化锰晶核去质子化表面带负电荷,吸附Mn2+和K+,高浓度的K+有利于 δ-MnO2的生成,帮助维持其层状结构.
图7是GO/硫酸锰质量比为1∶4,水热反应时间12 h,水热反应温度140 ℃和pH=9的石墨烯/MnO2复合材料的EDS能谱.从图7可以看出样品中含有Mn、O、C和K四种元素.Mn元素和O氧元素主要来源于复合材料中的二氧化锰,C元素可能来源于基底导电胶、样品表面吸附的二氧化碳以及石墨烯.此外能谱中Mn元素出现较强的吸收峰,说明被测样品表面含有大量Mn元素,结合红外、XRD以及SEM图可以推测石墨烯表面被大量二氧化锰包覆.K元素的出现是由于前驱体高锰酸钾产生的,这在MnO2的合成过程中会经常发生.




图6 不同pH值的RGO/MnO2复合材料的SEM照片
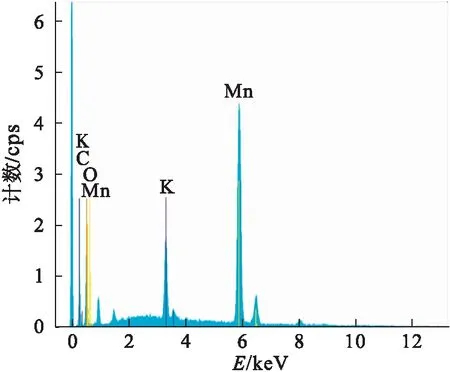
图7 RGO/MnO2复合材料的EDS谱图
2.2 复合材料的电化学性能
图8为扫描速率5 mV/s时复合材料的CV曲线以及相对应的阻抗谱图.由图8可以看出:所有的CV曲线谱图形状均近似于矩形没有明显的氧化还原峰,说明复合材料具有良好的双电层电容性能.从图8(a)可以看出材料的比电容随着GO/硫酸锰质量比的增加先增大后减小,在质量比为1∶4时达到最大.这是由于复合材料中二氧化锰的含量不断增加导致材料的比电容量增加,达到1∶4之后,大量的二氧化锰包裹在石墨烯片表面并团聚阻碍了电荷的传递导致材料的比电容量降低.从图8(b)对应的EIS谱图可以看出:随着GO/硫酸锰质量比的增加,电极材料与电解液的接触电阻和电荷传递电阻先减小后增大;质量比为1∶4时,接触电阻和电荷传递电阻最小,质量比为1∶7时的最大.这是由于比例的不断增加,使复合材料中MnO2的含量增加,大量导电性较差的二氧化锰包裹在石墨烯片表面并团聚导致材料的阻抗值增加.从图8(c)可以看出:随着反应时间的延长,复合材料的比电容不断增加,对应的阻抗谱中材料的电荷传递电阻逐渐减小[见图8(d)],在反应时间为12 h 时材料的比电容量达到最大.这可能是随着水热反应时间的延长,氧化石墨烯不断被还原,导电性逐渐增强,同时二氧化锰随着水热反应时间的延长片层逐渐增大堆叠成纳米花状,有利于离子的储存.
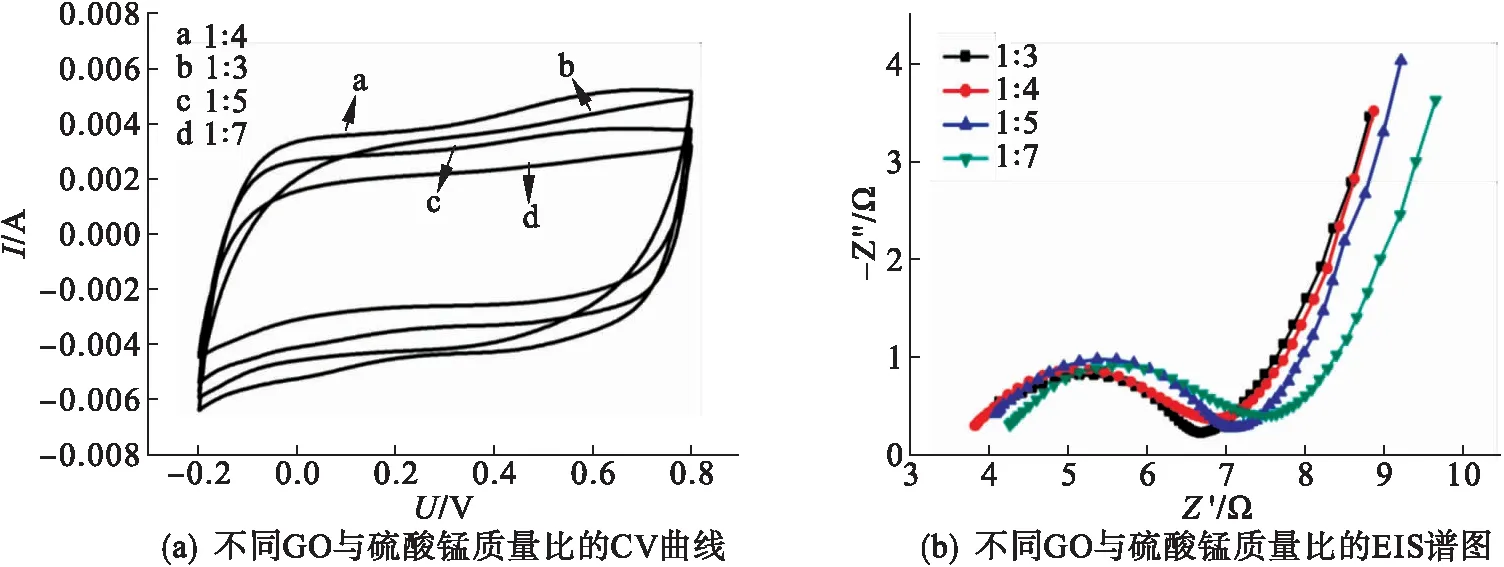
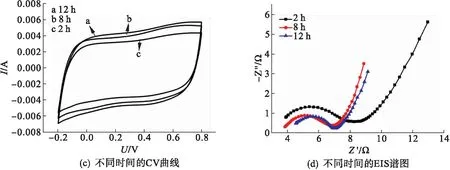
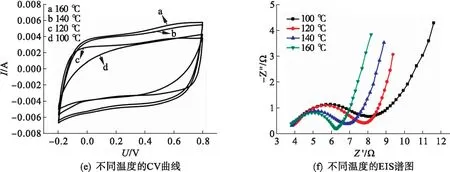

图8 不同反应条件下的RGO/MnO2的CV曲线和EIS谱图
从图8(e)可以看出:随着反应温度的升高,材料的比电容逐渐增大,电荷传递电阻逐渐减小,温度为160 ℃的材料的性能最好.这一变化规律与反应时间影响结果相类似,说明氧化石墨烯的不断还原以及MnO2结构形貌的变化是影响材料电化学性能的原因.从图8(g)可以看出:随着pH值的不断增大,复合材料的比电容先减小后增大;材料的接触电阻和电荷传递电阻先增大后减小,pH值为9时材料的电容量最大.这是由于pH值为4和7时部分层状 δ-MnO2转变为棒状 α-MnO2,使得材料的阻抗值增大.
图9为m(GO)∶m(硫酸锰)=1∶4,水热反应温度140 ℃,水热反应时间12 h的石墨烯/二氧化锰复合材料在不同扫描速率2 mV/s、5 mV/s、20 mV/s、50 mV/s和100 mV/s下的CV曲线以及对应的比电容曲线.
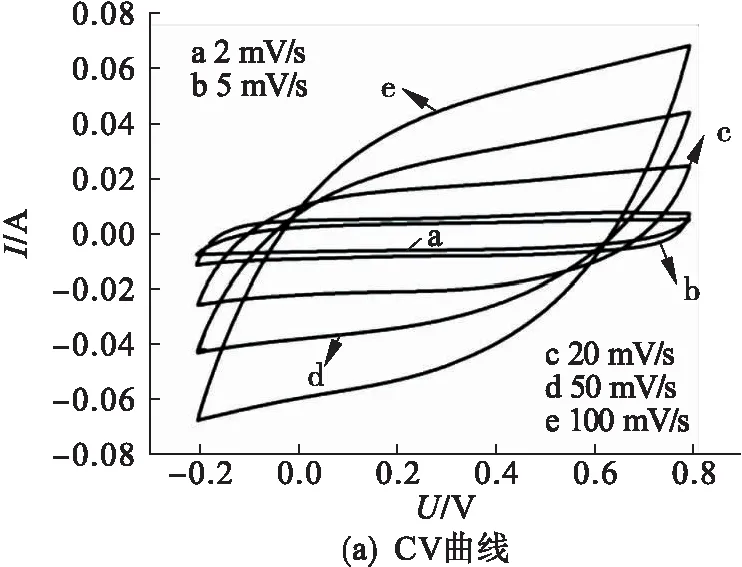
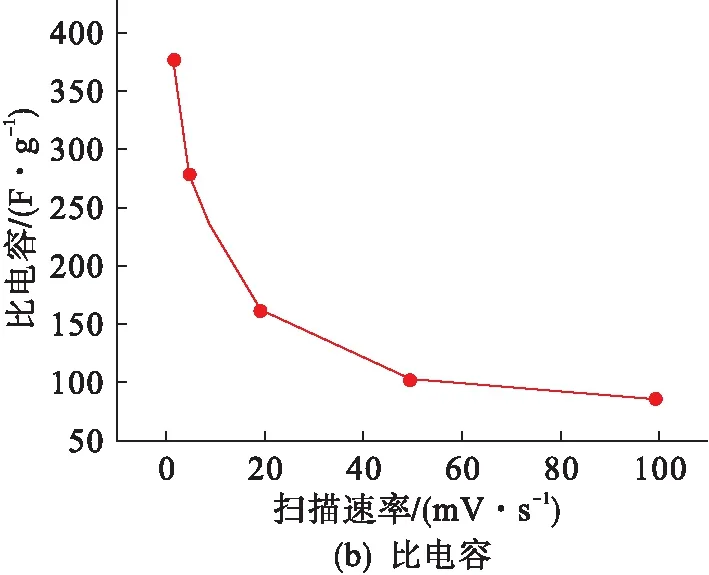
图9 RGO/MnO2复合材料在不同扫描速率下的CV曲线以及对应的比电容曲线
2 mV/s扫描速率下的曲线呈现规整对称的矩形,对应良好的双电层电容性能,此时材料的比电容值达到最大(380 F/g).随着扫描速率的不断增大,CV曲线的形状和对称性并未发生太大的变化,表明材料的电荷传递电阻较小,具有良好的电容性能.复合材料较好的电容性主要归功于石墨烯与MnO2之间的协同效应,石墨烯具有优异的导电性,然而其易团聚,使比表面积极大地降低,MnO2理论比电容量较大但本征导电性差,通过二者的复合,将MnO2片嵌入石墨烯片层中阻止其团聚,同时石墨烯作为一个电子聚集的基板提高MnO2的导电性,二者相互作用提高复合材料整体电容性能.
3 结 论
通过水热法成功合成了石墨烯/二氧化锰复合材料.分析结果表明:复合材料呈现一种包覆状结构,二氧化锰有效嵌入石墨烯片层之间和包覆在其表面,既阻止了石墨烯片的团聚又能够很好地发挥协同效应.4种反应条件对最终复合材料的结构和形貌都有一定的影响,其中:原料的配比主要影响复合材料中MnO2物相的生成;温度和时间是重要的影响因素,主要通过控制石墨烯的还原过程和二氧化锰晶体的生长过程来影响复合材料最终的结构和性能;pH值主要影响复合材料中二氧化锰的结构和形貌.制备石墨烯/δ-MnO2复合材料的一组优化条件为:m(GO)∶m(硫酸锰)=1∶4,θ=140 ℃,t=12 h,pH=9,在1 mol/L的Na2SO4电解液中,2 mV/s扫描速率下,材料的比电容量达到380 F/g.同时可以发现水热反应过程中 α-MnO2相的出现会降低材料的电容量,这是由于棒状的 α-MnO2隧道结构的孔隙较小,而层状 δ-MnO2拥有更大的层间距和比表面积能够储存更多的电荷.总之,水热法制备的石墨烯/二氧化锰复合材料具有良好的电化学性能,是一种理想的电极材料.本研究工作可能会对石墨烯/金属氧化物复合材料以及石墨烯/二氧化锰基三元复合材料的制备提供一定的帮助.

