模拟状态下硼氢化钠水解产氢动力学条件优化
辛 义 秀, 梁 德 勇, 姜 妍 彦
( 大连工业大学 纺织与材料工程学院, 辽宁 大连 116034 )
0 引 言
为了使能源保持稳定供给,新能源的开发成为世界各国发展的重要课题[1]。氢能以其密度小、资源丰富、可储存、高能量密度、环保等优势而成为各国科学界竞相研究的焦点。国际上一些顶尖的汽车公司:包括美国福特、德国奔驰、日本丰田、韩国现代等公司已经制造出了氢能汽车,这些氢能汽车的动力来源于质子交换膜燃料电池(PEMFC)产生的电能[2],其中氢气是阳极燃料,它通常是贮存在高压储氢罐中,但高压储氢罐存在一定的安全隐患,所以科研工作者努力探索一种安全、便捷、高效、便携的氢气制取方式。
常见的制氢方式有太阳能制氢、电解水制氢、烃类重整制氢、生物质制氢、风能、海洋能、潮汐能制氢,但这些制氢都普遍存在制氢转化率低的问题[3-4]。近年来在应用于小型无人机等便携式装置的氢源研究中,金属氢化物-硼氢化钠因其理论储氢密度高(10.7%)、水解产氢转化率高、安全性好、成本较低、产物纯度高、副产物清洁无污染、反应可控性强等优点而备受关注[5],其水解反应为[6]NaBH4+2H2O→NaBO2+4H2↑。
目前,有关硼氢化钠水解反应动力学条件的研究绝大多数仅限于容器内的化学反应[7-8],即试验时催化剂与反应液置于同一容器内进行反应,也称间歇式产氢。如郭庆杰课题组以及Aydin等[9-12]就是利用恒温水浴锅、三口烧瓶(反应器)以及排水集气瓶(氢气收集和计量)搭建的装置,利用金属型催化剂进行硼氢化钠水解产氢试验,探讨了温度对产氢速率的影响以及反应液中硼氢化钠质量分数、氢氧化钠质量分数、催化剂用量对产氢速率的影响。利用模拟实际应用状态搭建的产氢装置,采用分子筛负载化合物型NiCo2O4催化剂,其水解动力学条件研究尚未见报道,相比试验室间歇式产氢装置,该装置操作流程与实际应用状态更为接近。因此,在该装置下进行硼氢化钠水解反应条件的优化,研究它们对产氢效果的影响程度和最佳条件,对实际应用意义重大。
本试验模拟实际应用搭建了化学法制氢装置,其特点是模拟应用中的流化床,利用蠕动泵将反应液供给到装有催化剂的反应室中,反应产物及副产物则从反应室的另一端流出。以分子筛负载NiCo2O4作为催化剂,采用正交试验设计对硼氢化钠水解制氢所涉及的硼氢化钠质量分数、氢氧化钠质量分数、反应液体积流量以及催化剂用量等4个动力学因素对转化率、启动时间和反应速率3个优化指标的影响进行优化。
1 试 验
1.1 试剂与仪器
试剂:无水乙醇(C2H5OH),分析纯,天津市富宇精细化工有限公司;13X分子筛(Na2O·A12O3·2.45SiO2·6H2O),河南中聚净化材料有限公司;硼氢化钠(NaBH4),分析纯,山东西亚化学股份有限公司;氢氧化钠(NaOH),分析纯,天津市科密欧化学试剂有限公司;氨水(NH3·H2O),分析纯,沈阳力诚试剂厂;硝酸钴(Co(NO3)2·6H2O),分析纯,天津市大茂化学试剂厂;硝酸镍(Ni(NO3)2·6H2O),分析纯,天津市科密欧化学试剂有限公司;尿素(CO(NH2)2),分析纯,天津市科密欧化学试剂有限公司。
仪器:反应液供给采用YZ1515X型蠕动泵,河北保定创锐泵业,四位数显;催化剂物相分析采用D/Max-3B型X射线衍射仪(XRD),日本理学制造,Cu靶,射线管电压40 kV,工作电流30 mA,扫描速度5°/min,扫描范围10°~70°;表面形貌研究采用JSM-7800F型场发射扫描电子显微镜(FESEM),日本电子株式会社,信号:二次电子,分辨率:0.8 nm;催化剂样品元素含量及元素分布采用X-MaxN50型X射线能谱仪(EDS),英国牛津仪器公司,有效探测面积50 mm2。
1.2 产氢装置
为了模拟实际产氢状态而搭建的反应装置如图1所示,整套装置包括4个系统,分别是供料系统、反应系统、缓冲系统和产物收集系统。其中,供料系统由反应液储存装置和蠕动泵构成;反应系统是由装有催化剂的反应室和滤网组成,滤网的作用是使废液和氢气通过,同时阻挡催化剂的流失;缓冲系统是由一个缓冲瓶构成,用来存放反应产生的废液,同时也是氢气流动的通道;产物收集系统由集气瓶和量筒组成,进行氢气的储存及试验数据的测定。
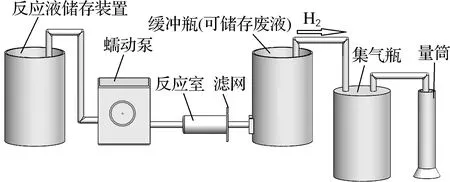
图1 产氢装置示意图Fig.1 Schematic diagram of hydrogen generation device
产氢过程:在反应液存储装置中放入配制好的反应液,并将催化剂放入水平放置的反应室中,开启蠕动泵,使反应液以一定的流速供给到反应室中,与催化剂接触后,硼氢化钠开始水解产生氢气;在蠕动泵压力推动下,反应液不断流入反应室,反应生成的氢气和副产物从反应室一端的滤网流出进入缓冲瓶,氢气则通过缓冲瓶进入集气瓶,并储存在其中,利用排水集气法测定氢气的体积,即可得到各优化指标的试验数据。
1.3 催化剂的制备
动力学条件优化试验选用的催化剂是分子筛负载NiCo2O4(以“NiCo2O4/分子筛”来表示),采用均相共沉淀法结合烧结法。
制备过程:对分子筛进行破碎、过筛处理,得到粒度为20~60目筛的小粒径分子筛(0.3 mm);对其进行3次水洗和醇洗,放入恒温鼓风干燥箱中烘干备用;按照w(Ni(NO3)2)∶w(Co(NO3)2)∶w(CO(NH2)2)∶w(H2O)=1.0∶2.0∶2.5∶17.5的比例倒入锥形瓶中配置混合溶液,之后向溶液中逐滴加入氨水,边滴加边测pH,直至前驱体溶液pH为7,此时溶液变为含有絮状沉淀的浑浊液,然后向混浊液中加入分子筛,再将装有浑浊液和分子筛的锥形瓶移至110 ℃的油浴锅中磁力搅拌加热4 h。
加热过程中尿素不断水解生成氨气,其反应如式(1)所示,其反应生成的氨气溶于水中,产生OH-,如式(2)所示,OH-不断与两种构晶离子Co2+、Ni2+形成共沉淀,如式(3)所示,并均匀沉积在分子筛表面,冷却后取出放入80 ℃恒温鼓风干燥箱中干燥2 h,再将其放入350 ℃马弗炉中进行烧结处理6 h,得到NiCo2O4/分子筛黑色颗粒,其形成反应如式(4)所示。
(1)
(2)

(3)
(4)
1.4 催化水解动力学试验设计
为了探究模拟状态下各动力学条件对硼氢化钠水解产氢过程的影响规律,采用正交试验L16(45)对NiCo2O4/分子筛催化作用下的硼氢化钠水解进行试验安排。其中,动力学条件(因素)有硼氢化钠质量分数、氢氧化钠质量分数、催化剂用量(每100 g反应液中添加催化剂的量,g)和反应液体积流量,每个因素选取4个水平,如表1所示。优化的指标为产氢性能,包括转化率(α)、启动时间(t0)和反应速率(v)。其中,转化率是反应终止时所获得的氢气总量与理论产氢量的比值;启动时间为反应液开始接触催化剂到持续产氢的时间间隔;反应速率为产氢量与所需时间的比值。
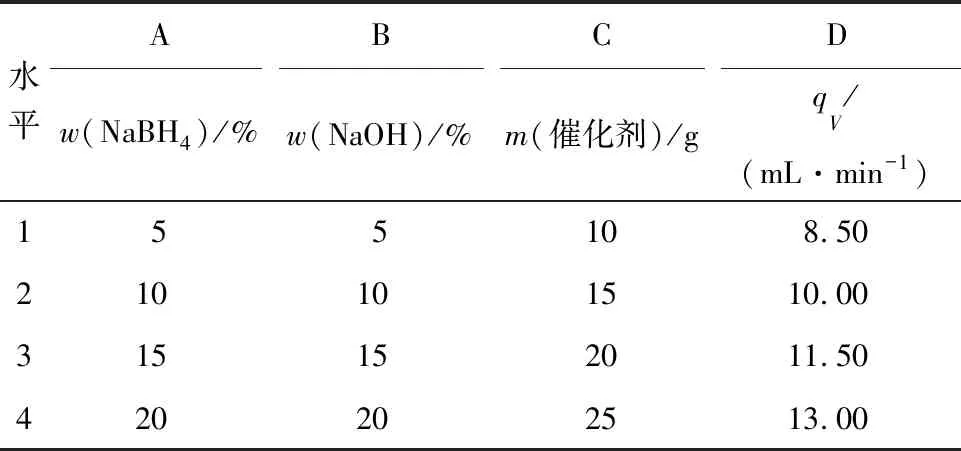
表1 正交试验因素水平表Tab.1 Factors and levels of orthogonal experiment
2 结果与讨论
2.1 催化剂物相分析
图2为样品的XRD图谱,其衍射峰分别位于2θ为18.35°、32.63°、36.90°、45.28°、58.69°、64.65°和65.10°处,与标准卡片(JCPDS,NO.73-1702)对照发现,这些衍射峰分别对应的是NiCo2O4晶体的(111)、(220)、(311)、(400)、(422)、(511)和(440)晶面,表明制备的样品为化合物型NiCo2O4晶体,并且不含有其他杂质相。
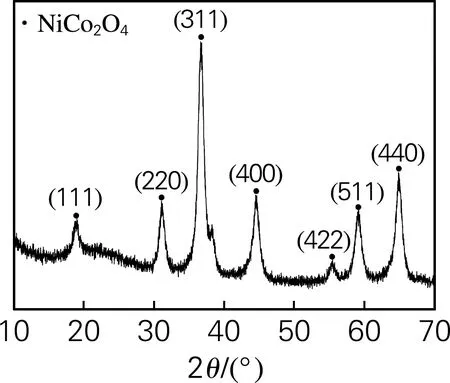
图2 催化剂的XRD图谱Fig.2 XRD pattern of catalyst
2.2 催化剂的形貌分析
图3为样品的FESEM照片,图3(a)、(d)显示分子筛是由微米级类球状物质搭建的固体骨架以及由骨架分隔成的大量密集微小空隙组成,单个类球状颗粒的直径约3~4 μm,并且表面残留有破碎时留下的细屑;图3(b)、(e)为均相共沉淀反应后分子筛的SEM照片,可见表面形貌由类球状转变成松针状,说明NiCo2O4前驱体已均匀沉积在分子筛表面;图3(c)、(f)为经热处理后形成NiCo2O4的SEM照片,可见在表面能的驱动下,松针状物质通过自组装形成纳米花簇,纳米花的直径约为100 nm。
图4为样品的EDS图谱,由分层显示(图4(a)~(c))可见,Co、Ni、O都均匀分布在载体上;图4(d)为NiCo2O4/分子筛的整体图,可见NiCo2O4晶体覆盖在凹凸不平的分子筛各个表面上,这表明通过均相共沉淀结合烧结法成功地制备了NiCo2O4/分子筛。

(a) 分子筛(5 000倍)

(b) 前驱体/分子筛(5 000倍)

(c) NiCo2O4/分子筛(5 000倍)

(d) 分子筛(20 000倍)

(e) 前驱体/分子筛(20 000倍)

(f) NiCo2O4/分子筛(20 000倍)
图3 样品的FESEM照片
Fig.3 FESEM images of samples

(a) Co

(b) Ni

(c) O

(d) 3种元素叠加图4 NiCo2O4/分子筛的EDS图谱Fig.4 EDS patterns of the NiCo2O4 /molecular sieve
2.3 正交试验结果分析
2.3.1 正交试验的极差分析
采用四因素四水平对转化率、启动时间、反应速率3个优化指标进行分析。依据表1中的因素水平设置,以NiCo2O4/分子筛为催化剂,按照正交试验L16(45)基本表,在室温下对硼氢化钠水解反应进行试验安排,如表2所示。极差分析如表3所示。
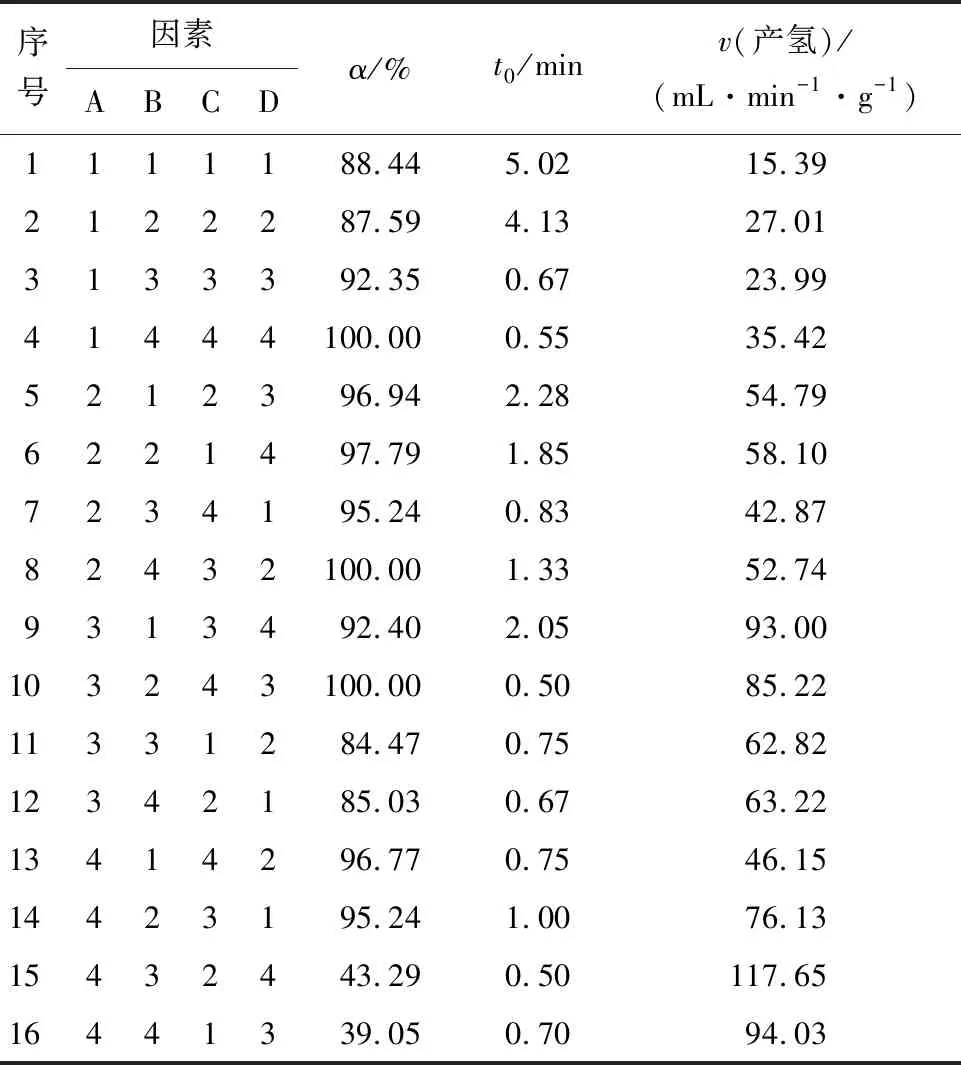
表2 正交试验结果Tab.2 Results of orthogonal experiment
根据转化率的极差分析结果可知:RD>RA>RC>RB,所以各因素对α的影响程度由大到小依次为反应液体积流量、硼氢化钠质量分数、催化剂用量、氢氧化钠质量分数;因素A为2水平(10%)、因素B为2水平(10%)、因素C为4水平(25 g)、因素D为2水平(10.00 mL/min)时α最大,则对于α,其最优参数组合为A2B2C4D2。
根据启动时间的极差分析结果可知:RA>RB>RC>RD,则它们对t0的影响程度由大到小依次为:硼氢化钠质量分数,氢氧化钠质量分数,催化剂用量,反应液体积流量;因素A为4水平(20%)、因素B为3水平(15%)、因素C为4水平(25 g)、因素D为1水平(8.50 mL/min)时t0最短,则对于t0,最优参数组合为A4B3C4D1。
根据反应速率的极差分析结果可知:RA>RD>RC>RB,则它们对v的影响程度由大到小依次为:硼氢化钠质量分数,反应液体积流量,催化剂用量,氢氧化钠质量分数;因素A为4水平(20%)、因素B为1水平(5%)、因素C为4水平(25 g)、因素D为4水平(13.00 mL/min)时,v达到最大值,即最优参数组合为A4B1C4D4。
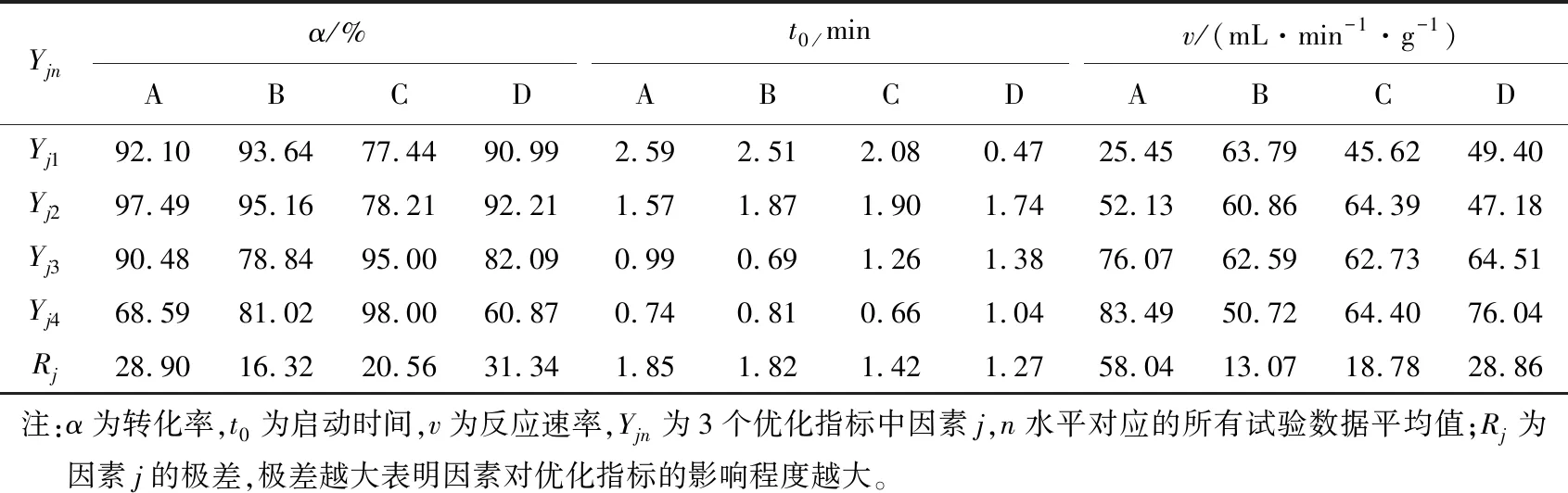
表3 转化率、启动时间和反应速率极差分析Tab.3 Extremum difference analysis of conversion, reaction rate and start-up time
2.3.2 综合平衡法分析各因素影响程度
根据表3中数据,采用综合平衡法分别对4个因素的影响程度进行分析。
因素A:t0和v两个优化指标中,因素A的R值均为最大,即它的影响程度最为主要;α指标中,其重要程度则处于次要,因素D为主要,考虑到因素A的极差值为28.9%,因素D的为31.34%,二者比较接近,这说明因素A和因素D对α的影响程度基本相当,所以选择因素A为最主要影响因素。
因素B:对于α和v两个指标,因素B的R值均为最小,即影响程度最低,但对于t0这一指标,因素B则属于次要影响因素,与因素D相比,其t0极差只相差0.58 min,同时考虑到t0在3个指标中的综合权重较小,所以选择因素B为最低影响因素。
因素C:α、t0和v3个优化指标的极差值均排在次低,所以选择因素C为次低影响因素。
因素D:对于α来说,因素D影响程度最为主要,极差值为31.34%,与因素A极差值28.9%相差很少,可认为影响程度相当;对于t0,因素D影响程度最低,极差值1.27 min,与次要的因素A极差1.85 min 相差仅有0.55 min,可认为影响程度相当;因素D对于v,为次要影响因素,同时考虑到v在3个优化指标中权重最大,所以选择因素D为次要影响因素。
通过综合平衡分析后,确定各因素对3个优化指标的综合影响程度从大到小依次为硼氢化钠质量分数、反应液体积流量、催化剂用量、氢氧化钠质量分数。
2.3.3 综合平衡法选取最优水平
根据表3中数据,采用综合平衡法分别对4个因素最优水平的选取进行分析。
因素A:4水平时,t0和v均处于最优状态,α为最低状态,3水平时,t0和v参数值与4水平时相差很小,同时3水平下的α为90.48%,满足使用要求,因此确定A3是整体反应的最优水平。
因素B:2水平时,α达到最大值;对于v,1、2、3水平下的数值基本一致;对于t0,2水平时的1.87 min,虽然在因素B优化中不是最佳值,但能满足使用要求,因此选择α和v两个优化指标均可达到优异状态的2水平,即B2是整体反应的最优水平。
因素C:4水平时,3个优化指标均处于最佳状态,因此C4是整体反应的最优水平。
因素D:4水平时,v可达最大值,但此时α为最低水平,而2水平时,α为最高值,v却为最低,所以最优条件只有在D1和D3中选取,考虑到v在3个优化指标中综合权重最大,所以选取v较大的D3为整体反应的最佳水平。
综合以上分析,动力学条件最优组合确定为A3B2C4D3,即硼氢化钠质量分数15%、氢氧化钠质量分数10%、催化剂用量25 g、反应液体积流量11.50 mL/min。这是L16(45)正交试验表中设计的16组试验中的第十组。
2.4 最优方案的验证及分析
A3B2C4D3为综合分析得到的最优组合,采用此组合条件在所搭建的连续式产氢装置中再次进行试验,结果如图5所示。v约为86.47 mL/(min·g),反应在23.23 min时,α达到100%;t0如图5中右侧小图所示,0.5 min,这与正交试验中的第10组数据相当。与表2中其他数据比较后综合指标均优于其他组试验。表明在最优动力学条件组合下,各项优化指标综合水平的确处于最佳状态,验证了综合平衡分析法的合理性。
2.5 催化剂用量优化试验
经过综合分析与验证,反应的动力学条件最优组合为A3B2C4D3,结合表3可发现,A、B、D 3个因素在选定的水平范围内,对优化指标均存在最佳值,只有因素C与各优化指标呈单调增加关系,没有极值点。所以需要对催化剂用量做进一步优化。在A3、B2、D3条件下,选取催化剂用量为15、20、25、30、35 g进行优化试验。结果如图6所示。5组曲线的产氢速率基本一致,其中催化剂用量为25 g时,对应的反应速率比其他4组略快,图6右下小图为v的放大图,可知,v随催化剂用量的增加呈现先增加后减小的趋势;从图6右上方小图可以看到当催化剂用量在15~25 g时,t0均为0.5 min,当用量为30、35 g时,t0分别为0.67、0.84 min,这表明当催化剂用量高于25 g 时,t0随着催化剂用量的增加而增大;如图6左侧小图所示,α随催化剂用量的增加呈现先增加后减小的趋势,当催化剂用量为25 g(C4)时,α达到最大值100%;综合以上分析,当催化剂用量为25 g 时,各指标均为最大值,所以动力学参数最优组合仍为A3B2C4D3。
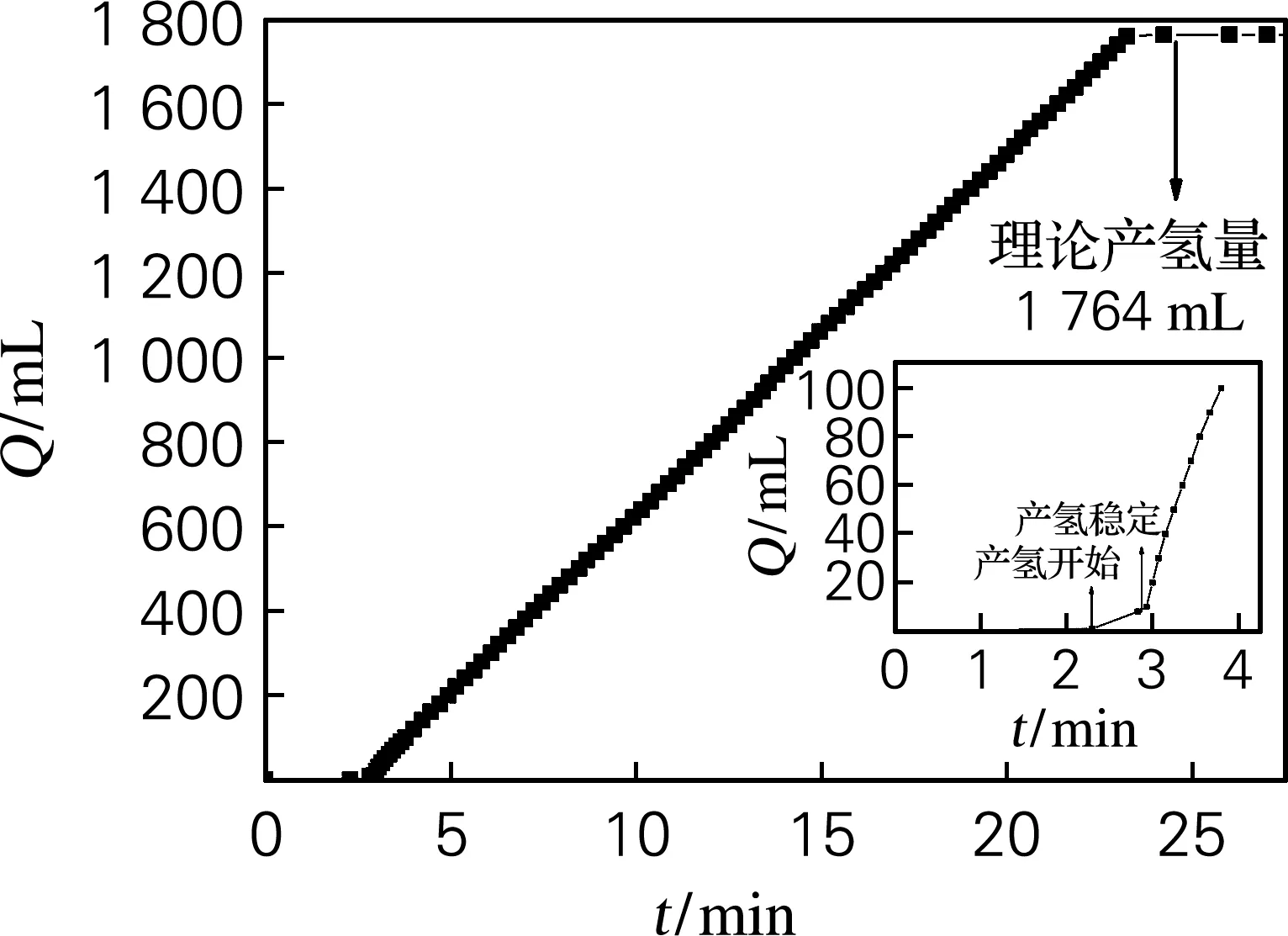
图5 组合A3B2C4D3产氢量与时间关系Fig.5 Amount of hydrogen generation versus time diagram in A3B2C4D3 combination
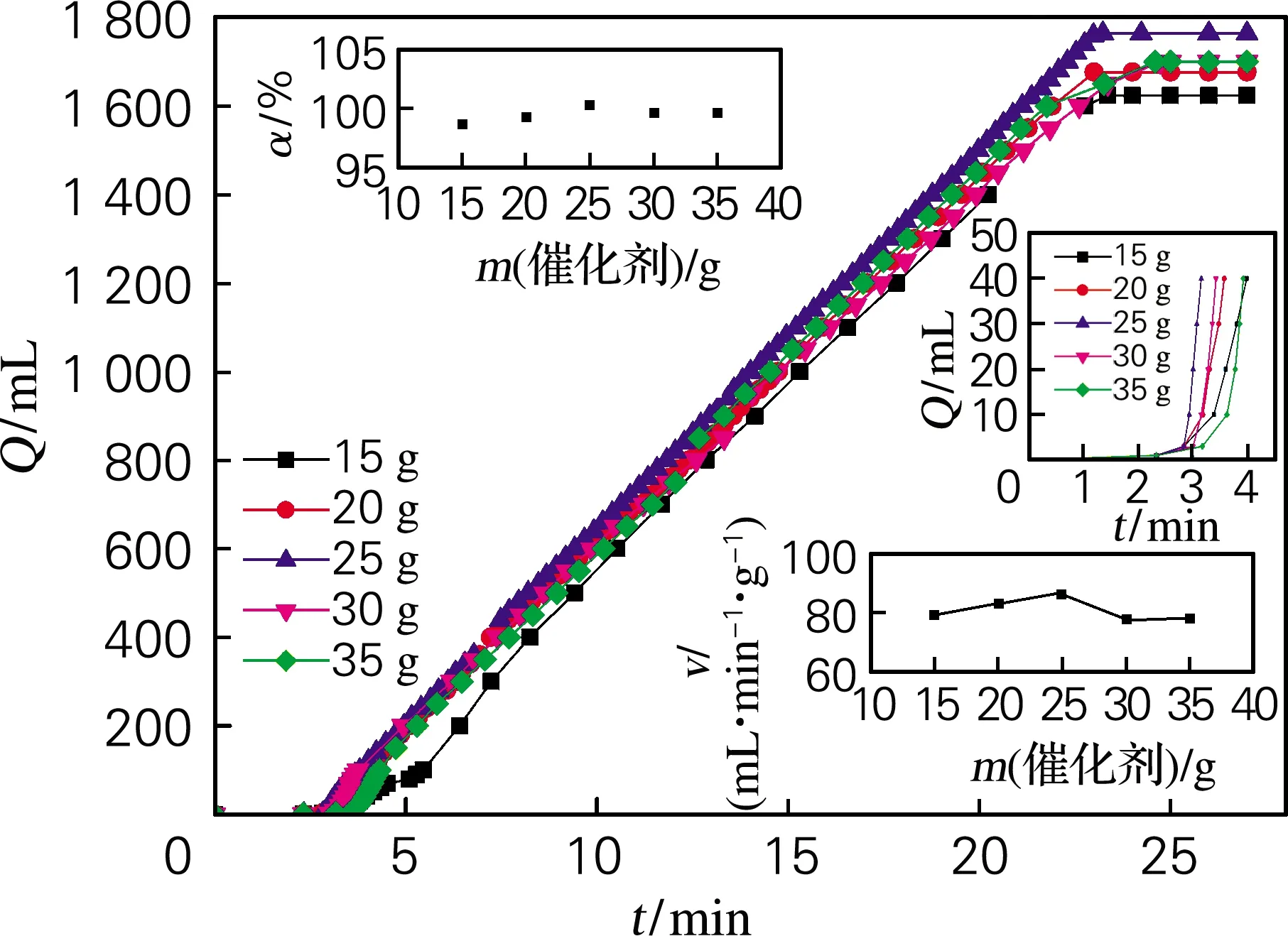
图6 不同催化剂用量对产氢反应的影响Fig.6 Effect of different catalyst dosage on hydrogen generation reaction
2.6 放大试验
为进一步探讨模拟状态下得出的最优动力学参数是否能够在硼氢化钠水解反应的放大规模中依然适用,以最优组合A3B2C4D3作为水解动力学条件,将总量分别放大1.5、2.0、2.5、3.0倍进行试验,结果如图7所示。5组曲线基本重合,这表明不同放大规模下水解反应对应的v非常接近,基本保持在85 mL/(min·g)左右,并且5组反应的α都可达到100%;图7中的局部放大图可清晰地反映不同放大规模下的t0均在0.5 min 左右。以上结果表明,利用该装置对硼氢化钠水解反应进行动力学条件优化,其结果可直接应用于放大规模,这对实际生产与应用更有价值。
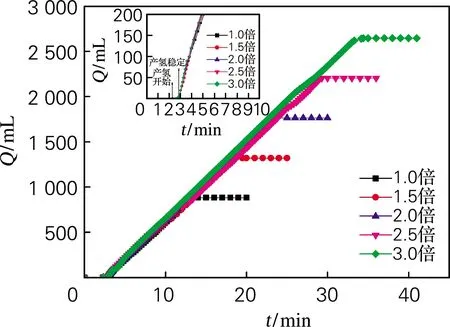
图7 不同溶液总量时产氢量和时间的关系Fig.7 Evolution versus time of hydrogen generation in different amount of solution
3 结 论
利用搭建的模拟试验装置,对硼氢化钠水解制氢反应体系进行了动力学优化试验,通过数学处理和综合平衡法分析发现,影响程度按照硼氢化钠质量分数、反应液体积流量、催化剂用量、氢氧化钠质量分数依次减小,且硼氢化钠质量分数15%,氢氧化钠质量分数10%,催化剂用量25 g、反应液体积流量11.50 mL/min时,反应体系的转化率、启动时间、反应速率达到最佳状态;以优化的最佳条件A3B2C4D3应用于1.5、2.0、2.5、3.0 倍放大规模试验中,仍可获得相同的规律和相同的最佳效果。该试验装置以蠕动泵作为输运动力设备,模拟连续式产氢体系,优化出的动力学参数不仅科学,而且更具实际意义,可成为扩大生产和实际应用重要参考依据。

