过表达FOSL1改善骨髓间充质干细胞增殖和迁移能力
张婉,符伟国,史振宇
复旦大学附属中山医院血管外科,上海200032
慢性心功能衰竭、冠心病、心肌梗死、下肢动脉硬化性闭塞症和腹主动脉瘤等心血管疾病均在老年患者中更常见[1-2],存在的共同问题是缺乏有效的根治措施。间充质干细胞(mesenchymal stem cells, MSCs)是中胚层来源的具有自我复制和多向分化潜能的细胞群[3],最常见的来源是骨髓。MSCs 能从发病机制角度逆转疾病的进展,当组织损伤时MSCs 受特殊趋化因子和炎症信号介导到达损伤或炎症位置[4],通过刺激机体内源性修复机制来实现对损伤组织的修复。近年来,MSCs 广泛应用于心血管疾病的治疗[5-8],有利于提高患者的生活质量和降低心血管疾病的死亡率,具有广阔的临床应用前景。
在猪腹主动脉瘤模型中,球囊损伤动脉瘤后,同时注射绿色萤光蛋白标记的猪骨髓MSCs,2 d 内动脉壁组织中均可检测到MSCs,但仅持续1 周[4]。提示MSCs 在移植环境中的存活能力不理想,可能影响了其修复受损组织的能力。因此,如何提高MSCs 体内体外的存活能力,增强其生物学性能,是修复受损组织能力的关键。基因修饰干细胞,是一种有效改善干细胞生物学性能的措施[9-10]。FOSL1 基因定位于染色体11q13,在多种细胞的增殖和迁移中发挥重要作用[11-12]。本研究通过基因转染技术将FOSL1 基因导入MSCs,进一步探讨FOSL1 基因转染对MSCs 生物学功能的影响,旨在为后续干细胞修复心血管疾病模型提供有利可靠的体外实验证据。
1 材料与方法
1.1 仪器与试剂 FOSL1 抗体(Abcam)、PBS 和M199培养基(Gibco)、0.25%胰蛋白酶(Gibco)、荧光标记小鼠单克隆抗体CD34、CD45、CD29 和CD90(Abcam)、嘌呤霉素(ScienCell)、青霉素/链霉素(国药)、CCK 试剂盒(同仁化工)、BCA 蛋白定量试剂盒(威奥)、电泳液和转膜液(威奥)、PI 染液(威奥)、移液枪(Thermo)、6 孔板与96 孔板(康宁)、超净台(苏州净化设备有限公司)、恒温水浴箱(上海跃进医疗器械有限公司)、倒置荧光显微镜(Olympus)、流式细胞仪(BD)、荧光定量PCR 仪(罗氏)、高速离心机(Thermo)、洗板机(Thermo)、凝胶呈像系统(Tanon)等。MSCs 细胞株和过表达FOSL1基因的慢病毒载体由上海中桥新舟生物公司提供。
1.2 实验方法
1.2.1 MSCs 复苏、传代与流式细胞鉴定 在超净台上融化并重悬MSCs,高速离心后加入2 mL 培养基,转移至康宁培养皿,37℃恒温培养。每3 天更换1 次培养液,细胞融合至60%~70%后开始传代。取扩增P3代MSCs,甲醛固定细胞,高速离心后弃上清液,以1.0×106/mL 的浓度重悬细胞,转移至Eppendorf 离心管。
实验分为转基因组(实验组)和MSCs 组(对照组)。实验组加入抗体CD29、CD90、CD45 和CD34,阴性对照不加一抗。室温避光孵育2 h。PBS 液清洗,高速离心后弃去上清液,加入相应的荧光标记二抗。室温孵育30 min,PBS 清洗后重悬细胞,流式细胞仪检测。
1.2.2 FOSL1 基因慢病毒载体转染 MSCs 转染前24 h 将P3 代MSCs 接种于6 孔板中,每孔1×105个细胞,放入培养箱常规培养。待MSCs 细胞融合约70%后进行慢病毒转染。
1.2.3 Real-time PCR 检测FOSL1-MSCs 中FOSL1基因表达情况 收集实验组细胞和对照组细胞,每孔不少于1×106个,使用抽提试剂盒提取总RNA,取5g 总RNA 行反转录合成cDNA,以cDNA 为模板,将GAPDH 作为内参,进行荧光定量PCR 反应。使用PCR 仪自带软件分析样本的循环阈值,采用2-Ct 方法定量计算基因的相对表达量。见表1。
1.2.4 Western Blot 检测FOSL1-MSCs 中FOSL1 蛋白表达情况 将2 组细胞裂解、变性,上样量为每孔30 g 蛋白,转膜,加入一抗(FOSL1 抗体与GAPDH),一抗浓度为1∶200,4℃孵育过夜,二抗经37℃孵育4 h 后,PBS 漂洗3 次,显影,分析目标蛋白灰度值。目标蛋白相对表达量=目标蛋白灰度值/GAPDH 灰度值,实验重复3 次,取平均值。
1.2.5 CCK8 与PI 染色实验检测细胞增殖情况(1)CCK8 法测定细胞增殖情况:将2 组细胞消化成单细胞悬液后,以1×106个/孔将细胞种植于96 孔板上,每孔按200L 的体积上样,经0h、12h、24h、36h、48 h、60 h、72 h 和84 h 培养后,100L CCK8试剂加入于每孔中,继续培养1 h。450 nm 波长下,用酶标仪测定各孔吸光值,绘制细胞增殖曲线(时间为横坐标,吸光值为纵坐标)。(2)PI 染色实验检测细胞周期改变情况:胰酶消化后收集细胞,PBS溶液清洗2 次,高速离心后收集细胞。PBS 溶液清洗2 次后重悬细胞,乙醇固定后4℃过夜。高速离心收集细胞,PBS 溶液重悬细胞后再次高速离心收集细胞沉淀,加入100L PI 染液。进行流式细胞检测(波长488 nm 检测红色荧光,同时检测光散射情况),用软件进行DNA含量分析及光散射分析。
1.2.6 划痕实验检测细胞迁移情况 先用marker 笔在6 孔板背后,直尺辅助下均衡划线(每隔0.5 cm划1 道)。6 孔板中加入约1×105个细胞,放入培养箱过夜。第2 天同法垂直划线。用PBS 洗细胞3次,去除划下的细胞,加入无血清培养基,培养箱培养24 h 取样并拍照。
1.3 统计分析 使用STATA15.0 软件进行分析,计量资料以均数±标准差表示,2 组间比较采用 检验;计数资料以百分率(%)表示,2 组间比较采用卡方检验<0.05 为差异有统计学意义。
2 结果
2.1 MSCs 复苏后形态学及流式细胞鉴定 细胞复苏培养6 d 后,细胞呈现典型的梭形形态,漩涡状生长。见图1。

表1 引物设计
图1 MSCs 形态学鉴定
待细胞融合至80%~90%后进行传代培养。对P3代细胞进行流式细胞鉴定细胞表面标志物CD29、CD90、CD34 和CD45,结果阳性率分别为89.2%、80.8%、5.8%和6.3%,符合MSCs 的特征。
2.2 FOSL1 基因在MSCs中的基因与蛋白表达水平RTPCR 结果显示实验组FOSL1基因表达高于对照组([0.09±0.00)V(0.03±0.00),<0.05]。WB 实验显示FOSL1 蛋白水平的表达高于对照组([1.97±0.02)V(0.39±0.04)0.05]。此外实验组FOSL1 在mRNA与蛋白水平的相对表达量均高于对照组,证实FOSL1基因成功导入MSCs。见图2。

图2 WB 实验检测FOSL1 蛋白(FRA-1)的表达情况
2.3 转染后细胞增殖与细胞周期情况CCK8 增殖实验结果显示实验组与对照组均从第3天进入快速增殖期,第5 天达到增殖高峰,第6 天起进入增殖平台期;实验组增殖率自第3 天起高于对照组(<0.05)。见图3。

图3 CCK8 细胞增殖实验
PI 染色实验结果显示实验组G0/G1 期细胞占比低于对照组([52.81±0.69)%(63.40±2.34)%,<0.05];实验组S 期与G2/M 期的细胞比例高于对照组([47.20±0.12)%(36.60±0.39)%,<0.05)]。提示FOSL1可能通过增加细胞G0/G1 期向S期与G2/M 期转化,促进MSCs 细胞增殖。见图4。

图4 PI 染色实验结果
2.4 转染后细胞迁移情况 划痕实验结果显示实验组竖线间的间隙小于对照组,实验组的迁移距离大于对照组,差异有统计学意义(0.05),说明FOSL1基因转染提高了MSCs 的迁移能力。见图5。
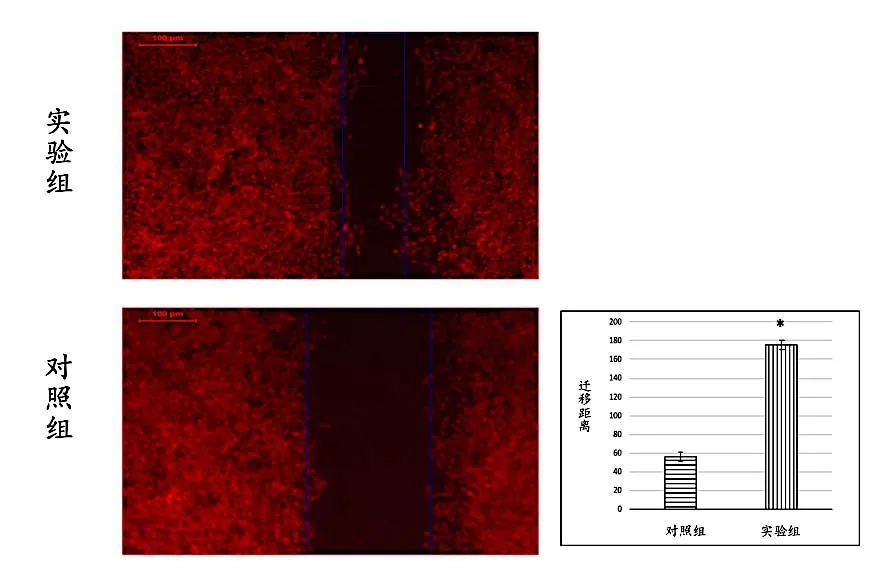
图5 细胞划痕实验
3 讨论
心脑血管疾病严重威胁人类健康,尤其是中老年人。MSCs 具有多向分化潜能,能够参与多种心血管组织修复,是理想的细胞移植与基因治疗的种子细胞[3-4]。有学者对15 例慢性冠状动脉闭塞的患者进行MSCs 移植,随访2年患者未发生心血管不良事件,冠脉CT 发现患者的心肌梗死面积减小,左室射血分数改善[13]。
MSCs 移植修复组织,影响移植效能的关键问题是干细胞的体外移植微环境存活、迁移和分化能力严重降低,多数细胞在未分化前即已凋亡。MSCs 移植治疗心肌梗死,90%的干细胞在移植3 d 内已凋亡,仅有少数干细胞存活以起到治疗作用[14-15]。MSCs 细胞内基因如血管内皮生长因子的过表达[16],能有效提高MSCs 存活。FOSL1基因定位于染色体11q13,参与调控多种细胞的增殖、凋亡和迁移等生物学行为[17]。FRA-1 是FOSL1基因的蛋白翻译产物,能激活特异性周期蛋白-D1 从而进一步改善细胞增殖功能[11-12]。本研究通过FOSL1基因转染MSCs,探讨FOSL1基因是否能有效改善MSCs 增殖与迁移能力。
本研究首先通过Real-time PCR与Western Blot 鉴定FOSL1基因在mRNA 水平和蛋白水平的相对表达量。实验组FOSL1 mRNA 表达量约为对照组的3 倍,FOSL1 蛋白水平的表达量为对照组的5.24 倍,差异均有统计学意义,证实FOSL1基因成功转染了MSCs。CCK8 增殖实验发现实验组的增殖速率约为对照组的1.3 倍,差异有统计学意义。PI 实验结果发现实验组G0/G1 期细胞比率低于对照组(<0.05);实验组S 期与G2/M 期的细胞比率较对照组增加(<0.05)。可见FOSL1基因转染MSCs,能促使MSCs 细胞从G0/G1期细胞向S 期与G2/M 期转化,进而有效改善细胞增殖功能。细胞划痕实验结果发现实验组迁移距离大于对照组(<0.05)。上述实验证实,FOSL1基因转染改善了MSCs 增殖与迁移功能。
综上所述FOSL1基因转染MSCs 改善了干细胞体外增殖与迁移能力,实验结果为后续干细胞修复心血管疾病模型提供有利可靠的体外实验证据。

