2014—2018年仙桃市伤寒沙门菌分子分型及耐药性分析*
叶恒平,张雅婷,袁 敏,邢学森,吕 静,何 飞,周海健,李国明,杨红梅△
(1.仙桃市疾病预防控制中心,湖北仙桃 433000;2.湖北省疾病预防控制中心,湖北武汉 430079;3.中国疾病预防控制中心传染病预防控制所,北京 100026)
伤寒沙门菌引起的伤寒是常见的消化道传染病,目前仍是重要的公共卫生问题[1],主要通过粪-口传播。食用受污染的水产品,饮用未煮沸的水或消毒不彻底的牛奶,生食瓜果蔬菜等均有可能导致该菌的传播,人口流动、个人卫生习惯、地方饮食风俗、环境卫生、食品卫生、水源管理、粪便管理、经济条件及居住环境等对伤寒沙门菌流行起着重要的作用,由于慢性带菌者持续存在,传播途径不易彻底切断[2]。仙桃市是湖北省的伤寒高发区,每年发病率在全省排名位列前3位。2013年仙桃市某高校出现了伤寒暴发,暴发后在学校及周边部分区域开展重点人群伤寒Vi多糖疫苗应急接种,但由于伤寒沙门菌荚膜多糖(Vi抗原)疫苗人工免疫效果欠佳,散发病例在仙桃市仍时有出现。为了解仙桃市伤寒沙门菌耐药性和分子分型特征,本研究通过对2014—2018年仙桃市肠道门诊监测系统收集并分离的伤寒沙门菌进行药敏试验、脉冲场凝胶电泳(PFGE)分型及多位点序列分型(MLST)研究,对该地区的伤寒防控有重要意义。
1 材料与方法
1.1菌株来源 菌株来源于2014—2018年仙桃市伤寒患者血液或粪便样本中分离的29株伤寒沙门菌。药敏质控菌株大肠埃希菌ATCC 25922和PFGE的分子质量标准参考菌株H9812均由中国疾病预防控制中心传染病预防控制所提供。
1.2仪器与试剂
1.2.1仪器 CHEF MAPPER PFGE仪(美国Bio-Rad公司),凝胶成像仪(美国Bio-Rad公司),VitekⅡ全自动生化分析仪(法国梅里埃公司),Vitek比浊仪(法国梅里埃公司),PCR仪(美国Bio-Rad公司),荧光定量PCR仪(美国Bio-Rad公司),电泳仪(美国Bio-Rad公司),隔水式恒温培养箱(上海齐欣),去离子水系统(美国Milipore公司),APLUS震荡恒温水槽(美国APLUS实验室通用仪器公司),DK-8D电热恒温水槽(上海齐欣仪器公司),TU-100C恒温金属浴(上海一恒仪器公司),5424R 台式冷冻离心机(德国Eppendorf公司),AIM自动接种系统(美国Thermo Fisher公司)。
1.2.2试剂 沙门显色培养基(中国科玛嘉公司),VITEK革兰阴性细菌鉴定卡(法国梅里埃公司),沙门菌诊断血清(丹麦SSI公司),革兰阴性需氧菌药敏检测板(美国Thermo Fisher公司,型号CHN1GOV、CHN2GOV),Xba Ⅰ酶、100 bp DNA Ladder[宝生物工程(大连)有限公司],SeaKemGold Agarose琼脂糖(美国Cambrex公司),蛋白酶K(美国Sigma公司),十二烷基肌氨酸钠(美国Sigma公司),Tris-HCl、乙二胺四乙酸、5×TBE(北京索莱宝科技有限公司)。所有试剂均在有效期内使用。
1.3方法
1.3.1菌株复核 将菌株复苏后接种至沙门显色培养基上,37 ℃培养过夜。挑取单个紫色菌落按照Vitek革兰阴性细菌鉴定卡使用说明书进行生化实验。生化复核后,进行玻片凝集试验[3]。
1.3.2PFGE分型 参考文献[4-6],选用XbaⅠ限制性内切酶对实验菌株和H9812进行酶切(37 ℃,3 h)。电泳参数:初始脉冲2.16 s,最终脉冲63.8 s,电压6 V/cm,电场夹角120°,电泳温度14 ℃,电泳时间19 h。电泳结束后,进行染色、脱色,再采用凝胶成像系统获取图像。PFGE图像导入Bio Numerics 7.6软件,设置Dice相关系数为1.5%,选择非加权组平均法(UPGMA),设置条带位置差异容许度为1.5%,进行聚类分析。分型判别标准参考文献[7],相似度100%认定为同一PFGE带型。
1.3.3MLST分析 挑取伤寒沙门菌单个菌落接种营养肉汤,37 ℃生长过夜后取1.5 mL菌液8 000 r/min离心10 min,去上清后沉淀复悬于1.0 mL无菌超纯水中,100 ℃金属浴10 min,13 200 r/min离心10 min,留取上清液作为PCR模板。利用扩增引物及条件(94 ℃ 5 min;94 ℃ 30 s、55 ℃ 1 min、72 ℃ 1 min,35个循环;72 ℃ 10 min)分别扩增7个管家基因片段(thrA、purE、sucA、hisD、aroC、hemD、dnaN)后进行测序[8]。管家基因位点选择参见爱尔兰科克大学(University College Cork,Ireland)MLST网站(http://mlst.ucc.ie),扩增及测序引物参见http://mlst.ucc.ie/mlst/dbs/Senterica/documents/primersEnterica_html。
1.3.4药敏试验 采用微量肉汤稀释法对最低抑菌浓度(MIC值)进行测定。将伤寒沙门菌转种脑心浸液琼脂平板,37 ℃培养16 h后混悬于0.85%生理盐水中制成0.5麦氏单位悬液,采用自动接种系统接种至药敏检测微孔板中,药物包含氨苄西林、氨苄西林/舒巴坦、四环素、氯霉素、复方磺胺甲噁唑、头孢唑啉、头孢噻肟、头孢他啶、头孢西丁、庆大霉素、亚胺培南、萘啶酸、阿奇霉素、磺胺异噁唑、环丙沙星、阿莫西林/克拉维酸、多黏菌素E、多黏菌素B、米诺环素、阿米卡星、氨曲南、头孢吡肟、美罗培南、左氧氟沙星、卡那霉素、链霉素,同时大肠埃希菌ATCC 25922作为质控菌株。依据药敏检测板说明书进行操作,36 ℃孵育培养,18 h后系统依据微孔板中菌株生长与否判读MIC值。结果的判定依据美国临床实验室标准化研究所(CLSI)2019年出版的M100药敏试验指南进行[9]。
1.3.5产超广谱β-内酰胺酶(ESBLs)耐药基因检测 采用煮沸法提取菌株及质粒DNA。PCR扩增反应体系为25.0 μL,包含12.5 μL 2×PCR反应混合物,纯水9.5 μL,上下游引物(10 μmol/L)各1.0 μL,模板1.0 μL。反应条件:95 ℃预变性5 min;94 ℃ 40 s、52 ℃ 40 s、72 ℃ 1 min,35个循环;75 ℃延伸5 min。blaCTX-M、blaTEM、blaSHV、blaGES、blaPER、blaVEB、blaOXA-1、blaOXA-2、blaOXA-10型基因引物序列及反应条件见表1[10-11],引物序列合成及PCR扩增产物测序由武汉天一辉远生物科技有限公司完成。测序结果进行GenBank Blast比对。
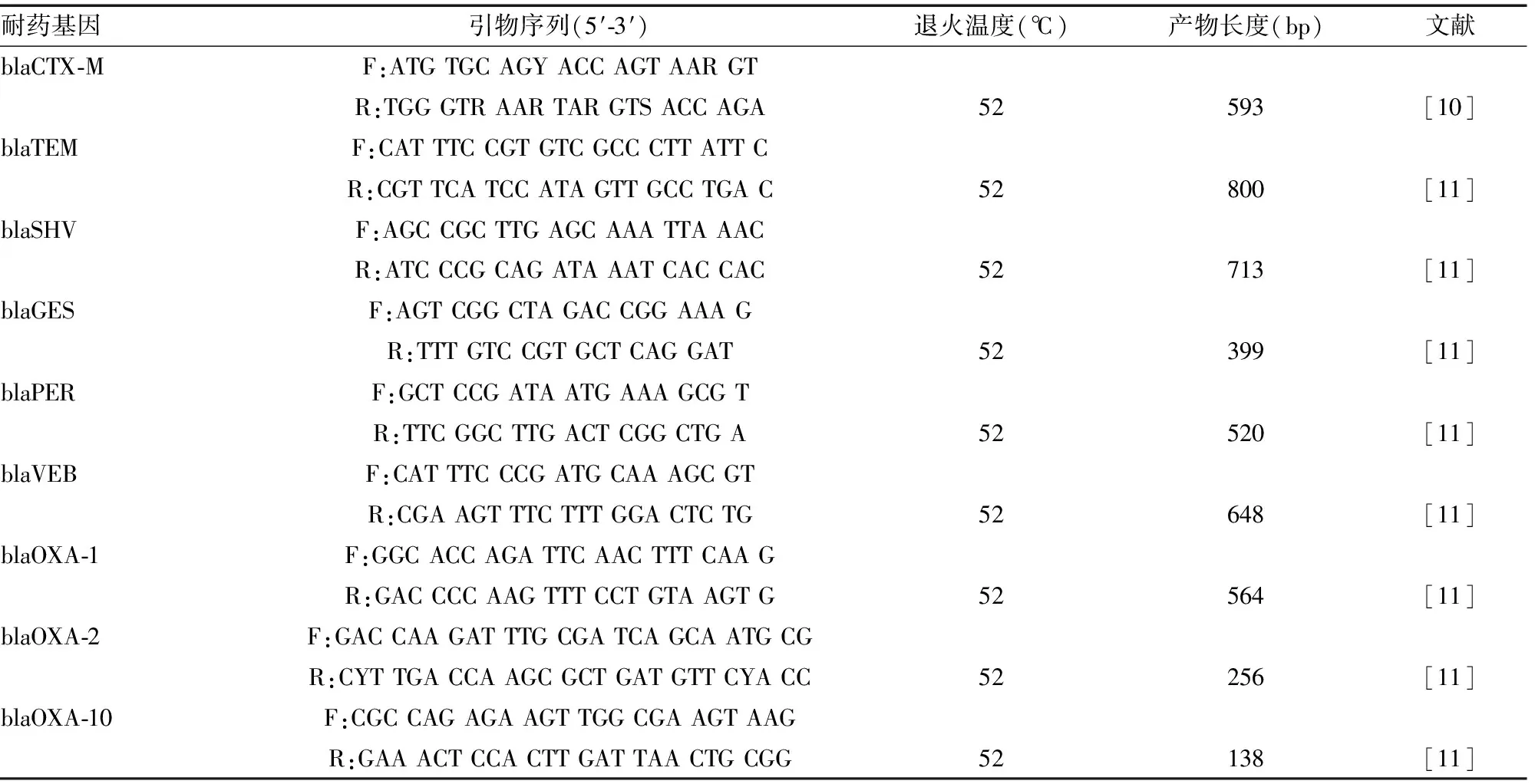
表1 ESBLs耐药基因PCR引物及序列

图1 伤寒沙门菌PFGE图谱和相关信息
2 结 果
2.1菌株复核结果 29株菌经生化及血清复核后均为伤寒沙门菌。其中27份菌株来源于患者血液,2份菌株来源于患者粪便。29株菌中2014年5株,2015年2株,2017年14株,2018年8株。病例年龄10~79岁,其中11~20岁占27.6%(8/29),其次为21~30岁及41~50岁,均占17.2%(5/29),其他年龄组分布依次为31~40岁占13.8%(4/29),51~60占10.34%(3/29),61~70岁占6.9%(2/29),70岁以上占6.9%(2/29)。男、女性别比为0.61:1(11/18),以女性为主。见图1。
2.2分子分型结果 29株伤寒沙门菌经Xba Ⅰ酶切PFGE电泳后,根据电泳条带的不同,29株伤寒沙门菌可分为6个型别(HuBXTSal001~HuBXTSal006),其中HuBXTSal003型包含24株菌,为优势带型。其余5种带型分别只包含1株菌。HuBXTSal004、HuBXTSal005、HuBXTSal006与HuBXTSal003相比分别只有4条带的差异。将这24株HuBXTSal003型图谱与仙桃市疾病预防控制中心所保存的2013年仙桃伤寒暴发疫情[12]中所分离到的菌株PFGE图谱进行比对,发现这24株菌与2013年暴发菌株带型一致,均为HuBXTSal003带型。29株伤寒沙门菌MLST分型分为2个ST型。27株血液分离菌株为ST2型(等位基因谱为1-1-2-1-1-1-5);2株粪便来源菌株为ST19型(等位基因谱为10-7-12-9-5-9-2)。见图1。对患者来源地点进行分析,可以发现,患者主要来自于干河街道(8例,27.5%)、龙华山街道(5例,17.2%)及沙嘴街道(5例,17.2%),在空间上较为集中。
2.3药敏试验结果 29株伤寒沙门菌中分离自血液的27株菌对26种抗菌药物均为敏感/中度敏感;分离自粪便的有2株菌对抗菌药物有不同程度的耐药性,见表2。分离自粪便的有2株菌株,菌株号为HB-2015-SAL-02的菌株对氨苄西林及四环素耐药,菌株号为HB-2014-SAL-01的菌株耐药谱分布较广,耐药药物名称为AMP-A/S2-TET-CHL-STX-FAZ-FOT-TAZ-FOX-AZI- FIS-CIP-AUG-MIN-AZT-KAN-STR。将这2种耐药菌株送至国家疾病预防控制中心采用纸片扩散法进一步确认,结果均一致。与分离自血液的菌株耐药结果相比,粪便来源的菌株耐药谱分布较广,且出现了1株多重耐药菌株。
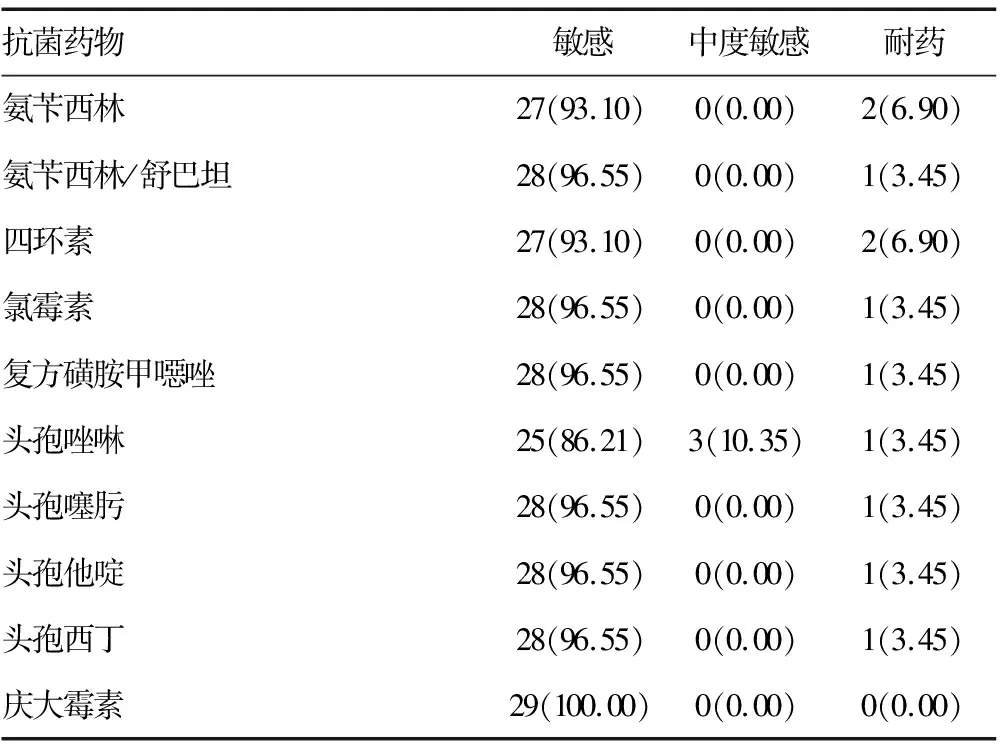
表2 29株伤寒沙门菌抗菌药物耐药情况[n(%)]
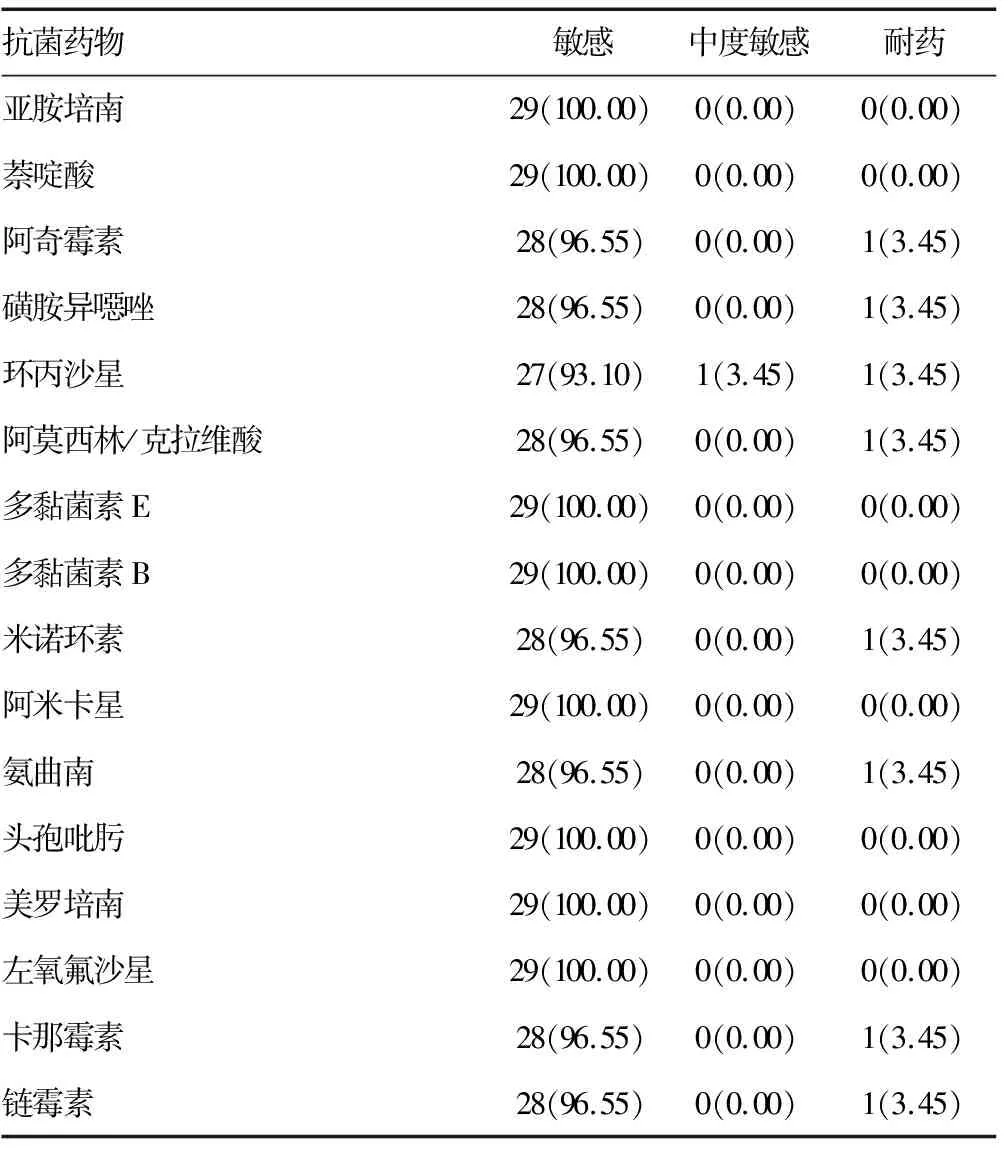
续表2 29株伤寒沙门菌抗菌药物耐药情况[n(%)]
2.4ESBLs细菌耐药基因检测 选取对氨苄西林和β-内酰胺酶抑制剂均耐药的菌株HB-2014-SAL-01,对其进行blaCTX-M、blaTEM、blaSHV、blaGES、blaPER、blaVEB、blaOXA-1、blaOXA-2、blaOXA-10 9种ESBLs基因检测,电泳结果见图2,仅有blaOXA-1扩增产物符合目的产物大小,经测序验证为blaOXA-1。
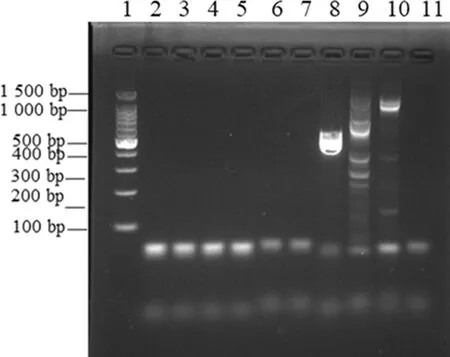
注:泳道1为分子标志物,泳道2~10依次为blaCTX-M、blaTEM、blaSHV、blaGES、blaPER、blaVEB、blaOXA-1、blaOXA-2、blaOXA-10扩增产物,泳道11为阴性对照。
图2 耐药基因检测电泳结果
3 讨 论
2010—2015年全国伤寒发病率约为0.65/10万[13-14],湖北省不属于伤寒高发区域,仙桃地区除2013年仙桃市某学校暴发伤寒疫情至今,发病率也基本控制在0.01/10万至0.93/10万,处于相对平稳且无暴发流行的状态,流行趋势以高度散发为主[12]。本研究中伤寒病例年龄在10~79岁,男、女性别比为0.61∶1,发病时间集中于夏秋季,体现了仙桃市近年来伤寒流行病学的基本特点和变化趋势。对仙桃市伤寒沙门菌流行菌株开展药敏监测和分子分型分析,可指导临床用药和特殊人群的预防性服药,在疫情防控中确定病原菌特征、分析传播途径、追溯传染源、研究菌株之间的亲缘性等方面具有重要作用。
PFGE是大多数细菌病原体分子分型的金标准,选用全基因组DNA在统一设定识别罕见切点的内切酶和实验条件下,以不同相对分子质量的差异作为分离不同分子的依据。PFGE因费用较低、结果直观,因而应用较广。其中HuBXTSal003型菌株出现在同一地区(仙桃市干河街道6株)不同的时间(4株为2017年菌株,1株为2018年菌株,1株为2014年菌株),在不同年份(2014年4株,2015年1株,2017年12株,2018年7株)反复出现反应伤寒沙门菌不断变异中的一种相对的稳定型,提示当地污染源持续存在,可能存在慢性带菌者群体,特别是2017年的12株与2018年的7株HuBXTSal003型簇聚类可能存在相同来源暴露的伤寒沙门菌潜在暴发。由于本研究菌株来源于肠道门诊监测系统,均为伤寒患者标本分离所得,因此,未能在环境中揭示出暴露来源,还需结合流行病进一步开展聚集性伤寒病例的溯源工作,找出可能持续存在的感染源头。
MLST因其易标准化而被广泛用于不同地区不同菌株的比较和生物进化研究。MLST分型结果显示,29株伤寒沙门菌分为ST2(27株)和ST19(2株)两个序列型别,表明仙桃市伤寒沙门菌株存在优势克隆。官网(http://mlst.ucc.ie)查询表明,这2种型别伤寒沙门菌在各地均广泛分布。
仙桃市的伤寒沙门菌耐药情况与其他地区不尽相同[15-17],分离自血液的27株菌对喹诺酮类的敏感率高达100%,提示环丙沙星可作为成人临床治疗伤寒沙门菌感染的首选药物。同时,这27株菌对第3、4代头孢菌素类抗菌药物均为敏感,但头孢菌素类抗菌药物易引起ESBLs、Ampc酶等一系列多重耐药菌的产生。随着临床中抗菌药物的广泛应用,伤寒沙门菌对抗菌药物的敏感性逐渐降低,多重耐药菌株显著增多[18],故应慎重选择并加强耐药监测。
本研究还显示分离自粪便的菌株耐药谱分布较广。本研究采用的药敏试验为微量肉汤稀释法进行MIC测定,发现1株耐药菌株对青霉素类、头孢类、氨基糖苷类、四环素类、β-内酰胺/β-内酰胺抑制剂复合物、单环内酰胺类等抗菌药物耐药。但对该菌进行ESBLs耐药基因检测发现为blaOXA-1,也从分子层面验证了该菌株对β-内酰胺/β-内酰胺抑制剂复合物类药物耐药。在本研究发现的此多耐药菌株来自较大年龄患者(63岁),对3代头孢菌素已产生了耐药,仅对碳青霉烯类抗菌药物敏感,有基础疾病且住院时间较长,存在院内获得性耐药可能,也有可能是伤寒沙门菌和患者肠道内的某些携带耐药基因的菌株进行了基因交换获得,尚需进一步实验阐明。遗憾的是本研究耐药病例较少,但随着研究病例的增多,将对科学合理用药提供更为有力的依据。
4 结 论
2014—2018年仙桃市所分离的伤寒沙门菌株存在优势PFGE带型及优势ST型,与血液来源的菌株不同,分离自粪便的菌株耐药谱分布较广,并出现了多重耐药菌株。因此,需加强该地区的病例监测,并开展伤寒病例的溯源工作,发现并控制危险因素。

