鸡HMG box蛋白1(HBP1)基因启动子区多态性与腹脂率关联分析
王守志,张长超,李紫薇,王伟佳,李玉东,王 宁,李 辉
(1.农业农村部鸡遗传育种重点实验室,哈尔滨 150030;2.黑龙江省普通高等学校动物遗传育种与繁殖重点实验室,哈尔滨 150030;3.东北农业大学动物科学技术学院,哈尔滨 150030)
肉鸡快速生长伴随腹部脂肪沉积增加,导致诸多不良后果,如酮体品质下降、饲料效率[1]和繁殖性能[2]降低。控制肉鸡腹部脂肪过度沉积是家禽养殖面临的重要问题。遗传手段是解决体脂过度沉积的重要途径[3-4]。脂肪组织增加主要由脂肪细胞数量增多和脂肪体积增大造成。脂肪细胞数量主要由前脂肪细胞增殖、衰老和凋亡调节,而脂肪细胞体积主要由前脂肪细胞分化调节。因此,解析影响鸡脂肪组织生长发育的遗传学基础对于应用遗传手段培育低脂肉鸡品系具有重要意义。
HMG box 蛋白1 为一种普遍存在的转录因子,属于高迁移率(HMG)家族DNA 结合蛋白[5]。哺乳动物研究表明,HMG box蛋白1(HBP1)基因在细胞增殖、分化、衰老中发挥重要作用[6]。在细胞增殖方面,可与视网膜神经胶质瘤蛋白(Retinoblastoma,RB)结合,通过抑制促细胞分裂基因表达抑制细胞增殖[7]。同时还是Wnt 信号通路负性调控因子[8],通过Wnt 通路中LEF/TCF 活性抑制Wnt 信号传导,抑制细胞增殖。此外,可通过下游靶基因调控细胞周期,利用Wnt通路调控脂肪生成,影响前脂肪细胞增殖调节脂肪沉积[9]。在细胞分化方面,可使多种细胞(如肌肉细胞、脂肪细胞、红细胞等)发生细胞周期阻滞并加速其分化。在诱导分化过程中,HBP1可使细胞退出细胞周期并触发分化特异性基因表达[10]。Tevosian 等发现HBP1 可与Rb 和p107相互作用调节细胞分化,使细胞发生G1期阻滞并抑制其S期进程,是影响细胞周期的关键性基因[11]。研究表明,在转基因小鼠肝细胞培养模型中,HBP1 基因协调动物组织分化,为HBP1 基因调节组织中细胞周期提供重要证据[12]。在细胞衰老研究方面,Bodnar等利用Western印迹和RT-qPCR研究H2O2对HBP1表达水平的影响,通过荧光素酶活性试验检测H2O2对HBP1 转录活性的影响发现,HBP1基因促进细胞衰老,为进一步探讨衰老的调控机制提供理论基础[13]。
本实验室前期研究发现,位于鸡1号染色体上HBP1基因是影响鸡脂肪组织生长发育的重要候选基因,可促进前脂肪细胞衰老和凋亡[14]。目前,有关HBP1 基因研究较少,HBP1 基因序列变异与鸡腹脂关系的研究尚未见报道。鉴于HBP1基因重要功能,本研究将HBP1基因作为影响鸡腹脂性状重要候选基因,以东北农业大学肉鸡高、低脂双向选择品系第十九世代鸡群为试验材料,对该基因进行多态性位点检测和基因分型,通过单位点和单倍型关联方法分析该基因启动子区多态性与鸡腹脂相关性,鉴定HBP1基因显著影响鸡腹脂率的分子标记,为后续深入探究HBP1基因影响鸡腹脂的遗传机理提供依据。
1 材料与方法
1.1 试验鸡群和性状测定
本研究以东北农业大学肉鸡高、低脂双向选择品系第十九世代肉鸡为试验材料,共计329只公鸡(高脂系159只个体,低脂系170只个体)。鸡群按常规商品肉鸡饲养程序统一管理。7周龄时翅静脉采血,EDTA-Na2抗凝,酚-氯仿抽提基因组DNA后,TE溶解-20 ℃保存备用。7周龄屠宰前测定活重(Body weight 7, BW7),屠宰后测定腹脂重(Abdominal fat weight,AFW),除以7周龄活重计算腹脂率(Abdominal fat percentage,AFP)。
1.2 多态性位点检测和基因分型
委托北京诺和致源公司全基因测序HBP1 基因(NM_001199454.2),检测基因多态性。在高、低脂系第十九世代群体中共发现168 个多态性位点,并获得所有个体基因型。考虑到基因启动子区碱基突变可能影响基因表达,因此本研究重点分析HBP1 基因启动子区54 个SNPs 与鸡腹脂率相关性。
1.3 单倍型构建
针对HBP1 基因启动子区54 个SNPs 位点,用SAS 9.4 通过滑动窗口单倍型构建,每4 个SNPs构成1个窗口,每次向前滑动1个SNP,共计51个窗口。
1.4 统计分析
根据肉鸡高、低脂双向选择品系群体特点,构建如下混合线性统计模型分析基因型与腹脂率:
其中,Y 为性状观测值,μ 为群体均值,Sire(Line)为品系内公鸡随机效应,Dam(Line,Sire)为品系与公鸡内母鸡随机效应,G 为基因型固定效应,H 为单倍型固定效应,Line 为品系固定效应,e为随机效应。模型(1)和(2)分别用于分析单位点和单倍型与腹脂性状的相关性。应用统计软件JMP11.0 作相关分析,并估计性状最小二乘均值(LSM)。单位点关联分析采用Bonferroni 方法校正,当P<0.0009(0.05/54)时,基因型对腹脂率有显著影响;单倍型关联分析显著水平为P<0.05。
2 结果与分析
2.1 SNP的鉴定和选择
全基因组测序结果显示,HBP1基因中检测到168个SNPs位点,其中启动子区有54个SNPs位点。
2.2 单位点SNP基因型与鸡腹脂率相关分析
利用JMP11.0 软件分析HBP1 基因启动子区54个SNPs 位点单位点基因型与鸡腹脂率相关性,结果见表1。结果表明,g.-5335G>A、g.-4354T>A、g.-3328C>T、g.-3327G>A、g.-1013T>C、g.-990G>A和g.-159A>C 7 个位点与腹脂率呈显著相关(P<0.05)。

表1 HBP1基因多态性对鸡腹脂率的影响(P值)Table 1 Effects of HBP1 gene polymorphisms on abdominal fat percentage in chickens(P value)
对显著影响鸡腹脂率7 个SNPs 位点不同基因型多重比较分析,结果见表2。仅g.-4354T>A位点AA 基因型个体腹脂率显著低于AT、TT 基因型个体,而其余6 个位点(g.-5335G>A、g.-3328C>T、g.-3327G>A、g.-1013T>C、g.-990G>A和g.-159A>C)腹脂率均为突变前纯合基因型个体显著低于其他两种基因型个体(P<0.05)。
对以上7 个SNPs 位点在两系间作基因型和等位基因频率分析发现,部分多态性位点基因型在两系间分布比较偏,甚至仅有两种基因型,例如g.-1013T>C在低脂系中仅TC、CC基因型。等位基因频率卡方检验发现,7 个SNPs 位点等位基因在两系间分布均存在极显著差异(P<0.0001)。
2.3 单倍型与鸡腹脂率相关分析
利用JMP11.0软件分析单倍型与鸡腹脂率相关性,结果见表3。

表2 不同基因型对鸡腹脂率的影响(最小二乘均值)和基因型频率及等位基因频率在两系间分析Table 2 Effects of different genotypes on chicken abdominal fat(LSM)and the analysis of genotype and allele frequencies between two lines
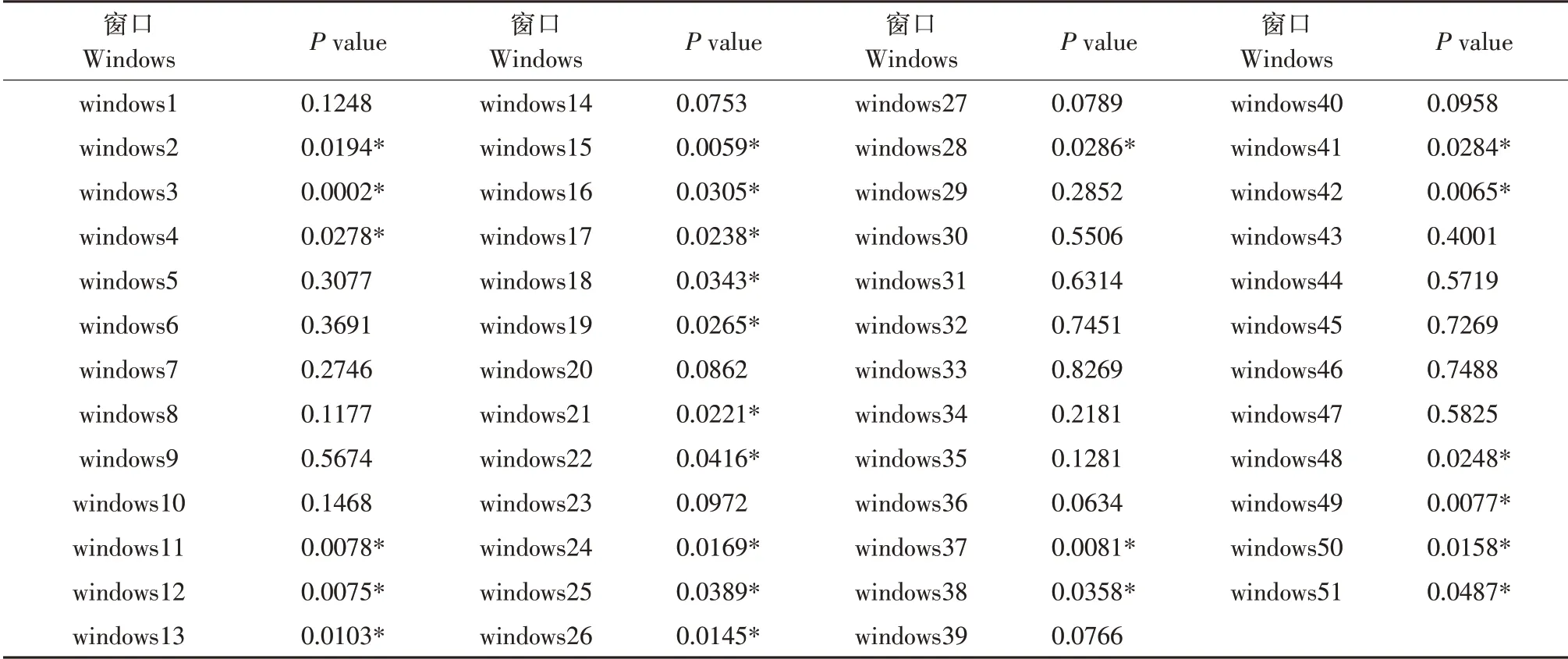
表3 HBP1基因单倍型对鸡腹脂率的影响(P值)Table 3 Effects of HBP1 gene haplotypes on abdominal fat percentage in chickens(P value)
由表3 可知,windows2、windows3、windows4、windows11、 windows12、 windows13、 windows15、windows16、 windows17、 windows18、 windows19、windows21、 windows22、 windows24、 windows25、windows26、 windows28、 windows37、 windows38、windows41、 windows42、 windows48、 windows49、windows50、windows51 共25 个窗口的单倍型基因型与腹脂率呈显著相关(P<0.05)。这些单倍型中包括单位点分析显著的7个SNPs,即g.-5335G>A、g.-4354T>A、g.-3328C>T、g.-3327G>A、g.-1013T>C、g.-990G>A 和g.-159A>C,表明这7 个SNPs 可能是影响鸡腹脂率重要变异位点。
3 讨 论
前期研究发现,HBP1基因可促进前脂肪细胞衰老和凋亡[14]。考虑到启动子区有较多顺式作用元件,该区域碱基突变可能影响基因转录,进而影响基因表达,因此本研究重点分析启动子区SNPs位点和鸡腹脂率相关性,为后续深入探究HBP1基因影响鸡腹脂遗传机理提供依据。
在候选基因或GWAS 研究中,基于单标记和单倍型与目标性状相关分析是常用方法。基于单倍型分析是研究由相邻多个标记构建的单倍型对目标性状的影响。与单标记分析相比,单倍型分析具有可检测到单倍型块内标记间的上位作用、利用单倍型信息检测等位基因是否为IBD、拥有更高且稳健的QTL 检测效率等优点。滑动窗口(Sliding windows)构建单倍型关联分析是常用方法。研究发现,窗口(即组成滑动窗口标记个数)大小不同对关联分析结果有重要影响。Braz 等分别以3、5、7、9和11个标记组成滑动窗口构建单倍型,同时利用单标记和单倍型分析牛肉嫩度性状GWAS,结果显示,相对于单标记分析和其他数目标记组成滑动窗口构建单倍型分析,3 和5 个标记组成的滑动窗口具有更高的QTL 检测效率[15]。本研究中,为保证结果可靠性,同时开展HBP1基因单标记和4个标记组成的滑动窗口单倍型与鸡腹脂率关联分析。单标记分析发现,g.-5335G>A、g.-4354T>A、g.-3328C>T、g.-3327G>A、g.-1013T>C、g.-990G>A 和g.-159A>C 7 个位点与腹脂率呈显著相关,这一结果在单倍型分析中也得到验证。从7个SNP等位基因在两系间分布来看(见表2),等位基因在两系间分布存在显著差异(P<0.0001),说明这些位点可能被选择,随腹脂率的选择在两系间分化,可能是影响鸡腹脂性状重要多态性位点。结合相关分析和多态性位点在两系间频率分布,本文认为,g.-5335G>A 等7 个位点是影响鸡腹脂性状的重要分子标记。从应用角度来看,g.-4354T>A 位点AA 基因型是降低腹脂率的有利基因型,其余6个位点野生型纯合个体为降低腹脂率的有利基因型,具有用于低脂肉鸡选育的应用价值。
转录因子是一类反式作用因子,可与靶基因顺式作用元件结合调控基因表达。为此本研究应用Mulan、TFBIND 和JASPAR 软件对HBP1 基因启动子区7 个显著SNPs 位点开展生物信息学分析,预测突变位点是否可能改变转录因子结合位点进而影响基因表达。预测结果显示,每个SNP 位点均可能使一些转录因子结合发生变化。例如,当g.-4354T>A 等位基因为T 时预测到可能结合的转录因子有E2F1、Sox6、CEBP等,当等位基因突变为A 时预测可能结合的转录因子有PBX1、NFY等。研究表明,这些转录因子对脂肪生长发育具有调控作用。E2F 转录因子是一类细胞周期、增殖、凋亡和分化的调节因子,E2F1 是其重要成员,调节肝脏糖酵解和脂肪生成[16]。转录因子SOX6 通过直接调控脂肪生成相关基因表达促进脂肪生成[17]。CEBP 是参与脂肪代谢的一类重要转录因子,可在瘦蛋白信号传导中调节缺陷小鼠脂肪生成[18]。人类脂联素基因(Adiponectin,APM1)第1 内含子中存在内含子增强子,CEBP 通过与该增强子中作用元件相互作用,在成熟脂肪细胞中激活APM1 转录[19]。研究发现,转录因子PBX1 在人类胚胎发育多个阶段调节脂肪细胞形成[20]。转录因子NFY通过调控Leptin等脂肪细胞相关基因表达影响脂肪生成[21]。未来需通过报告基因、EMSA和ChIP等分子生物学试验进一步验证与该突变位点结合的转录因子。
综上所述,HBP1基因是影响肉鸡腹脂性状的重要候选基因,其启动子区7个多态性位点对鸡腹脂率有显著影响,可能是影响鸡腹脂率的重要分子标记,后续可通过相关分子生物学试验验证其功能,有望应用于肉鸡育种实践。

