松栀丸HPLC指纹图谱模式识别及大黄素含量测定
粟倩,胡玉珍,罗堃,夏伯候,张智敏,李亚梅,林艳
松栀丸HPLC指纹图谱模式识别及大黄素含量测定
粟倩,胡玉珍,罗堃,夏伯候,张智敏,李亚梅,林艳
湖南中医药大学药学院,湘产大宗药材品质评价湖南省重点实验室,湖南 长沙 410208
建立松栀丸HPLC指纹图谱并测定主要差异性成分大黄素的含量,为松栀丸质量评价提供依据。采用HPLC对3批松栀丸共60个样品进行检测,采用《中药色谱指纹图谱相似度评价系统》(2.0版)计算相似度,运用主成分分析(PCA)和正交偏最小二乘-判别分析(OPLS-DA)对松栀丸进行模式识别,寻找差异性成分,并对其含量进行测定。建立了松栀丸的指纹图谱,标定了17个共有峰。3批样本的相似度为0.898~0.971。通过PCA和OPLS-DA基本能区分不同批次松栀丸,确定大黄素为松栀丸的主要差异性成分。3批松栀丸中大黄素含量分别为0.013 5~0.017 1 mg/g、0.036 7~0.043 6 mg/g、0.022 1~0.031 0 mg/g。HPLC图谱结合PCA和OPLS-DA可快速评价松栀丸的质量,为松栀丸的质量控制提供依据。
松栀丸;指纹图谱;大黄素;模式识别
松栀丸由茯苓、栀子根、穿破石、岗梅、地骨皮、太子参、砂仁、丹参等药加水蒸煮、浓缩、以水泛丸、干燥而成,具有清热利湿、健脾益气功效,主治慢性丙型肝炎[1]。松栀丸可有效改善慢性丙型肝炎患者临床症状、体征和肝功能,降低丙型肝炎病毒RNA定量,从而减轻肝脏损伤,尤其在改善肝功能及停药后的反跳率方面有优势[2]。松栀丸处方来源于湖南湘西侗族蒙氏家族祖传秘方,于2007年获国家食品药品监督管理局批准为中药第三类新药[3]。目前尚未见松栀丸指纹图谱和差异性化学成分的研究,无法对松栀丸的质量进行全面控制。
中药指纹图谱具有综合、宏观、非线性的特点,可对中药成分进行全面的分离及测定,反映中药的整体质量信息。通过指纹图谱特征相似程度的比较,可用于中药真伪鉴别、质量评价、考察稳定性和一致性[4-5]。运用多元统计分析方法,包括主成分分析(PCA)和正交偏最小二乘-判别分析(OPLS-DA),可降低多元数据的维数,并根据数据中固有模式对项目进行分类[6]。因此,本试验采用PCA、OPLS-DA对松栀丸HPLC指纹图谱进行分析,比较样品制备的差异性,为松栀丸的全面质量控制提供参考。
1 仪器与试药
Waters e2695高效液相色谱系统(包括Empower工作站、四元梯度泵、自动进样器、紫外检测器),美国Waters公司;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;BP211D分析电子天平(十万分之一),美国Sartorius公司。
大黄素对照品(批号wkq18041909,纯度≥98%),四川省维克奇生物科技有限公司;3批松栀丸共60个样品(批号20160101、20160102、20160201,编号分别为S1~S20、S21~S40、S41~S60),泰凌医药有限公司;甲醇、乙腈为色谱纯,德国Merck公司;冰醋酸为色谱纯,天津市化学试剂研究所;水为超纯水。
2 方法与结果
2.1 对照品溶液制备
精密称取大黄素对照品,加甲醇溶解,制成每1 mL含0.06 mg的溶液,0.45 μm微孔滤膜过滤,即得。
2.2 供试品溶液制备
取本品粉末(过5号筛)1.0 g,置50 mL锥形瓶中,精密加入甲醇10 mL,称定质量,超声处理(功率500 W,频率40 kHz)45 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,0.45 μm微孔滤膜过滤,取续滤液,即得。
2.3 色谱条件
色谱柱:Agilent HC-C18(12)柱(250 mm×4.6 mm);检测波长:254 nm;柱温:30 ℃;进样量:10 μL;流速:1 mL/min;流动相:乙腈(A)-1%醋酸水溶液(B);梯度洗脱程序:0~30 min,2%~25%A;30~40 min,25%~40%A;40~45 min,40%~70%A;45~55 min,100%A;55~60 min,100%A。
2.4 方法学考察
2.4.1 线性关系考察
精密称取大黄素对照品0.6 mg,加甲醇制成0.06 mg/mL对照品溶液,分别进样1、2、4、6、8、10 μL,按“2.3”项下色谱条件,测定大黄素峰面积积分值,以对照品进样量为横坐标,峰面积积分值为纵坐标,绘制标准曲线,得回归方程=22 763-35 182,=0.999 7,表明大黄素在6~60 ng范围内呈良好线性关系。
2.4.2 精密度试验
取同一批松栀丸(批号20160101),按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件连续进样6次,结果各色谱峰的相对保留时间和相对峰面积RSD均小于3.0%,表明仪器精密度良好。
2.4.3 稳定性试验
取同一批松栀丸(批号20160101),按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件分别于0、2、6、8、12、24 h进样分析,结果各共有峰相对保留时间和相对峰面积RSD均小于3.0%,表明供试品溶液在24 h内稳定。
2.4.4 重复性试验
取同一批松栀丸(批号20160101),按“2.2”项下方法平行制备6份供试品溶液,按“2.3”项下色谱条件分别进样分析,结果各共有峰相对保留时间和相对峰面积RSD均小于3.0%,表明重复性良好。
2.5 指纹图谱的建立及相似度评价
取60个松栀丸样品,分别按“2.2”项下方法制备,进样测定,色谱图见图1。选取峰面积较大的17个峰作为样品共有峰,经对照品比对后,指认13号峰为大黄素。将结果导入《中药色谱指纹图谱相似度评价系统》(2.0版),确定共有峰,生成对照图谱并进行相似度计算,结果见图2、表1。60个松栀丸样品与对照图谱的相似度为0.898~0.971,表明各批次松栀丸的化学成分组成基本一致,质量相对稳定,但不同批次样品色谱峰的峰面积有差异,说明其化学成分含量存在一定差异。

图1 60个松栀丸样品HPLC指纹图谱
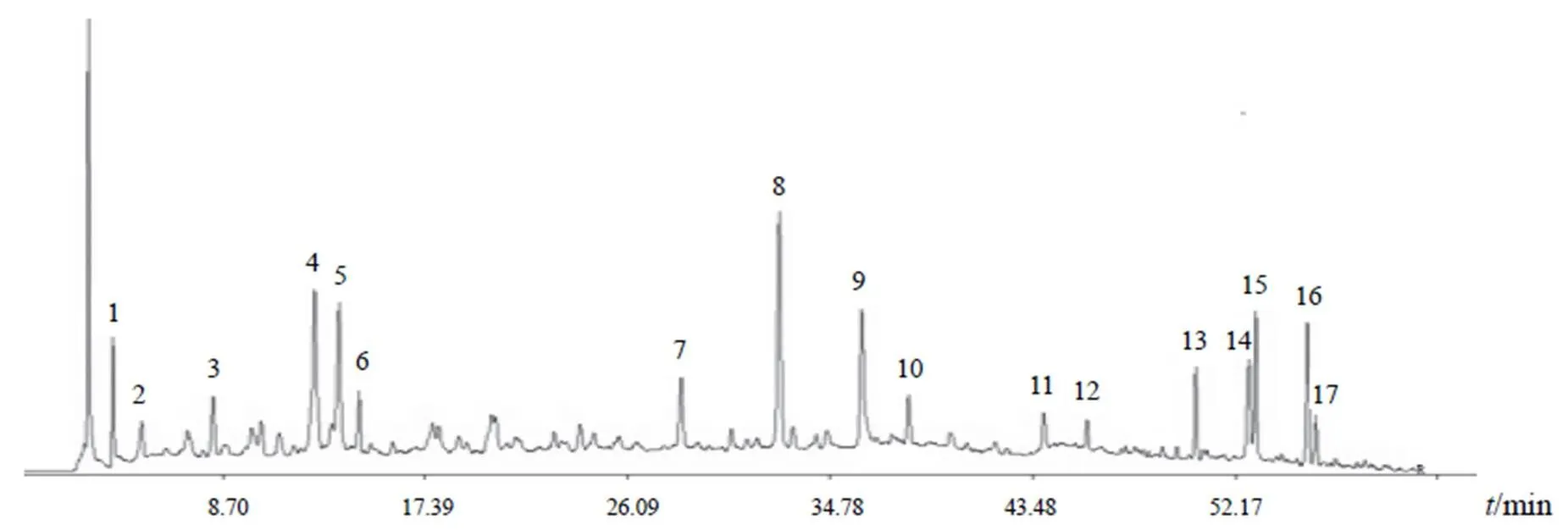
图2 松栀丸样品HPLC对照图谱
表1 60个松栀丸样品相似度评价结果
编号相似度 编号相似度 编号相似度 S10.933 S210.963 S410.939 S20.924 S220.970 S420.965 S30.927 S230.966 S430.968 S40.927 S240.964 S440.958 S50.920 S250.970 S450.970 S60.912 S260.956 S460.966 S70.944 S270.958 S470.970 S80.944 S280.965 S480.966 S90.931 S290.962 S490.969 S100.924 S300.961 S500.966 S110.941 S310.960 S510.967 S120.937 S320.966 S520.964 S130.925 S330.966 S530.957 S140.900 S340.963 S540.947 S150.898 S350.971 S550.953 S160.898 S360.955 S560.960 S170.909 S370.915 S570.905 S180.952 S380.905 S580.948 S190.948 S390.959 S590.949 S200.931 S400.915 S600.917
2.6 化学模式识别
2.6.1 主成分分析
将数据导入SIMCA-P14.1软件,以松栀丸色谱图中的17个共有峰积分面积为变量对样品进行分析。前3个主成分方差贡献率分别为41.14%、26.25%和15.74%,累积方差贡献率为83.12%(见表2),因此提取前3个主成分对样品进行分析,结果见图3。不同批次松栀丸在PCA得分图上分为3类,批号20160101(S1~S20)的松栀丸为1类,且分布较集中,与其余2批明显分开,批号为20160102(S21~S40)的松栀丸为1类,分布集中;批号为20160201(S41~S60)的松栀丸为1类,分布较分散。批号为20160102(S21~S40)和批号为20160201(S41~S60)的2批松栀丸有分开趋势,但界限不明显,二者稍有重叠,PCA不能将这2批松栀丸明显分开,因此需进一步采用OPLS-DA对样品进行区分。
表2 松栀丸HPLC指纹图谱共有峰主成分载荷
峰号PC1PC2PC3PC4PC5PC6 10.185 20.082 30.451 50.211 9-0.250 6-0.318 2 20.133 30.257 90.294 80.083 10.608 5-0.010 7 30.094 10.072 50.544 00.086 90.194 9-0.323 2 40.256 20.230 30.042 80.459 6-0.003 50.320 1 50.045 10.064 70.487 60.260 6-0.223 60.722 7 60.213 20.318 20.071 80.195 30.273 30.189 8 70.318 20.195 70.091 80.170 2-0.154 0-0.139 2 80.339 40.142 30.104 20.065 6-0.230 8-0.044 1 90.077 60.394 90.111 10.045 0-0.471 4-0.178 0 100.239 80.272 30.247 20.034 2-0.236 2-0.055 8 110.162 20.318 70.036 60.469 8-0.081 00.125 2 120.159 60.265 00.152 80.595 70.182 1-0.177 9 130.285 40.273 10.164 00.057 10.090 80.116 5 140.308 90.258 60.094 80.040 10.023 30.056 5 150.332 50.220 90.037 80.023 70.004 50.063 9 160.338 60.206 80.036 50.029 60.012 20.035 6 170.303 60.263 60.111 70.070 80.021 20.088 5 贡献率0.411 40.262 50.157 40.057 50.042 40.023 8 累积贡献率0.411 40.673 90.831 20.888 80.931 20.955 0
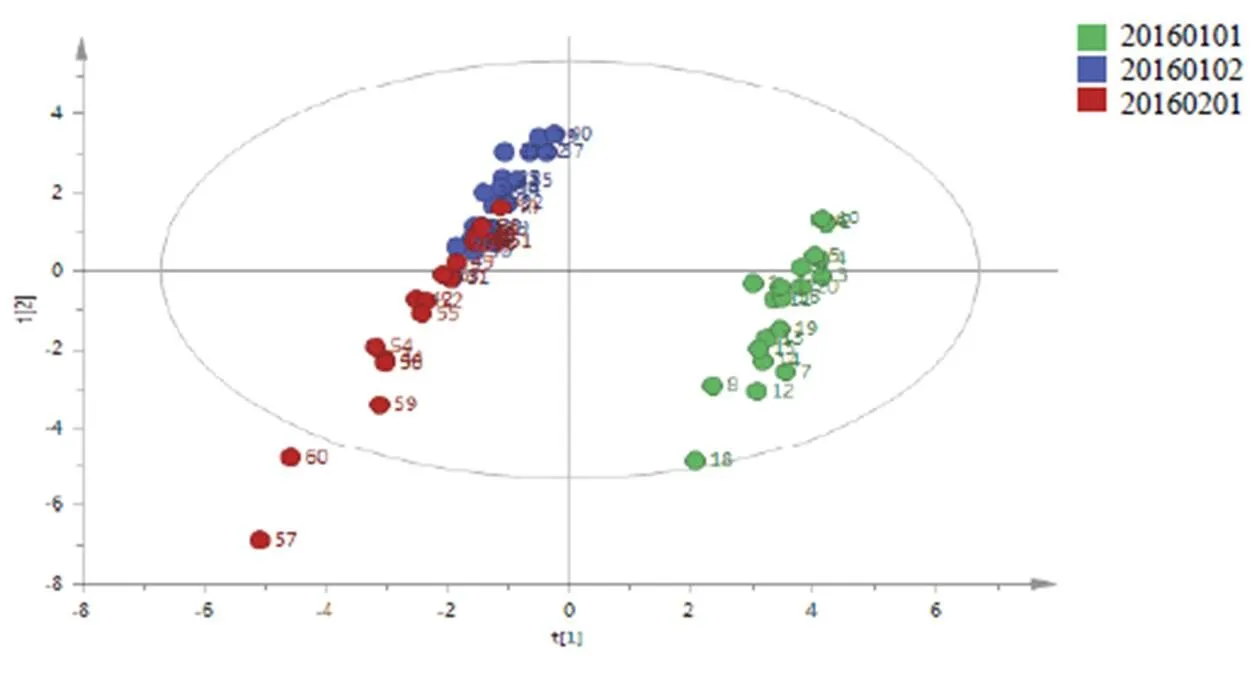
图3 3批松栀丸样品PCA得分图
2.6.2 正交偏最小二乘-判别分析
运用OPLS-DA建立不同批次松栀丸HPLC指纹图谱差异模型。模型R2Y=0.97,表明模型的拟合度较好;Q2Y=0.96,表明模型的预测能力较强,反映3组样本具有明确分离的趋势。该方法能很好地将不同批次的松栀丸样品分为3类,结果见图4。可以看出,3批样品明显分布在得分图不同的区域,其中批号为20160102(S21~S40)松栀丸分布最集中,位于得分图左上角,批号为20160101(S1~S20)松栀丸分布较集中,位于得分图的右侧,批号为20160201(S41~S60)松栀丸分布较分散,位于得分图的左下角。表明不同批次的松栀丸在化学成分上存在一定差异,且有趋势性。对建立的模型进行20次置换检验实验,R2=0.049,Q2=-0.406,表明模型可靠。
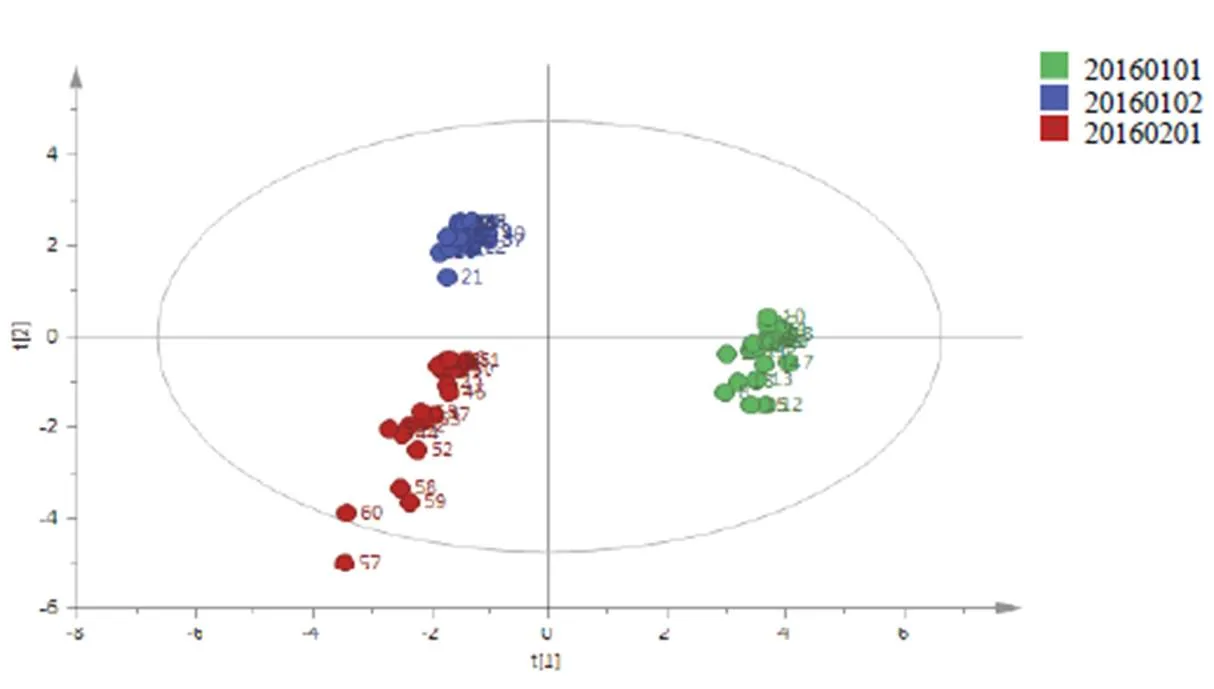
图4 3批松栀丸样品OPLS-DA得分图
提取OPLS-DA模型中17个变量的变量重要性投影(VIP),对17个共有峰峰面积VIP值进行排序,结果见图5。根据VIP图可以看出,13号峰(VIP=1.242 4)、17号峰(VIP=1.205 2)、14号峰(VIP=1.183 8)、3号峰(VIP=1.155 8)、15号峰(VIP=1.150 9)、16号峰(VIP=1.150 6)、10号峰(VIP=1.136 7)、4号峰(VIP=1.115 1)、5号峰(VIP=1.057 7)对松栀丸有显著影响,这些成分是引起不同批次松栀丸成分差异的主要标志性成分,其中13号峰为大黄素。
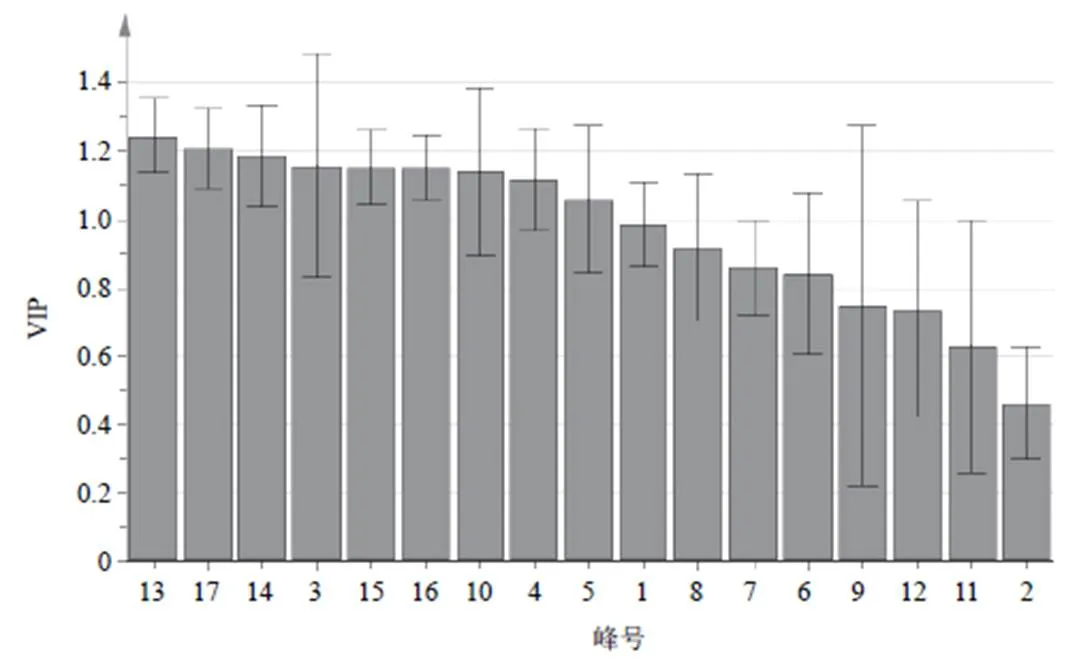
图5 3批松栀丸样品OPLS-DA差异标志物VIP图
2.7 大黄素含量测定
按3批松栀丸共60个样品,按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件进样分析,以峰面积按标准曲线法计算样品中大黄素的含量,结果见表3。3批松栀丸样品的大黄素含量范围分别为0.013 5~0.017 1 mg/g(批号20160101)、0.036 7~0.043 6 mg/g(批号20160102)、0.022 1~0.031 0 mg/g(批号20160201),3批松栀丸样品的大黄素含量有明显差异(<0.01)。可见,不同批次样品的大黄素含量不同,据此可以区分不同批次的松栀丸样品。大黄素含量测定结果与指纹图谱模式识别结果一致,两者可相互验证。
表3 松栀丸样品中大黄素含量测定结果(mg/g)
编号含量 编号含量 编号含量 S10.014 5 S210.037 7 S410.023 2 S20.014 4 S220.038 2 S420.023 4 S30.015 1 S230.040 2 S430.023 3 S40.015 2 S240.038 7 S440.026 1 S50.013 6 S250.038 8 S450.023 1 S60.015 5 S260.040 2 S460.023 6 S70.016 0 S270.042 0 S470.025 0 S80.015 6 S280.039 7 S480.022 4 S90.016 0 S290.038 0 S490.023 2 S100.016 2 S300.036 7 S500.022 1 S110.017 1 S310.037 7 S510.023 5 S120.015 8 S320.043 2 S520.025 0 S130.015 3 S330.041 7 S530.024 2 S140.015 0 S340.042 4 S540.024 0 S150.014 8 S350.043 6 S550.024 4 S160.015 1 S360.041 1 S560.023 0 S170.014 8 S370.039 0 S570.031 0 S180.013 9 S380.042 7 S580.027 8 S190.013 5 S390.040 7 S590.029 0 S200.014 0 S400.040 5 S600.027 8
3 讨论
为提高松栀丸的质量控制水平,本研究采用HPLC建立松栀丸的指纹图谱,共标定17个共有峰,对其中大黄素进行了含量测定,结果表明不同批次的松栀丸样品大黄素含量差异较大。为比较不同批次样品之间差异,采用无监督模式识别PCA和有监督模式识别OPLS-DA,结果显示不同批次样品间有差异,3个批次样品有明显分开趋势,同一批次样品间差异较小,每一批次的样品都有集中趋势。批号20160102(S21~S40)与批号20160201(S41~S60)样品虽明显分为2个区域,但距离相对较近,批号20160101(S1~S20)分布的区域距离另2批样品的区域相对较远,表明此批号样品制备工艺与其他2批差异较大,而批号20160102(S21~S40)与批号20160201(S41~S60)的制备工艺较为接近。本研究建立的松栀丸指纹图谱共有模式较为理想,结合模式识别方法对不同批次松栀丸样品进行综合评价,可为松栀丸质量的全面控制提供参考。
[1] 湖南湘潭市继蒙中草药肝病研究所.松栀丸:CN00113403.5[P]. 2001-06-27.
[2] 王灵台,高月求,陶其敏,等.松栀丸治疗湿热蕴结兼气滞血瘀证慢性丙型肝炎临床研究[J].中西医结合肝病杂志,2016,26(4):196-199.
[3] 湘泉.我国治疗丙型肝炎的第一个中成药——松栀丸近获国家新药证书[J].中医药导报,2007,13(11):7.
[4] DONNO D, BOGGIA R, ZUNIN P, et al. Phytochemical fingerprint and chemometrics for natural food preparation pattern recognition:an innovative technique in food supplement quality control[J]. Journal of Food Science and Technology,2016,53(2):1071-1083.
[5] DECONINCK E, DJIOGO C A S, KAMUGISHA A, et al. The use of stationary phase optimized selectivity liquid chromatography for the development of herbal fingerprints to detect targeted plants in plant food supplements[J]. Talanta,2017,170(8):441- 450.
[6] BORAN H, YAQING Y, YONG Z, et al. Proton nuclear magnetic resonance-spectroscopic discrimination of wines reflects genetic homology of several different grape (L.) cultivars[J]. PLoS One,2015,10(12):1-16.
Pattern Identification of Fingerprint ofPills and Determination of Emodin by HPLC
SU Qian, HU Yuzhen, LUO Kun, XIA Bohou, ZHANG Zhimin, LI Yamei, LIN Yan
To establish an HPLC fingerprint ofPills and determine the content of the main difference component (emodin); To provide the basis for the quality evaluation ofPills.HPLC was used to detect 3 batches (a total of 60 samples) ofPills. Similarity analysis was counted through TCM Chromatographic Fingerprint Similarity Evaluation System (V2.0). Principal component analysis (PCA) and orthogonal partial least squares-discrimination analysis (OPLS-DA) were used to evaluate, find the difference components and detect their contents.The fingerprint ofPills was established. 17 common peaks were obtained with similarities between 0.898 and 0.971. PCA and OPLS-DA could basically separate different batches ofPills, and emodin was determined as the main different chemical component ofPills. The contents of emodin in the three batches ofPills were 0.013 5–0.017 1 mg/g, 0.036 7–0.043 6 mg/g, 0.022 1– 0.031 0 mg/g, respectively.The HPLC fingerprint combined with PCA and OPLS-DA methods can quickly evaluate the quality ofPills, providing references for quality control ofPills.
Pills; fingerprint; emodin; pattern identification

R284.1
A
1005-5304(2020)05-0070-05
10.3969/j.issn.1005-5304.201903365
林艳,E-mail:linyan198210@163.com
(2019-03-27)
(2019-04-29;编辑:陈静)

