白头翁汤对人肺腺癌细胞增殖及周期调控的影响
金燊懿,许玲
白头翁汤对人肺腺癌细胞增殖及周期调控的影响
金燊懿1,2,许玲1,3
1.上海中医药大学,上海 200120;2.上海中医药大学附属曙光医院,上海 200120;3.上海中医药大学附属岳阳中西医结合医院,上海 200080
观察白头翁汤对人肺腺癌细胞增殖及周期阻滞、促凋亡的影响,初步探讨其抗癌作用机制。以人肺腺癌细胞株A549、H1975细胞为研究对象,不同浓度白头翁汤干预后,运用CCK8法检测A549、H1975细胞增殖,细胞克隆形成实验观察A549、H1975细胞克隆形成,流式细胞术检测A549细胞周期,Western blot检测A549细胞周期相关蛋白CDK1、CyclinB1和细胞凋亡相关蛋白Caspase 8、9、3及PARP、Bcl2的表达。与对照组比较,不同浓度白头翁汤均能抑制A549、H1975细胞增殖和细胞克隆形成,不同浓度白头翁汤G2/M期细胞比例明显增加,且将A549肺腺癌细胞周期阻滞在G2/M期,0.2 mg/mL白头翁汤均明显降低CDK1、CyclinB1和Caspase 8、9、3及PARP、Bcl2蛋白的表达。白头翁汤有促进人肺腺癌细胞凋亡的作用,其机制可能与其降低细胞周期和细胞凋亡相关蛋白的表达有关。
肺腺癌;白头翁汤;细胞增殖;细胞周期;细胞凋亡
肺癌是世界上发病率和死亡率均位居前2位的恶性肿瘤,严重危害人类的健康[1]。腺癌是非小细胞肺癌常见的病理类型之一[2]。手术是根治早期肺腺癌的首选手段[3]。随着对肺腺癌发病机制深入研究,逐渐形成了以化疗、放疗、分子靶向治疗、免疫治疗等综合手段有效提高肺腺癌患者生存率、改善患者临床症状的治疗方案[4]。而上述治疗手段所涉及的抗癌理论中,调控细胞周期是一种经典的抗癌途径[5]。肿瘤是一类细胞周期失常疾病,因此,阻滞肿瘤细胞周期成为肿瘤治疗的重要策略之一。
白头翁汤出自《伤寒杂病论》,由白头翁、黄柏、黄连和秦皮4味药物组成,主要功效为清热解毒、止痢凉血。临床主要用于治疗痢疾和消化系统肿瘤等[6-10]。而少有将本方用于治疗呼吸系统肿瘤,同时对白头翁汤内在的抗肿瘤机制研究较少,这无疑限制了白头翁汤临床上的扩展运用。本实验在前期文献研究的基础上,以体外细胞培养形式,运用CCK8法、细胞克隆形成实验、流式细胞术及Western blot方法,观察白头翁汤对肺腺癌细胞增殖及周期的影响,初步探讨其抗癌的作用机制。
1 实验材料
1.1 细胞
人非小细胞肺腺癌细胞株A549、H1975,购自美国模式培养物保藏中心(ATCC),编号分别为CRM-CCL-185TM、CRM-5908TM。
1.2 主要试剂与仪器
DMSO(Sigma公司,批号#RNBD4071),RPMI1640培养基(Gibco公司,批号#1967410),胎牛血清(Gibco公司,批号#42F9683K),CCK8(上海生工有限公司,批号#EC07FC0251),结晶紫(Sigma公司,批号#MKCG7859),台盼蓝(索莱宝公司,批号#71752241),4%多聚甲醛(塞维尔公司,批号#G1101),细胞周期试剂盒(BD公司,批号#8012947),BCA蛋白定量试剂盒(Bio-Rad公司,批号#RH237552),RIPA裂解液(Intech公司,批号#INW2102),二抗HRP(Biotech公司,批号#123795),一抗CDK1、CyclinB1(CST公司,批号#9116、#12231)。MCO-18AIC CO2细胞培养箱(Sanyo公司),多功能酶标仪(Thermo公司),流式细胞仪(BD公司),17R低速冷冻离心机(Thermo公司),显微镜(OLYMPUS公司),电泳仪(Bio-Rad公司)。
1.3 药物及制备
白头翁汤(白头翁15 g,黄柏12 g,黄连6 g,秦皮12 g),颗粒剂购自四川新绿药有限公司,颗粒剂与饮片比例为1∶15.063。将颗粒剂用研钵研成粉末状,称取400 mg颗粒剂粉末,加入1 mL DMSO溶解,振荡30 min,放置在超声机内,水浴超声1 h至颗粒剂粉末完全溶解,配制成浓度为400 mg/mL母液,置于4 ℃冰箱保存。
2 实验方法
2.1 细胞培养
将细胞置于含10%胎牛血清和1%双抗RPMI培养基,5%CO2、37 ℃培养箱中培养。0.25%胰蛋白酶消化并收集细胞,取对数生长期细胞进行实验。
2.2 细胞增殖检测
取处于对数生长期A549、H1975细胞,制成细胞悬液,用培养基将细胞密度调整为2×104个/mL,将细胞以3000个/孔,每孔100 μL接种于96孔板中,放入培养箱,继续培养24 h,待细胞贴壁后分别加入浓度为0、0.01、0.1、0.5、1 mg/mL白头翁汤。各浓度均设置6个复孔。放入培养箱中继续培养48 h,避光,每孔加入10 μL CCK8试剂,用锡纸包裹96孔板,置于培养箱中孵育1.5 h,于波长450 nm处测定吸光度(OD值)。计算细胞存活率[实验组OD值÷对照组OD值×100%],采用GraphPad Prime7软件计算白头翁汤半数抑制浓度(IC50)。
2.3 细胞克隆形成实验
取对数生长期A549、H1975细胞,消化后制成细胞悬液,以10 000个/孔细胞数接种于小细胞培养皿中,8 mL/孔,每组设3复孔,用含10%FBS的培养基进行培养。加药组按IC50值0.04 mg/mL设置药物浓度,分别为0.02 mg/mL和0.04 mg/mL。培养箱中连续培养6 d,吸去上清液,加入PBS清洗2次,4%多聚甲醛室温固定细胞1 h,吸去固定液,加入0.5%结晶紫染液1 mL/孔,染色30 min,吸去染液,洗净培养皿,晾干后对克隆进行计数。
2.4 流式细胞术检测A549细胞周期
将对数生长期A549细胞以1×105个/孔接种于6孔板,给药组加0.01、0.04、0.08、0.10 mg/mL白头翁汤,对照组加与最高浓度等体积DMSO,干预48 h,细胞消化离心,去掉上清液,收集细胞团块,PBS重新沉悬细胞,离心,清洗1次,弹击流式上样管底部,使细胞沉淀分散,先加入300 μL、4 ℃预冷PBS,再将上样管置于涡旋振荡器上,振荡上样管,加700 μL、4 ℃预冷的纯乙醇沉悬,4 ℃固定过夜。次日离心弃去上清液,PBS洗1次,加500 μL PI染液,室温避光孵育15 min,上流式细胞仪检测,用Flowjo软件分析细胞周期时相分布。
2.5 Western blot检测细胞周期和凋亡相关蛋白表达
0.2 mg/mL白头翁汤分别干预A549细胞16、32、48 h,依次收取蛋白,按BCA试剂盒说明书测定蛋白浓度,取50 μg/孔蛋白样品进行10%SDS-PAGE分离,用湿转法(30 V,16~20 h)将蛋白转移至PVDF膜,2%脱脂奶粉室温摇床封闭2 h,TBST洗膜3次,分别加入GAPDH,CDK1,CyclinB1,Caspase 8、9、3,PARP,Bcl2一抗(1∶1000),4 ℃孵育过夜。用TBST洗膜3次,加入二抗(1∶10 000),室温孵育2 h,TBST洗膜3次,加入ECL,用化学发光凝胶成像仪检测,使用Image J软件对蛋白条带进行光密度分析。
3 统计学方法
4 结果
4.1 白头翁汤对A549、H1975细胞增殖的影响
与对照组比较,白头翁汤各浓度组均可明显抑制A549、H1975细胞增殖,差异有统计学意义(<0.05),并呈浓度依赖性。A549、H1975细胞IC50分别为0.04、0.07 mg/mL。结果见图1、表1。
4.2 白头翁汤对A549、H1975细胞克隆形成的影响
与对照组比较,白头翁汤中、低剂量组均能显著抑制A459、H1975细胞克隆形成,差异有统计学意义(<0.001)。结果见表2。
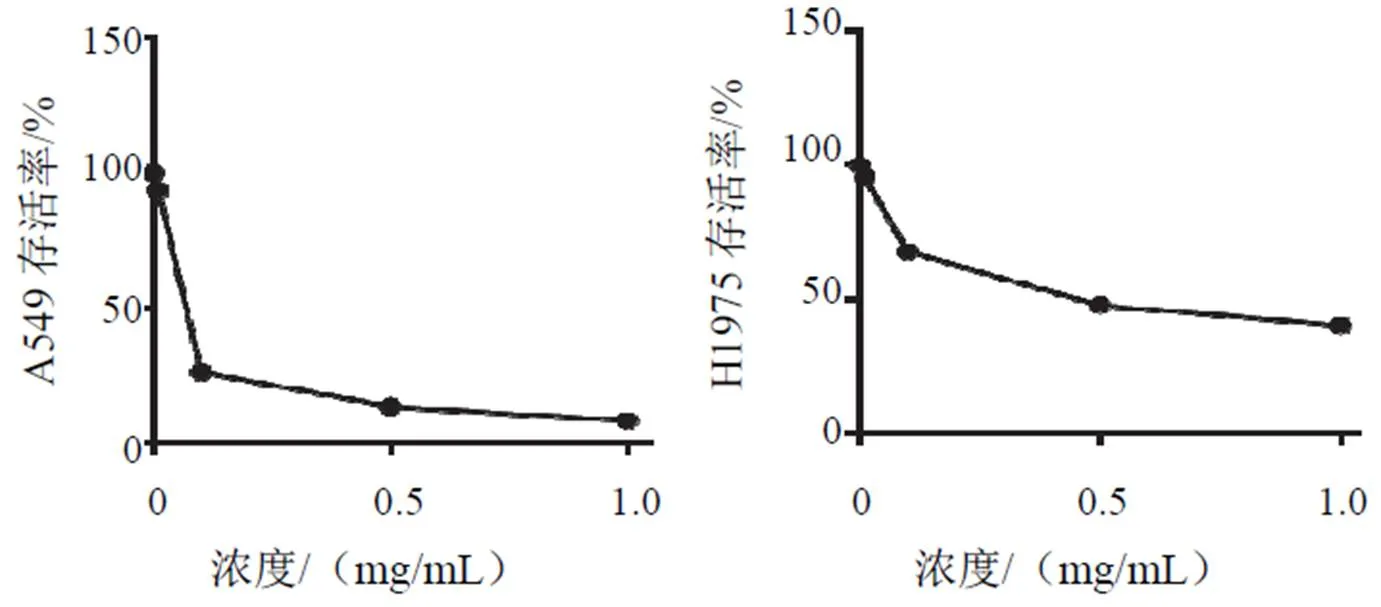
图1 白头翁汤干预48 h对A549、H1975细胞增殖的影响
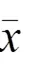
表1 各组A549、H1975细胞增殖水平比较(±s,OD值)
注:与对照组比较,*<0.05,***<0.001
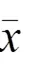
表2 各组A549、H1975细胞克隆形成比较(±s,个)
注:与对照组比较,***<0.001
4.3 白头翁汤对A549细胞周期的影响
与对照组比较,白头翁汤中、高剂量组均将A549细胞阻滞在G2/M期,细胞比例分别为(39.2±3.9)%、(66.7±2.5)%(<0.05)。结果见图2、表3。

图2 白头翁汤干预后A459细胞周期流式细胞图
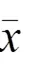
表3 各组A549细胞不同细胞周期细胞比例比较(±s,%)
注:与对照组比较,*<0.05
4.4 白头翁汤对细胞周期和凋亡相关蛋白表达的影响
与对照组比较,白头翁汤干预16 h时可提高CyclinB1蛋白的表达,差异有统计学意义(<0.05),而32、48 h时间段均可降低蛋白的表达,差异有统计学意义(<0.05);并在16、32、48 h均可降低CDK1蛋白表达,差异有统计学意义(<0.05),同时降低凋亡相关蛋白Caspase 8、9、3及PARP、Bcl2的表达,差异有统计学意义(<0.05)。结果见图3。
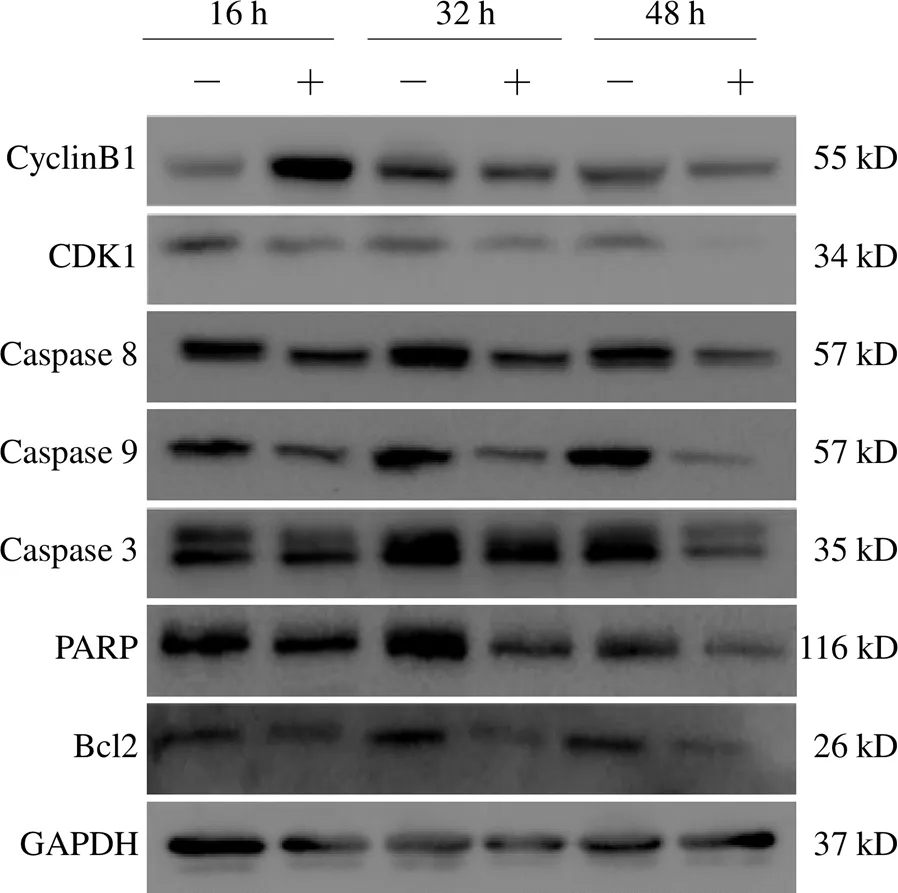
图3 白头翁汤干预后A549细胞各凋亡、周期相关蛋白免疫印迹图
5 讨论
《灵枢•本输》“肺合大肠,大肠者,传道之府”,《灵枢•九针论》“手阳明太阴为表里”,《素问•五脏生成篇》“咳嗽上气,厥在胸中,过在手阳明、太阴”,《素问•咳论篇》云:“肺咳不已,则大肠受之,大肠咳状,咳而遗矢。”可见,古代医家早已了解到两者的关联,并将肺与肠道的关系总结为“肺与大肠相表里”,认为肺与肠道之间存在生理病理上的联系,通过调治肠道以达治疗肺部疾患的目的。
中医学认为,湿热毒邪是肿瘤发生发展的重要原因,而清热解毒法是其治疗的基本方法。湿邪重浊、黏滞,湿聚生痰;热邪可炼液为痰,痰热胶结,又阻碍气血运行而为瘀,痰瘀互结,久之发为肿物[11]。清热解毒法不仅具有直接抑制肿瘤增殖的作用,通过调控细胞周期相关蛋白,进而阻滞肿瘤细胞周期;也可调节凋亡相关基因如Bcl2,促进肿瘤细胞凋亡等[12-13]。
肿瘤细胞也通过对细胞外基质的重建、血管新生、代谢的调节和免疫监视功能的抑制等途径在微环境中得以无限增殖[14]。细胞周期的顺利进行是细胞增殖的重要条件。干扰或破坏这一过程,可达到抑制细胞增殖的目的[15]。前期CCK8细胞增殖实验研究发现,白头翁汤干预后,对肺腺癌A549细胞增殖具有较好的抑制作用。因此,本研究从细胞周期入手,进一步阐释白头翁汤抑制肺癌细胞增殖机理。
周期相关蛋白在调控细胞周期过程中发挥主要作用,CyclinB1和CDK1均是关键的G2/M期周期检查点蛋白,这2个蛋白涉及细胞G2/M期的转化,促进细胞进入M期,保证有丝分裂正常进行。而细胞周期检查点蛋白调节异常是癌症形成的关键标志,产生不受控制的细胞生长和肿瘤发生。CyclinB1蛋白可与CDK1蛋白结合形成蛋白复合物,两者在细胞周期的早期不断积累,于G2期达到峰值,之后在M期中期时迅速降解,细胞进入M期的后期。所以,当CyclinB1蛋白和CDK1蛋白表达降低时,可将肿瘤细胞阻滞在G2/M期,达到抑制细胞增殖的目的。
本实验通过CCK8与细胞克隆形成实验探讨白头翁汤对肺腺癌A549细胞增殖与克隆形成的影响,结果表明,白头翁汤能抑制A549细胞的增殖与克隆形成。流式细胞实验结果发现,白头翁汤干预48 h后,肺腺癌A549细胞在G2/M期的细胞比例与对照组比较明显升高;而Western blot检测发现,白头翁汤干预16、32、48 h后,肺腺癌A549细胞中CDK1蛋白表达均明显降低,表明其阻滞细胞周期的机制可能与CDK1表达下调有关;而CyclinB1蛋白表达逐渐升高,而后表达降低,说明白头翁汤可通过调节CyclinB1、CDK1表达,使细胞大量进入G2/M期。
细胞凋亡主要与促凋亡蛋白Caspase家族和抗凋亡蛋白Bcl2家族有关。细胞凋亡是细胞死亡的主要方式之一,当细胞受到物理和化学信号刺激时,凋亡相关蛋白分子开始活化发挥促凋亡作用,Caspase家族蛋白根据功能不同可以分为启动和效应Caspase蛋白。Caspase 8、9蛋白都是细胞凋亡的启动者,接收到凋亡信号后,两者会被切割活化。活化后可剪切效应Caspase 3蛋白,激活Caspase 3 蛋白,该蛋白被认为是Caspase线粒体依赖的细胞凋亡途径的主要承担者,激活触发PARP蛋白发生切割,最终导致细胞凋亡。Bcl2蛋白是机体细胞抗凋亡的主要蛋白之一。Bcl2蛋白过表达可促进损伤的DNA修复,阻止细胞发生凋亡。Western blot检测发现,白头翁汤干预可降低肺癌细胞Caspase 8、9、3及PARP、Bcl2蛋白的表达,表明白头翁汤可能通过下调这些蛋白的表达,诱导肺腺癌A549细胞凋亡。
综上,白头翁汤在肺腺癌领域中的研究与应用尚处于初级阶段,临床疗效的评价研究目前也尚属空白,其更深层次的抗肿瘤分子机制还未明了,这无疑限制了白头翁汤抗肺腺癌的临床运用。本研究初步开展白头翁汤抗肺腺癌的基础研究,为白头翁汤的抗肺腺癌临床应用提供一定的依据,也可为“肺与大肠相表里”理论提供依据。
[1]SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA:A Cancer Journal for Clinicians,2019,69(1):7-34.
[2] OSMANI L, ASKIN F, GABRIELSON E,et al. Current WHO guidelines and the critical role of immunohistochemical markers in the subclassification of non-small cell lung carcinoma (NSCLC):Moving from targeted therapy to immunotherapy[J]. Seminars in Cancer Biology,2018,52:103-109.
[3] MOLINA J R, YANG P, CASSIVI S D, et al. Non-Small cell lung cancer:epidemiology, risk factors, treatment, and survivorship[J]. Mayo Clinic Proceedings,2008,83(5):584-594.
[4] HERBST R S, MORGENSZTERN D, BOSHOFF C. The biology and management of non-small cell lung cancer[J]. Nature,2018,553(7689):446-454.
[5] PAWLIK T M, KEYOMARSI K. Role of cell cycle in mediating sensitivity to radiotherapy[J]. International Journal of Radiation Oncology Biology Physics,2004,59(4):928-942.
[6] 谢利梅.白头翁汤的临床应用[J].北京中医,2005,24(3):166-167.
[7] 苏慕鹤,杨晓红.中药直肠滴注治疗肿瘤的体会[J].实用中医药杂志, 2000,16(6):42-43.
[8] 梅命珠,柴妮,杨琼,等.朱惠蓉“以通为用”论治大肠癌经验浅谈[J].上海中医药杂志,2016,50(10):29-31.
[9] 胡正国,陈冬,庞德湘.庞德湘教授运用经方白头翁汤加减治疗直肠癌经验[J].黑龙江中医药,2015,44(6):30-31.
[10] 江如,肖静,李连明,等.白头翁汤治疗宫颈癌放射性直肠炎临床观察[J].江西中医学院学报,2011,23(2):38-39.
[11] 巨大维,魏品康.清热解毒中药在恶性肿瘤防治中的药用机理与应用[J].吉林中医药,2007,27(1):60-62.
[12] 周燕萍,杨航,关江峰,等.清热解毒类与活血化瘀类中药对肺癌A549细胞增殖抑制的机制研究[J].光明中医,2013,28(10):2033-2036.
[13]阮善明,沈敏鹤,李梦婷,等.清热解毒法基于Bcl-2/Bax等凋亡信号通路调控结肠癌的研究[J].中华中医药学刊,2013,31(7):1531- 1534.
[14] JOYCE J A, POLLARD J W. Microenvironmental regulation of metastasis[J]. Nature Reviews Cancer,2009,9(4):239-252.
[15] XIE X H, LIN W Z, ZHENG W L. Downregulation of G2/mitotic- specific cyclinB1 triggers autophagy via AMPKULK1-dependent signal pathway in nasopharyngeal carcinoma cells[J]. Cell Death Dis,2019,10(2):94.
Effects ofDecoction on Proliferation and Cycle Regulation of Human Lung Adenocarcinoma Cells
JIN Shenyi1,2, XU Ling1,3
To explore the effects ofDecoction on proliferation, cell cycle arrest and apoptosis of human lung adenocarcinoma cells; To preliminarily explore its anti-cancer mechanism.Human lung adenocarcinoma cell lines A549 and H1975 were used as the research object. After intervention with different concentrations ofDecoction, CCK8 method was used to detect proliferation of A549 and H1975 cells. Cell clones formation experiment were used to observe the formation of A549 and H1975 cells. Cell cycle of A549 was detected by flow cytometry. The expressions of cell cycle-associated proteins CDK1, CyclinB1 and apoptosis-related proteins Caspase 8, 9, 3, PARP and Bcl2 were detected by Western blot.Compared with the control group, the proliferation and cell clone formation of A549 and H1975 cells could be inhibited by different concentrations ofDecoction; G2/M phase cell ratio significantly increased by different concentrations ofDecoction; A549 lung adenocarcinoma cell cycle was arrested in G2/M phase; 0.2 mg/mLDecoction significantly reduced the protein expressions of CDK1, CyclinB1 and Caspase 8, 9, 3, PARP, Bcl2.Decoction can promote the apoptosis of human lung adenocarcinoma cells. The mechanism may be related to reducing the expressions of cell cycle and apoptosis-related proteins.
lung adenocarcinoma cells;Decoction; cell proliferation; cell cycle; cell apoptosis

R285.5
A
1005-5304(2020)05-0048-05
10.3969/j.issn.1005-5304.201911079
国家自然科学基金(81904163);上海市进一步加快中医药事业发展三年行动计划[ZY(2018-2020)-CCCX-2004-09];上海市科学技术委员会“扬帆计划”(19YF1450000);上海中医药大学研究生“创新能力培养”专项科研项目(Jx61.02.03.48)
许玲,E-mail:xulq67@aliyun.com
(2019-11-05)
(2019-11-23;编辑:华强)

