IMD1-53通过miR-34a延缓泡沫细胞脂质聚集
孙卓成,马生贤,田 荣,张 玲,李思睿,杨晓玲
中介素(IMD)是2004年新发现的血管活性多肽,属于降钙素基因相关肽超家族成员(CGRP)[1],其前体蛋白在体内可以酶解为IMD1-47、IMD8-47和IMD1-53等三个活性片段[2]。研究显示,IMD1-53除了具有舒张血管[3]、降低血压[4]等作用外,还能抑制泡沫细胞的形成[5]。miRNAs是20~25 nt的具有调控功能的非编码RNA,在体内参与了多个生物学过程,而miR-34a参与了动脉粥样硬化的发生发展[6]。但是IMD1-53是否通过miR-34a抑制泡沫细胞的形成尚不清楚。本研究以泡沫细胞为研究对象,探讨miR-34a在IMD1-53抑制泡沫细胞脂质沉积中的作用,为临床脂代谢紊乱相关疾病的研究提供依据。
1 资料与方法
1.1 一般资料:IMD1-53购自凤凰制药公司,RPMI-1640培养基和胎牛血清购自Gibco公司,DNA 提取试剂盒购自碧云天生物科技公司、RNA 提取试剂盒购自天根生物有限公司,荧光定量PCR 试剂盒购自TaKaRa公司,DNA修饰试剂盒购自美国Zymo公司,TC和TG检测试剂盒购自南京建成公司。引物由上海生工生物工程公司合成。
1.2 细胞培养:参考文献方法培养THP-1细胞[7],先用佛波酯(终浓度为100 nM)刺激24 h 使之分化为巨噬细胞,再用氧化低密度脂蛋白(终浓度50 mg/L)刺激24 h 使之变成泡沫细胞。将诱导成功的泡沫细胞随机分为对照组、IMD1-53干预组(终浓度为1 μM),继续培养24 h,用于后续实验。
1.3 荧光定量PCR检测泡沫细胞miR-34的mRNA水平:用Trizol试剂按操作说明方法提取细胞总RNA,紫外分光光度计检测总RNA的A260和A280。按照miRNA逆转录试剂盒说明书制备cDNA,首先向miRNA加Poly尾进行修饰,然后合成miRNA cDNA第一链。合成的cDNA用于下游PCR扩增条件:95 ℃ 5 min启动,94 ℃ 15 s,55 ℃ 30 s,70 ℃ 30 s进行40个循环。表达量用内参U6进行校正,结果用2-△△CT法分析。
1.4 甲基化特异性PCR检测miR-34a启动子甲基化:按照试剂盒说明书提取细胞DNA,并对基因组DNA进行甲基化处理。由于DNA甲基化常发生于基因启动子区CpG岛中的胞嘧啶,因此,在UCSC(http://www.genome.ucsc.edu/cgi-bin/hgGateway)网站中寻找miR-34a基因启动子区序列,使用甲基化引物设计软件(htty://www.urogene.org/methprimer)设计miR-34a的引物,包括甲基化引物和未甲基化引物。序列如下:甲基化引物,上游:5’- GGGATTAGGTTTTGAACGC-3’,下游:5’-CCTAAAAACAAAAAACGCGT-3’;未甲基化引物,上游:5’-AAAGGGATTAGGTTTTGAATGT-3’,下游:5’-TCCTAAAAACAAAAAACACATAC-3’。扩增产物用DNA琼脂糖凝胶电泳,凝胶扫描观察分析结果。
1.5 细胞内胆固醇含量测定:用刮刀刮取培养的细胞,制成细胞悬液,PBS洗涤3次,超声裂解1 min,考马斯亮蓝G-250对样品中的蛋白进行定量,1 000 r/min离心10 min,弃去上清液;收集细胞沉淀,超声破碎细胞后在96孔板空白孔、校准孔、样本孔中分别加入蒸馏水、校准品、样本与工作液,酶标仪测定吸光度值,再用对应公式计算细胞内胆固醇含量(TC)和甘油三酯含量(TG)。
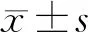
2 结果
2.1 IMD1-53抑制泡沫细胞脂质聚集:泡沫细胞经IMD1-53处理后,泡沫细胞内TC和TG的含量分别降低36.4%和37.8%,差异有统计学意义(P<0.05),见表1。
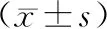
表1 IMD1-53对泡沫细胞内TC和TG的影响
2.2 IMD1-53对泡沫细胞miR-34a mRNA和甲基化的影响:与正常对照组相比,IMD1-53组泡沫细胞内miR-34a的表达减少了62.2%,差异有统计学意义(P<0.05)。进一步用甲基化PCR检测泡沫细胞启动子区的甲基化水平,结果显示与正常对照组相比,IMD1-53处理泡沫细胞后,miR-34a启动子区甲基化水平升高了1.05倍,差异有统计学意义(P<0.05),见表2。
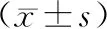
表2 IMD1-53对泡沫细胞miR-34a mRNA和甲基化的影响
3 讨论
动脉粥样硬化斑块中的泡沫细胞绝大部分来自于血液单核细胞,当发生炎症时,单核细胞向炎症部位浸润并伸出伪足变成巨噬细胞,进一步吞噬ox-LDL以及过量的胆固醇生成脂滴,最终触发泡沫细胞的形成[8]。因此,减少泡沫细胞内脂质沉积能够延缓动脉粥样硬化的发生发展。
IMD又称为肾上腺髓质素2,是降钙素相关基因肽超家族的新成员,具有扩张血管、降低血压、稳定血管内皮屏障等作用,是一种强的内源性的心血管保护因子,具有潜在的临床应用前景[3-4]。本研究结果显示,泡沫细胞用IMD1-53干预后,细胞内胆固醇和甘油三酯水平明显降低,表明IMD1-53能够抑制泡沫细胞内的脂质沉积,与文献报道一致[5]。但IMD1-53是通过哪些机制影响泡沫内脂质沉积尚不清楚。
miRNAs是一类由内源性基因编码的小分子非编码RNA,可通过诱导mRNA的降解、翻译抑制或其它形式抑制靶基因的表达,在调控生物体的生长、发育及分化等方面发挥重要作用。研究显示,miR-34a在乳腺癌中主要作用为抑制癌细胞生长、增殖及迁移[9],其还可与c-myc结合,降低c-myc的蛋白表达水平,从而抑制肺癌[10-11]。另外,miR-34a可通过调控靶基因Notch1参与乳腺癌细胞凋亡[12]。由此可见,miR-34a在许多疾病中发挥重要作用。另有研究报道,抑制miR-34a的表达,可减少心肌细胞凋亡[13-14],因此,miR-34a可能是心血管疾病治疗的重要靶点。本研究结果显示,用IMD1-53处理泡沫细胞后,miR-34a表达降低,提示IMD1-53抑制泡沫细胞内的脂质沉积与下调miR-34a的表达有关。DNA甲基化是表观遗传学的重要内容,能够逆向调控基因的表达[15],常常发生于基因启动子区的CpG岛[16]。我们用生物信息学分析了miR-34a启动子区的甲基化情况,发现在其启动子上游约350~580 bp附近有一个CpG岛,提示miR-34a的表达可能受到甲基化调控。进一步用甲基化特异性PCR检测miR-34a启动子甲基化水平,发现IMD1-53干预泡沫细胞后,miR-34a启动子区甲基化水平明显增加,提示miR-34a启动子高甲基化可能是IMD1-53延缓脂质沉积的重要机制。
综上所述,IMD1-53可抑制THP-1单核源性泡沫细胞miR-34a的表达,延缓泡沫细胞的形成,miR-34a启动子区甲基化在IMD1-53延缓泡沫细胞脂质形成中具有重要作用,但IMD1-53是如何影响miR-34a启动子区甲基化的机制,还需要进一步探究。

