重组抗原p29免疫保护小鼠细粒棘球蚴感染的差异长链非编码RNA的筛选研究
王 浩,佟雪琪,朱明星,赵嘉庆,赵 巍
包虫病是一种寄生虫蚴虫感染人体或家畜而引发的严重危害人畜健康的慢性感染性疾病。该病分布广泛,世界范围内多个地区与国家均有流行。在我国,目前已经证实有25个省区存在感染病例,尤其在西部等畜牧业发达地区,人群患病率为0.6%~4.5%[1]。宁夏是我国包虫病发病最高的地区之一,有数据表明,宁夏川区和城市的阳性率分别达到了7.9%和5.8%,南部山区包虫病血清阳性感染率为10.6%,B超筛查发现宁夏西吉县中学生感染阳性率为2.1%[2]。长链非编码RNA(lncRNA)是一类长度>200碱基的非编码RNA。研究表明,lncRNA调控细胞多种生理过程,病理状态下参与多种疾病包括肿瘤、感染、自身免疫病等的发生与发展,是当前的研究热点[3-5]。本课题组前期研究表明,重组抗原p29作为潜在的疫苗在绵羊中展现出抗细粒棘球蚴感染的保护作用,具有作为包虫病疫苗转化应用的可能性[6]。然而lncRNA是否参与了p29的免疫保护作用尚不清楚。因此,本研究在小鼠腹腔继发感染模型中,采用重组抗原p29免疫接种小鼠,收集血液中外周血单个核细胞(PBMCs),提取总lncRNA并测序,经高通量测序及生物信息学分析,寻找p29免疫保护过程中的lncRNA差异分子,为丰富p29疫苗预防包虫病的分子机制提供基础研究资料。
1 资料与方法
1.1 一般资料:45只BALB/c小鼠(雌性,8周龄,SPF 级)购自北京维通利华实验动物有限公司,由宁夏医科大学实验动物中心饲养。原头蚴来源于宁夏医科大学总医院手术切除包虫病患者的完整包囊。具体获取步骤为:将手术剥离的包囊无菌转移至实验室,无菌抽取囊液,4 ℃ 9 000×g离心20 min。将沉淀用PBS缓冲液 (pH 7.2,含有 1 000 μg/mL 青霉素和1 000 U/mL 链霉素)调整浓度为200 μl PBS中含有1 500个原头蚴。原头蚴活性采用台盼蓝染色鉴定,以确保活性>90%。
1.2 主要试剂:配制PBS缓冲液的干粉、青霉素、链霉素、台盼蓝、淋巴细胞分离液均采购于北京索莱宝生物有限公司。Magnetic Core试剂盒购自美国Epicentre公司。Trizol试剂购自美国Invitrogen公司。RevertAid第一链cDNA合成试剂盒、荧光定量PCR试剂盒均购自美国Thermo Fisher Scientific公司。引物由上海生工生物技术公司合成。
1.3 实验动物分组:雌性6~8周龄BALB/c 小鼠[n=45,体重为(25±5) g],随机分为3组(15只/组):空白对照组、感染组、p29+感染组,其中,空白对照组既不感染也不免疫。p29+感染组每只小鼠第1周背部皮下多点免疫接种10 μg重组抗原p29+等体积弗氏完全佐剂;第3周、第5周分别加强免疫接种10 μg重组抗原p29+等体积弗氏不完全佐剂各一次。在实验第12周,感染组与p29+感染组每只小鼠腹腔注射(intraperitoneal,i.p.)1 500原头蚴/200 μl PBS。在感染24周后,剖杀小鼠,采用高通量测序检测各组外周血PBMC细胞中lncRNA分子的变化。
1.4 方法
1.4.1 提取小鼠外周血PBMCs:15 mL离心管中加入3 mL淋巴细胞分离液,随后将抗凝管中血液样本缓慢贴壁加入分离液上层,注意分层,4 ℃ 2 000×g 离心20 min;离心后,吸取中间白膜层到另一支新15 mL离心管,加入10 mL PBS缓冲液并混匀,4 ℃ 1 500×g 离心10 min;再用PBS缓冲液洗一遍,用于接下来的提取RNA。
1.4.2 提取总RNA并测序:将PBMCs细胞中加入1 mL Trizol试剂并混匀,室温静置10 min。随后加入200 μl氯仿,迅速颠倒混匀15 s,室温静置5 min。4 ℃ 12 000×g 离心15 min,样本分为3层,而RNA在上层水相中,故小心吸取上层水相至无RNA酶EP管,注意不要吸到有机相。随后加入400 μl氯仿,4 ℃ 12 000×g 离心15 min。吸取上层水相液到新EP管,加入500 μl异丙醇(提前在-20 ℃冰箱内预冷),4 ℃ 14 000×g 离心30 min。弃上清液,加入500 μl 75%乙醇(用无RNA酶水配置,现用现配)混匀,离心后弃上清液。将含有RNA沉淀的EP管放在超净工作台中吹干,不能太干,否则不利于溶解。最后加入30 μl DEPC水,在OD 260/280 nm测定RNA浓度,并进行1%琼脂糖凝胶电泳鉴定。随后采用Magnetic Core试剂盒建立lncRNA文库后,在中国科学院北京基因组研究所采用Illumina公司Hiseq 2 000高通量测序仪进行测序分析。
1.4.3 生物信息学分析获得差异lncRNA:测序原始数据经质量评估和前处理后,获得高质量reads,利用tophat 2软件将高质量reads比对到小鼠基因组上,并构建转录本。全部reads用Cufflinks软件正态分布化,获得相互比较的表达数据,挑选出长度>200 nt,并且转录本与Hmmer/pfam比对没有比对到已知domain的转录本作为最终的候选lncRNA,差异lncRNA用Cuffidiff软件按照P<0.05且fold change>2的标准获得。
1.4.4 qRT-PCR验证:根据候选lncRNA序列,采用 primer 5.0软件和同源性比较分析网站http://blast.ncbi.nlm.nih.gov/Blast.cgi设计引物并由上海生工公司合成。将之前提取的总RNA备份,采用逆转录试剂盒逆转录获得cDNA,随后采用特异性引物PCR扩增。反应条件为:预变性95 ℃ 2 min,PCR反应变性95 ℃ 10 s,退火58 ℃ 30 s,延伸72 ℃ 30 s,40个循环;溶解曲线 95 ℃ 1 min,55 ℃ 1 min,72 ℃延伸,36个循环。以GAPDH(F:AGGTCGGTGTGAACGGATTTG;R:GGGGTCGTTGATGGCAACA)为内参,每个差异分子分别做3个复孔,重复3次试验。
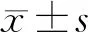
2 结果
2.1 高通量测序及生物信息学分析获得p29免疫后感染原头蚴小鼠PBMCs中的差异lncRNA:通过二代高通量测序,所有reads每一个位置统计质量均值的分布正常(图1,目录后)。进一步采用生物信息学分析测序数据,与感染组相比,p29+感染组PBMCs中共有30个显著差异的lncRNA分子(P<0.05),见表1-表2。
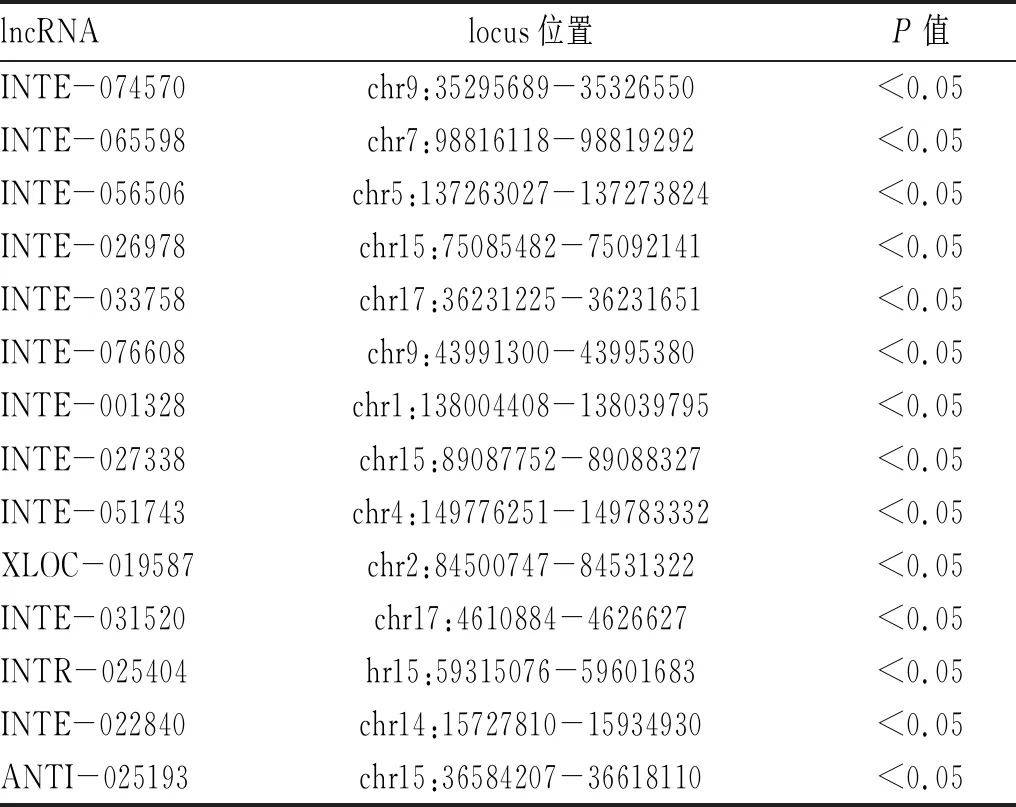
表1 空白对照组与p29+感染组的差异表达lncRNAs分子
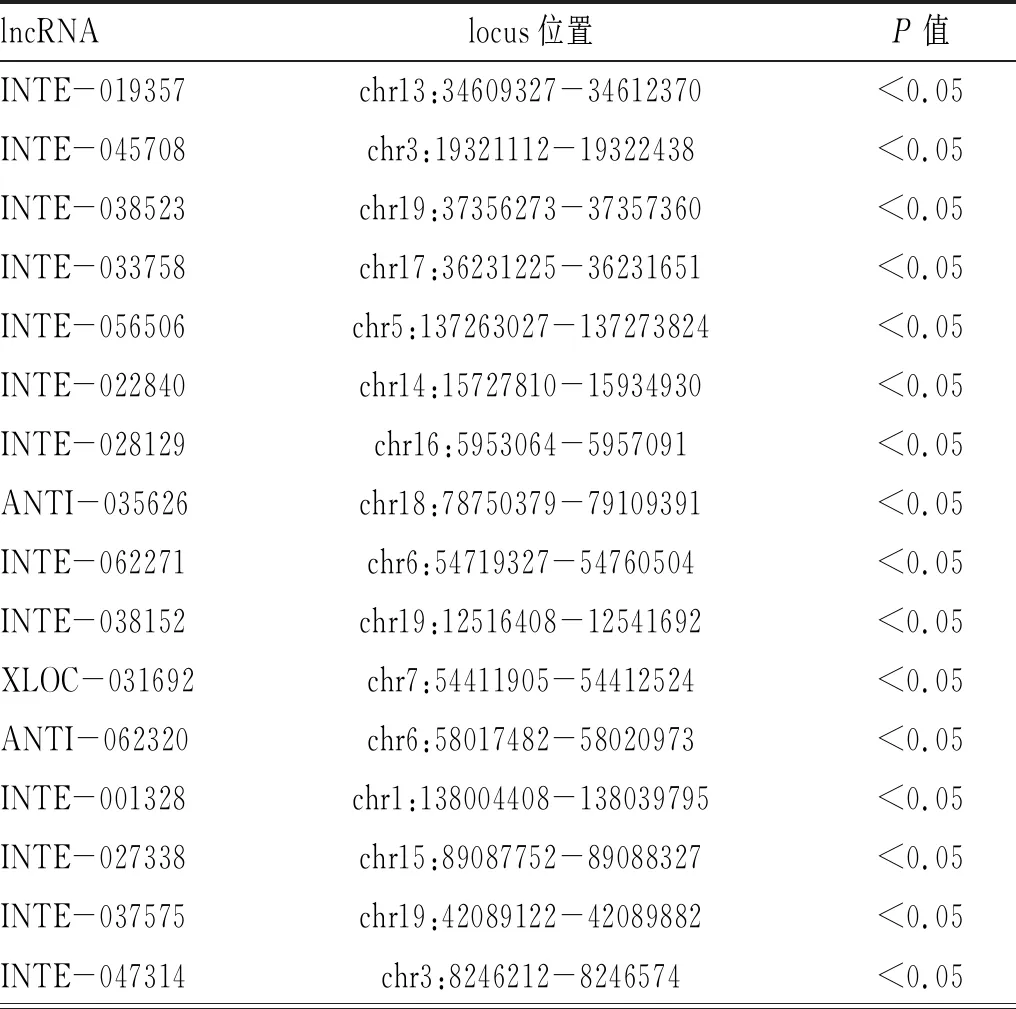
表2 p29+感染组与感染组相比小鼠PBMCs中的差异表达lncRNAs
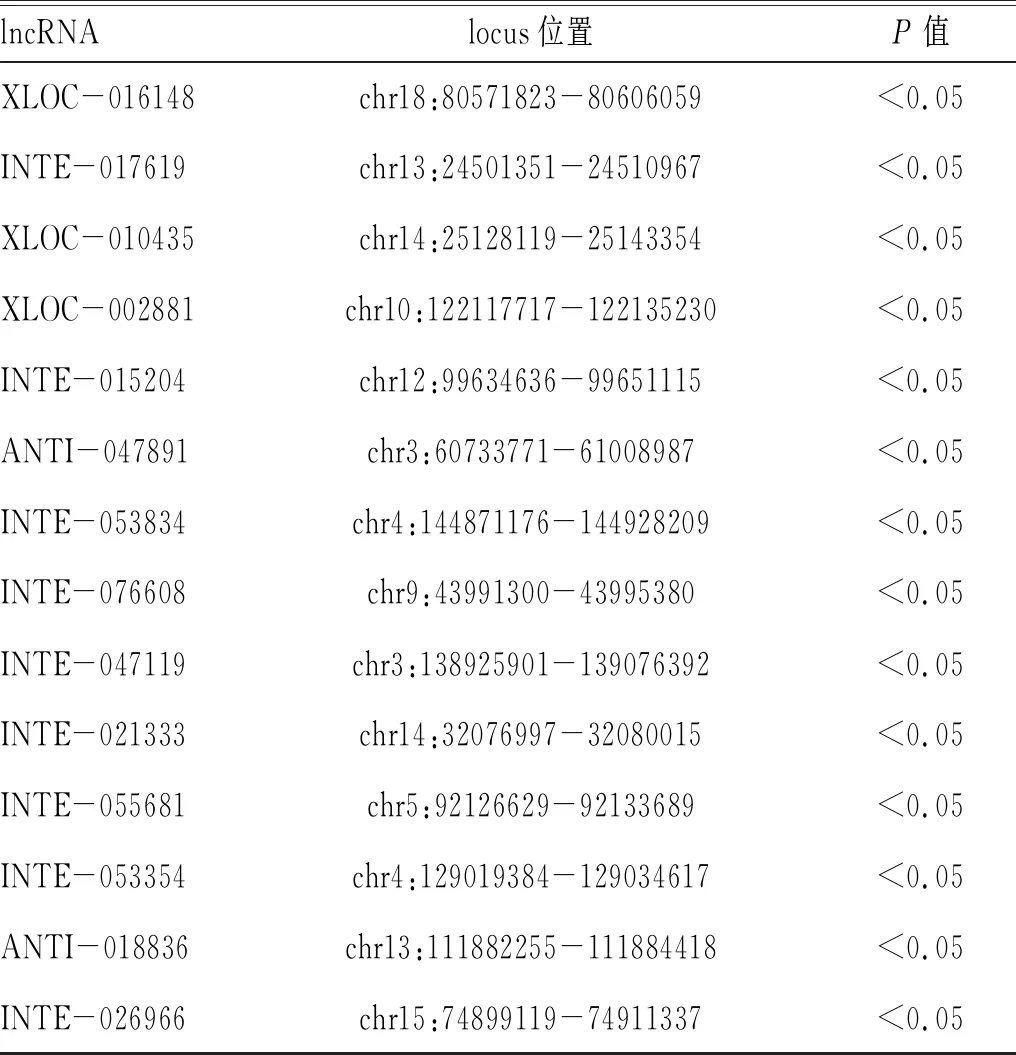
lncRNAlocus位置P值XLOC-016148 chr18:80571823-80606059 <0.05INTE-017619chr13:24501351-24510967 <0.05XLOC-010435chr14:25128119-25143354<0.05XLOC-002881 chr10:122117717-122135230 <0.05INTE-015204 chr12:99634636-99651115<0.05ANTI-047891chr3:60733771-61008987<0.05INTE-053834chr4:144871176-144928209 <0.05INTE-076608chr9:43991300-43995380<0.05INTE-047119 chr3:138925901-139076392 <0.05INTE-021333chr14:32076997-32080015<0.05INTE-055681chr5:92126629-92133689<0.05INTE-053354 chr4:129019384-129034617<0.05ANTI-018836 chr13:111882255-111884418 <0.05INTE-026966 chr15:74899119-74911337<0.05
2.2 qRT-PCR验证p29免疫后感染原头蚴小鼠PBMCs中的候选差异lncRNA:将上述测序获得的30个lncRNA差异分子进行qRT-PCR验证,与感染组相比,p29+感染组PBMC细胞中lncRNA分子XLOC-012763显著降低(P<0.05),INTE-015204显著降低(P<0.05),INTE-028446显著降低(P<0.05),见图2(目录后)。而这三个分子在空白组与感染组之间差异无统计学意义(图2,目录后)。经生物信息学初步分析发现,XLOC-012763与 Dab2ip、Hc、Trem、Oas3基因可能相关,INTE-015204与klf4、Patz1、Cxxl2基因调控可能相关性,INTE-028446与klf4、Jchain基因可能有关联性。
3 讨论
包虫病分为泡型和囊型两种,在我国西部地区包括宁夏南部山区主要以囊型为主,故本研究采用了细粒棘球蚴感染小鼠模型开展研究。本研究前期证实,重组抗原p29疫苗免疫接种绵羊能够获得90%以上的保护力,表明该基因工程重组疫苗p29具有较好的抗包虫感染效果[6]。进一步研究,结果发现经p29疫苗免疫后,抗包虫特异性抗体IgE、IgG及其亚型IgG1、IgG2均显著增加,Th1型细胞因子IL-2、IFN-γ显著升高。这些结果提示p29免疫接种后,显著激活了特异性体液免疫应答,同时有效活化了抗寄生虫感染的Th1细胞,初步说明了p29保护作用的相关免疫机制[6-7]。然而,p29疫苗接种后如何激活免疫、产生保护力的确切细胞及其信号通路分子机制仍不清楚,故本研究团队试图从非编码RNA调控免疫机制方面展开研究。就本研究而言,试图寻找在p29免疫保护作用下感染原头蚴小鼠PBMCs中lncRNA表达的变化。
LncRNA是一种长度>200 nt的非编码RNA,在基因表达调控中发挥重要作用[8]。随着基因组计划的完成,研究发现细菌的基因组编码6 000个基因,线虫的基因组编码19 000个基因,果蝇的基因组编码14 000个基因,而人的基因组也就只编码20 000~25 000个基因,这表明高等生物的复杂性并不是由基因组所编码的基因数目所决定的[9]。低等生物到高等生物基因数目相差不多,但是非编码区域占比越来越高;人类基因组转录产物约98%是不编码蛋白质的RNA,表明高等生物的复杂性可能是由非编码区域决定的[10]。与microRNA相比,lncRNA的调控作用形式更加复杂,这为lncRNA调控研究带来了一定的难度[11]。但是,随着高通量测序技术的不断革新,lncRNA作为当前的研究热点,已被证实在肿瘤、感染、自身免疫、慢性代谢性疾病等多种疾病中发挥重要作用。然而,lncRNA在寄生虫感染中的作用与机制研究相对较少,且多数是原虫类,如疟原虫感染中发现lncRNA分子发挥重要调控作用[12]。我们采用高通量测序,首次在p29免疫保护细粒棘球绦虫感染中发现了30个lncRNA差异分子,随后进一步通过qRT-PCR验证获得3个lncRNA候选分子。基于lncRNA和mRNA的调控关系,其中,XLOC-012763与 Dab2ip、Hc、Trem、Oas 3基因可能相关,INTE-015204与klf4、Patz1、Cxxl2基因可能调控相关,INTE-028446与klf4、Jchain基因可能有关联[13-15]。目前我们正在展开p29免疫转录组测序工作,这将为确定差异lncRNA分子的作用靶基因提供依据。此外,由于PBMC细胞是一群异质性细胞,为了进一步寻找可能参与p29免疫保护的关键细胞,体外细胞实验包括Th0细胞、Th1细胞、Th2细胞、DC等,将有助于找出上述lncRNA分子作用的免疫细胞。
近年,越来越多的研究证实,外周血液循环中lncRNA可能成为一些疾病潜在的生物标志物[16-17]。本研究中找到的外周血PBMC差异lncRNA分子亦有可能存在于外周血浆中,故检测临床包虫病患者外周血浆中这些分子的表达情况,分析ROC曲线,将有助于评价其是否具有成为生物标志物的可能性。
综上所述,本研究发现了p29免疫小鼠细粒棘球蚴感染中lncRNA存在显著变化,证实了3个lncRNA差异分子,提示这些lncRNA差异分子可能参与了p29的疫苗保护作用,为p29疫苗的进一步的开发应用奠定了理论基础。

