miRNA-200a靶向BRD4对非小细胞肺癌上皮间质转化的影响
田晓静 周伊兰 薛宏峰
(南京中医药大学附属常州市中医医院检验科,常州 213003)
肺癌是全世界发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占总肺癌病例数的85%以上,且易转移、预后差,总体生存率低于20%[1,2]。因此深入研究NSCLC发病及转移复发的分子机理对其临床诊疗具有重要价值。MicroRNAs (miRNAs)是一种长度为21~23个核苷酸的内源性的保守非编码小RNA,既往研究显示miRNAs通过与靶mRNA 3′-UTR区的不完美配对,在转录后水平上负向调控基因的表达,从而广泛参与包括肿瘤发生发展在内的多种生理和病理过程[3]。miRNA-200a是miRNA-200家族成员之一,研究显示miRNA-200a在乳腺癌、肝癌、肾癌以及子宫内膜癌等多种肿瘤的上皮间质转化(epithelial-mesenehymal transition,EMT)、侵袭、转移中起着重要作用[4,5]。本研究旨在探讨miRNA-200a对NSCLC细胞EMT的影响及其可能的作用途径。
1 材料与方法
1.1材料
1.1.1一般资料 收集2017年1月至2018年12月于我院进行手术的NSCLC患者肺癌组织65例,同时取其癌旁组织(病理学检查确认无肿瘤细胞浸润)作为对照。纳入标准:①所有患者经病理学检查确认为NSCLC;②患者临床病理资料完整;③患者术前均未接受放疗、化疗以及其他抗肿瘤治疗;④排除合并重大脏器功能疾病、自身免疫性疾病以及严重内分泌疾病患者。其中男性48例,女性17例;年龄43~69岁,平均年龄(57.8±5.7)岁;根据WHO肺癌分类标准:鳞癌41例,腺癌24例; TNM分期:Ⅰ期16例,Ⅱ期27例,Ⅲ 期22例;淋巴结转移35例,淋巴结未转移30例。本研究经我院伦理委员会批准,患者或其家属均签署知情协议书。
1.1.2试剂和仪器 人非小细胞肺癌细胞系A549购自上海中国科学院生物化学与细胞生物学研究所。RNAprep pure动物组织总RNA提取试剂盒购自天根生化科技(北京)有限公司。RevertAidTMFirst Strand cDNA Synthesis逆转录试剂盒、Applied Biosystems TaqMan RT-PCR试剂盒、LipofectamineTM2000转染试剂、ECL化学发光液均购自美国Thermo Fisher Scientific公司。pAD-MIR-GFP-miRNA-200a或pAD-MIR-GFP-NC腺病毒表达载体购自山东维真生物科技公司。Dual-Luciferase®Reporter Assay System检测试剂盒购自美国Promega公司。BRD4、E-cadherin、Vimentin鼠单克隆抗体购自美国Santa Cruz Biotechnology公司。Transwell小室购自美国Corning公司。
1.2方法
1.2.1RT-PCR 采用动物组织总RNA提取试剂盒分离NSCLC组织和癌旁组织总RNA,采用逆转录试剂盒将总RNA反转录为cDNA。从NCBI上查询人源miRNA-200a和内参GAPDH的核苷酸序列,并设计、合成RT-PCR反应引物: miRNA-200a-F:5′-CCCCTGTGAGCATCTTACC-3′,miRNA-200a-R:5′-GCGGGTCACCTTTGAACATC-3′;GAPDH-F:5′-CCACAGTCCATGCCATCAC-3′,GAPDH-R:5′-CAGGTCAGGTCCACCACTG-3′。根据RT-PCR试剂盒说明书配置反应体系,上机,设置RT-PCR反应程序:95℃变性30 s,55℃退火30 s,72℃延伸30 s,40个循环。反应结束后采用2-ΔΔCt法分析miRNA-200a 的mRNA相对表达水平。
1.2.2稳定细胞系构建 pAD-MIR-GFP-miRNA-200a或pAD-MIR-GFP-miRNA-NC腺病毒表达载体分别用LipofectamineTM2000转染试剂转染人HEK 293T细胞,6 h后换液。48 h后荧光显微镜下观察细胞有绿色荧光出现表明转染成功。收集病毒培养上清,0.45 μm无菌滤器过滤,将病毒分别感染指数生长期的人非小细胞肺癌细胞系A549细胞,37℃、5%CO2继续培养48 h,培养基中加入1 μg/ml的嘌呤霉素筛选未成功感染的细胞,至显微镜下的细胞均发出绿色荧光时表明miRNA-200a和miRNA-NC腺病毒过表达细胞系构建成功。
1.2.3荧光素酶报告基因检测 生物信息学分析BRD4可能是miRNA-200a的一个潜在的靶基因。克隆野生型BRD4的3′-UTR区(BRD4-WT)和缺失miRNA-200a配对区域的突变体BRD4的3′-UTR区(BRD4-MUT)片段,并构建到荧光素酶报告基因载体pMIR-Report上。指数期miRNA-200a和miRNA-NC腺病毒过表达细胞消化、计数,等密度接种到12孔板中,当细胞密度达到70%时,分别转染BRD4-WT和BRD4-MUT荧光素酶报告基因载体和对照荧光质粒pRL-TK,培养48 h,采用双荧光素酶报告基因检测试剂盒检测细胞荧光素酶相对活性。
1.2.4Western blot 指数期miRNA-200a和miRNA-NC腺病毒过表达细胞消化、计数,等密度接种到6孔板中,miRNA-NC细胞接种1组,miRNA-200a细胞接种3组。构建pcDNA3.1-BRD4真核过表达载体,pcDNA3.1空载和pcDNA 3.1-BRD4过表达载体分别转染其中2组miRNA-200a细胞,其他组细胞加入等体积的转染试剂。24 h后收集细胞,RIPA裂解液冰上裂解30 min,高速离心取上清,加入5×SDS Loading buffer,煮沸10 min,SDS-PAGE电泳,转膜,封闭。分别加入BRD4(1∶300)、E-cadherin(1∶200)、Vimentin(1∶500)抗体,4℃孵育过夜。PBST洗3次,加入二抗(1∶5 000)室温孵育2 h,PBST洗 3次,涂抹ECL化学发光液,Bio-Rad凝胶仪分析miRNA-NC组、miRNA-200a组、miRNA-200a+pcDNA组和miRNA-200a+ BRD4组中各蛋白的表达水平。
1.2.5Transwell分析 miRNA-NC组、miRNA-200a组、miRNA-200a+pcDNA组和miRNA-200a+BRD4组细胞胰酶消化,PBS洗2次,用5% FBS的培养基重悬并调整密度至5×105个/ml,分别接种100 μl细胞悬液到Transwell小室中,下室添加500 μl完全培养基。24 h后PBS洗涤Transwell小室2次,甲醇固定30 min。PBS洗涤2次,0.1%结晶紫孵育20 min。PBS洗涤2次,并用棉签擦除上层未迁移细胞,显微镜下观察细胞侵袭情况。

2 结果
2.1miRNA-200a在NSCLC组织和癌旁组织中的表达 RT-PCR结果显示,癌旁组织和NSCLC组织中miRNA-200a的mRNA相对表达水平分别为1.66±0.12和0.46±0.07,miRNA-200a在NSCLC组织中的相对含量显著低于其癌旁组织,差异有统计学意义(P<0.05),见图1。
2.2miRNA-200a与BRD4靶向关系的验证 采用生物信息学在线预测网站(http://www.targetscan.org/)分析miRNA-200a可能的作用靶点,结果显示:BRD4 mRNA 3′UTR与miRNA-200a存在互补区域,可能是它的一个潜在作用靶基因,见图2A。双荧光素酶报告基因检测结果表明,在过表达BRD4-WT的细胞中,miRNA-200a组细胞的相对荧光素酶活性显著低于miRNA-NC组细胞(P<0.05);而在过表达BRD4-MUT的细胞中,miRNA-200a组和miRNA-NC组细胞的相对荧光素酶活性差异无显著统计学意义(P>0.05),见图2B。
2.3miRNA-200a过表达对BRD4、E-cadherin、Vimentin蛋白表达的影响 采用Western blot探究miRNA-200a靶向BRD4是否影响NSCLC细胞EMT标志蛋白的表达。结果显示与miRNA-NC组比较,miRNA-200a组细胞BRD4和Vimentin的蛋白表达水平显著下降,E-cadherin的蛋白表达显著增加(P<0.05);而在miRNA-200a细胞中过表达BRD4后,与miRNA-200a+pcDNA组比较,Vimentin的蛋白表达水平明显回升,E-cadherin的蛋白表达呈现下降趋势,差异有统计学意义(P<0.05),见图3。

图1 miRNA-200a mRNA相对表达水平比较Fig.1 Comparison of relative mRNA expression of miRNA-200aNote:*.P<0.05.

图2 A549细胞中miRNA-200a与BRD4靶向关系的验证Fig.2 Verification of targeting relationship between miRNA-200a and BRD4 in A549 cellsNote:*.P<0.05.

图3 miRNA-200a过表达对A549细胞EMT蛋白E-cadherin、Vimentin的影响Fig.3 Effect of miRNA-200a overexpression on EMT-related protein E-cadherin,Vimentin in A549 cells
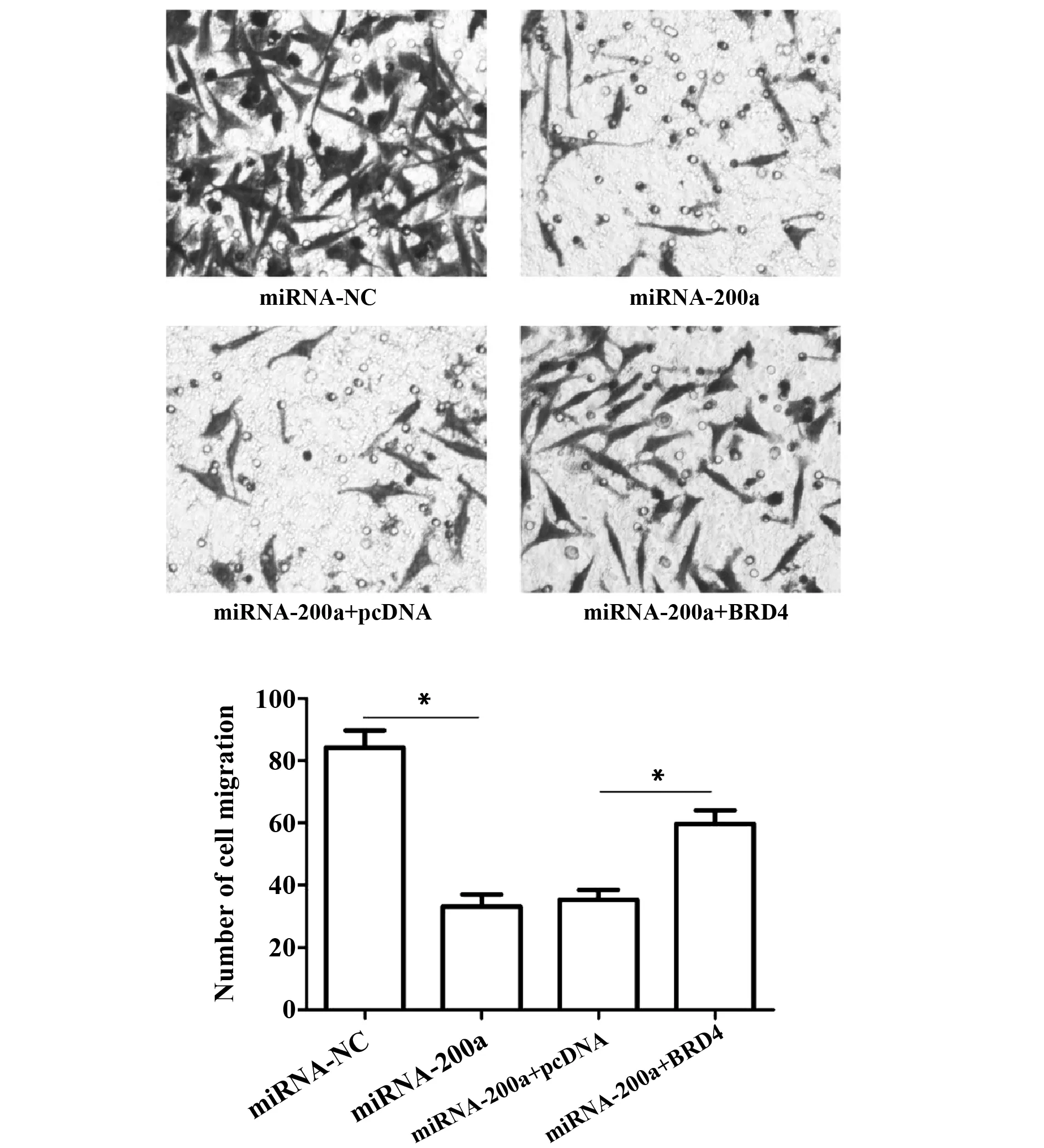
图4 miRNA-200a过表达对A549细胞侵袭的影响Fig.4 Effect of miRNA-200a overexpression on invasion of A549 cellsNote:*.P<0.05.
2.4miRNA-200a过表达对A549细胞迁移的影响 Transwell实验显示,与miRNA-NC组(83.66±9.25)个比较,miRNA-200a组(32.73±6.02)个细胞的迁移数显著下降(P<0.05);与miRNA-200a+pcDNA组(35.06±5.89)个比较,miRNA-200a+BRD4组(60.02±7.28)个细胞的迁移数显著回升,差异有统计学意义(P<0.05),见图4。
3 讨论
miRNA-200包括miRNA-141、miRNA-200a、miRNA-200b、miRNA-200c和miRNA-429五个子族,在细胞的增殖、分化、凋亡、EMT、侵袭转移的调节中起着重要作用[6,7]。大量研究显示,miRNA-200家族成员在肺癌、结肠癌、乳腺癌等众多肿瘤中异常表达,并靶向下游基因参与肿瘤侵袭和转移的调控[8]。miRNA-200a在机体恶性肿瘤中的调控作用不尽相同,如在子宫内膜癌、结肠癌、鼻咽癌中作为癌基因促进癌细胞的增殖、迁移和侵袭,并与肿瘤的分化程度密切相关[9,10];而在乳腺癌、肝癌、胰腺癌等多种癌组织中表达下调,作为抑癌基因通过靶向不同蛋白抑制肿瘤细胞的EMT、侵袭和转移[11,12]。本研究结果显示,miRNA-200a在NSCLC组织中的相对含量显著低于癌旁组织,提示miRNA-200a可能与NSCLC的发生发展存在密切关系。这一结果在TCGA数据库中得到进一步验证。
为了进一步阐明miRNA-200a通过何种途径参与NSCLC的调控,我们通过生物信息学发现溴化结构蛋白4(bromodomain containing protein 4,BRD4)是miRNA-200a的潜在作用位点。BRD4是溴结构域和超末端结构(bromodomain and extra-terminal domain,BET)蛋白家族成员之一,可通过与组蛋白中乙酰化修饰的赖氨酸特异性结合调控下游基因转录、细胞周期和分化、信号转导等各种生物学过程[13,14]。近期研究表明,BRD4在多种恶性肿瘤中高表达,并参与肿瘤的发生、侵袭和转移,已成为抗肿瘤治疗的重要研究靶点[15];此外,多项研究已证明BRD4的抑制剂对胰腺癌、乳腺癌、NSCLC、卵巢癌等多种恶性肿瘤具有良好的治疗作用[16]。本研究采用荧光素酶检测实验证实过表达BRD4-WT 3′UTR后,miRNA-200a组细胞的相对荧光素酶活性显著低于miRNA-NC组细胞,表明miRNA-200a可负向调控BRD4的表达。
EMT是肿瘤细胞发生侵袭、转移的重要途径。肿瘤上皮细胞发生EMT后转变为高迁移和侵袭能力的间质细胞,离开原发病灶后可进入机体循环系统,从而发生远处转移。大量研究证明EMT表型与众多肿瘤的组织学分级、TNM分期、分化程度和预后密切相关,已成为多种恶性肿瘤靶向治疗和预后评估的新靶标[17,18]。EMT是一种动态过程,其发生特征是上皮细胞标志物E-cadherin、ZO-1表达的下调和间质细胞标志物N-cadherin、Fibronectin和Vimentin表达的上调[19]。在我们的研究中,NSCLC细胞过表达miRNA-200a后,其靶基因BRD4和Vimentin的表达显著下降,E-cadherin的蛋白表达增加;而在miRNA-200a过表达细胞中重新诱导BRD4的表达后,Vimentin的表达水平明显回升,E-cadherin的表达显著回落。此外,通过Transwell进一步分析miRNA-200a对NSCLC细胞生物行为学的影响。结果显示,NSCLC细胞过表达miRNA-200a后,细胞侵袭能力受到显著抑制;而在miRNA-200a过表达细胞中恢复BRD4的表达后,细胞侵袭能力呈现明显回升态势。上述结果表明miRNA-200a可通过靶向下调BRD4的表达抑制NSCLC细胞EMT的发展,从而抑制NSCLC细胞的侵袭和迁移。
综上所述,miRNA-200a在NSCLC组织中的表达水平显著降低,miRNA-200a过表达可靶向下调BRD4的表达,并抑制NSCLC细胞中BRD4诱导的EMT和侵袭迁移过程,有望为NSCLC的靶向治疗开辟新的思路。

