F-FDG PET/CT显像SUVmax预测非霍奇金淋巴瘤化疗疗效的价值
赵晓佳 宿伟鹏 李肖红 秦永德
作者单位:830054 乌鲁木齐 新疆医科大学第一附属医院1核医学科,2肿瘤一科
淋巴瘤是原发于淋巴组织或淋巴结的恶性肿瘤,依据免疫、病理和基因分型主要分为霍奇金淋巴瘤(Hodgkin′s lymphoma,HL) 和非霍奇金淋巴瘤(non-Hodgkin′s lymphoma,NHL)。其中 NHL 是一组恶性血液系统疾病,病理类型多样且起源部位不同,原发部位是淋巴的网状组织,淋巴结的发生率高于结外淋巴组织[1]。目前NHL诊断主要依靠病理学及影像学检查[2]。其中18F-FDG PET/CT显像常用于恶性淋巴瘤的疗效评价,在判断疗效中发挥重要作用,对淋巴瘤临床分期亦有指导意义[3]。PET/CT显像病灶代谢参数包括最大标准化摄取值(maximum standard uptake value,SUVmax)、代谢体积(metabolic tumor volume,MTV)和病灶糖酵解总量(total lesion gigcolysis,TLG)等[4]。其中SUVmax值是评价FDG摄取强度的一种半定量指标,具有良好的一致性和可重复性,能提供准确的客观依据[5-6]。但治疗前18F-FDG PET/CT显像的SUVmax值对NHL患者疗效的预测价值尚未知。本研究检测NHL患者治疗前的SUVmax值,并探讨其对NHL患者疗效的预测价值,以期为NHL疗效预测提供可靠的新指标。
1 资料与方法
1.1 研究对象
回顾性分析2017年7月至2019年3月在新疆医科大学第一附属医院行18F-FDG PET/CT显像,并经淋巴结活检初次确诊为NHL的146例患者的临床资料。纳入标准:⑴淋巴结活检及影像检查确诊且符合 NHL 的世界卫生组织(WHO)分类[7];⑵临床病理资料完整;⑶随访期间未发生其他恶性肿瘤;⑷治疗前未行放化疗者。排除标准:⑴治疗前18F-FDG PET/CT显像检查有肺内结节(≥2 cm)18F-FDG的摄取程度≤纵隔血池、化疗后骨髓出现弥漫性18F-FDG摄取、中等或较大肿块(≥2 cm)者;⑵伴感染性疾病者。共146例患者符合标准纳入研究,年龄19~81岁,平均(49.43±30.72)岁;其中男性87例。所有患者均由2名主治及以上职称医师明确诊断,且经新疆医科大学第一附属医院临床研究伦理委员会批准,患者自愿参加,并签署知情同意书。
1.2 18F-FDG PET/CT显像及分析
18F-FDG为新疆医科大学第一附属医院核医学科PET中心制备(放射性化学纯度>95%),显像仪器为美国GE discovers VCT64 PET/CT。检查前患者禁食水至少6 h,空腹血糖需维持在6.1 mmol/L以下,按体重5.55 MBq/kg由肘静脉注射18F-FDG,50 min后排尿行PET/CT常规扫描(从股骨中段至颅顶),采集6~8个床位,必要时加至双下肢或足底,螺旋CT扫描层厚3.75 mm,PET显像为3D采集,每床位采集3~4 min。由2位高年资核医学科诊断医师分析图像,选取全身最大淋巴结中最浓聚区,并放置适当的感兴趣区(ROI),同时避开坏死区域、邻近血管及病灶边缘区域,测量SUVmax。
1.3 治疗方法及疗效评价
所有患者均接受利妥昔单抗联合CHOP(RCHOP)方案[8]:每一疗程第 1天,静脉滴注利妥昔单抗375 mg/m2,滴速先慢后快且最大速度为400mg/h,第1天或第2天静脉滴注环磷酰胺750 mg/m2,第1天或第2天静脉推注长春新碱1.4 mg/m2,且最多2 mg,第1天或第2天静脉滴注多柔比星50 mg/m2,第1~5天或第2~6天口服泼尼松60 mg/m2,治疗过程中密切监测生命体征,若出现异常应及时处理,每3周为1个疗程,共接受系统规范的6个疗程化疗。
化疗结束后以国际工作组织淋巴瘤疗效评估标准(IWC)为依据[9],经全身影像学检查后评估疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。其中CR为病灶证据完全消失,至少持续4周;PR为病灶缩小>50%,至少持续4周;SD为病灶缩小<50%,或病灶增大<25%,至少持续4周;PD为1或多个病灶增大>25%,或有新的病灶出现。将化疗后获CR、PR、SD NHL患者分为有效组(95例),PD患者为无效组(51例)。
1.4 统计学方法
采用SPSS 23.0软件进行数据分析。计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验;采用受试者工作特征曲线(receiver operator characteristic curve,ROC) 分析治疗前 SUVmax对NHL患者疗效的评估价值;Logistic回归分析影响NHL患者疗效的因素。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效
6个疗程化疗结束后,根据IWC评估患者疗效,其中获CR 20例,PR 23例,SD患者52例,PD 51例。
2.2 SUVmax与临床病理特征的关系
将146例NHL患者分别根据年龄大小、临床分期等分类后,分析SUVmax在不同临床病理特征中的差异,结果显示,不同年龄段、性别及B症状患者的SUVmax比较,差异均无统计学意义(P>0.05)。不同临床分期、恶性程度、病灶大小、坏死情况、骨髓浸润、治疗前血清乳酸脱氢酶(PsLDH)、Ki-67阳性率患者的SUVmax比较,差异均有统计学意义(P<0.05)。见表1。
2.3 不同疗效组治疗前SUVmax的比较
6个化疗疗程后,无效组治疗前SUVmax为16.68±6.16,高于有效组的 12.16±5.27,差异有统计学意义(t=4.654,P=0.001)。
2.4 治疗前SUVmax对NHL患者疗效的评估价值
以治疗前SUVmax为检验变量绘制ROC曲线,结果显示,治疗前SUVmax评估NHL患者疗效的最佳截断值为 14.836,对应的 AUC为 0.835(95%CI:0.751~0.920,P<0.001)、特异度为 80.0%,敏感度为77.4%。见图1。
表1 不同临床病理特征中SUVmax的比较(±s)Tab.1 Comparison of SUVmax in different clinicopathological characteristics(±s)

表1 不同临床病理特征中SUVmax的比较(±s)Tab.1 Comparison of SUVmax in different clinicopathological characteristics(±s)
Characteristic n SUVmax t P Gender 1.9340.055 Male Female 87 59 13.42±6.51 15.57±6.71 Age(year)1.5570.122≤60 61 13.82±5.62>60 85 15.38±6.21 Clinical stage 2.419 0.017Ⅰ/Ⅱ 87 13.64±5.81Ⅲ/Ⅳ 59 16.17±6.74 Malignant degree 4.217 <0.001 Inertness 62 12.74±5.32 Aggressiveness 84 16.87±6.21 Focus size(cm) 5.182 <0.001>2 78 16.82±6.23≤2 68 11.87±5.16 Necrosis 3.006 0.003 Yes 32 16.43±6.42 No 114 11.36±4.98 B symptoms 1.789 0.076 Yes 80 15.49±6.38 No 66 13.72±5.38 Bone marrow infiltration 3.333 0.001 Yes 51 16.13±6.41 No 95 12.84±5.26 PsLDH 5.550 <0.001≤238.5 63 11.64±5.94>238.5 83 16.73±5.12 Ki-67 positive rate(%) 2.765 0.006>25 89 15.94±6.13≤25 57 13.28±5.46

图1 治疗前SUVmax对NHL患者疗效的评估价值Fig.1 The evaluation of SUVmax before treatment for the prognosis of NHL patients
2.5 影响NHL患者疗效的Logistic回归分析
单因素Logistic回归显示,骨髓浸润、PsLDH>238.5、Ki-67阳性率>25%和治疗前 SUVmax>14.836与NHL患者疗效有关(P<0.05),见表2。多因素Logistic回归显示,治疗前 SUVmax>14.836、PsLDH>238.5、Ki-67阳性率>25%是影响NHL患者疗效的独立危险因素(P<0.05),见表3。
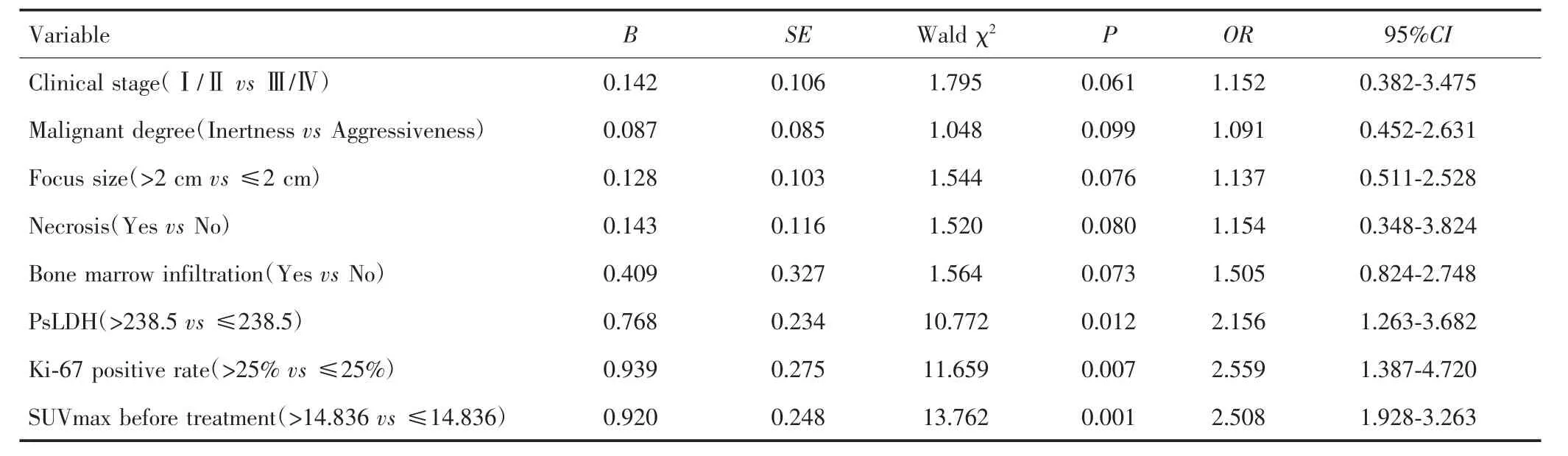
表2 影响NHL患者疗效的单因素Logistic回归分析Tab.2 Univariable logistic regression analysis on the effect of NHL patients
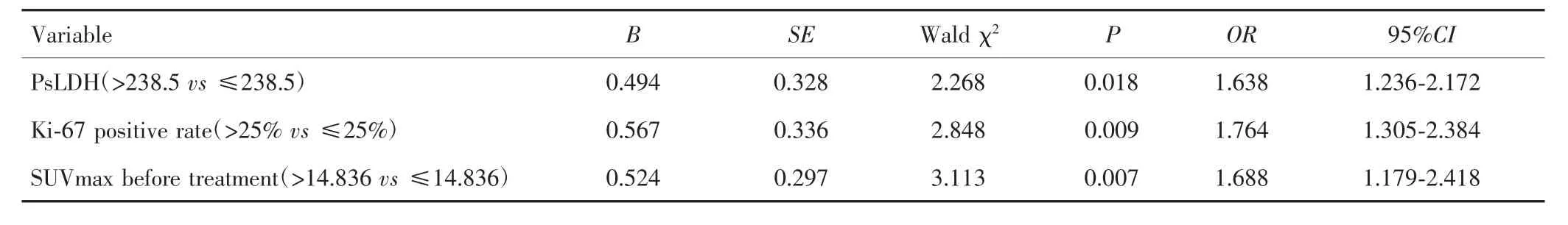
表3 影响NHL患者疗效的多因素Logistic回归分析Tab.3 Multivariable logistic regression analysis on the effect of NHL patients
3 讨论
国际预后指数、肿瘤标志物等是NHL常用的预测因子,但较少应用于临床常规检查,且无法准确预测预后[10]。18F-FDG PET/CT是一种无创性检查手段,已发现在淋巴瘤分期、疗效监测和预后评价方面具有重要价值。SUVmax是衡量肿瘤组织18F-FDG摄取程度最常用的半定量指标,可区分惰性和侵袭性淋巴瘤,预测弥漫大B细胞淋巴瘤的早期疗效[11]。本研究将18F-FDG PET/CT显像病灶代谢参数SUVmax应用于预测NHL疗效,结果发现18F-FDG PET/CT显像测量的SUVmax与临床分期、恶性程度、病灶大小等临床病理特征均有密切联系,且对疗效具有较好的评估价值,可为临床预测淋巴瘤疗效提供新的评价指标。
与传统影像学检查相比,PET/CT是一种功能学和解剖学相融合的显像技术。18F-FDG是目前临床上最常用的糖代谢显像剂,主要依靠正常组织细胞葡萄糖代谢水平显著低于肿瘤组织细胞,进而造成18F-FDG大量积聚于肿瘤细胞内,经PET/CT显像后,能清晰显示肿瘤的大小、位置、形态及放射性分布[12]。PET-CT显像病灶代谢参数SUVmax可直接反映细胞内葡萄糖代谢水平的高低,从而间接反映肿瘤细胞的增殖状况[13]。研究发现NHL患者的临床分期、恶性程度、病灶大小、坏死情况等与SUVmax均存在一定的相关性[14]。本研究结果亦显示,NHL患者临床分期越晚、恶性程度越高、病灶越大、有坏死情况等SUVmax较大,与上述文献报道的结果基本一致,提示SUVmax与NHL进展有关。分析原因可能为肿瘤的恶性程度增加、临床分期越晚,代谢随之旺盛,同时肿瘤供血更丰富,肿瘤组织摄取葡萄糖能力增强,从而致使SUVmax增大[13,15]。进一步分析发现化疗无效组患者的SUVmax高于有效组,提示SUVmax或可用于评估NHL患者的化疗疗效。
研究表明,治疗前18F-FDG PET/CT显像参数SUVmax对预测淋巴瘤预后具有较高的应用价值[14]。张亚飞等[16]报道治疗前18F-FDG PET/CT显像参数SUVmax可作为预测鼻型NK/T细胞淋巴瘤患者疗效的指标。本研究ROC曲线分析结果显示,治疗前SUVmax评估NHL患者疗效的 AUC为 0.835,最佳临界值为14.836,且具有较高的敏感度和特异性,进一步的多因素Logistic回归显示,SUVmax>14.836是影响NHL患者疗效的独立危险因素。以上结果证实治疗前SUVmax对NHL患者疗效具有较高的评估价值,且SUVmax>14.836时,其评估价值可能更高。
综上所述,治疗前18F-FDG PET/CT显像SUVmax可评估NHL患者的化疗疗效,检测治疗前18F-FDGPET/CT显像的SUVmax有助于预测NHL患者疗效。但本研究为回顾性研究,样本数量较少,且缺乏长期的生存随访数据,SUVmax与NHL预后的关系仍需进一步研究。

