系统免疫炎症指数与接受新辅助化疗胰腺导管腺癌患者预后的关系
赵 阳 程 静
作者单位:124010 盘锦 盘锦辽油宝石花医院1普通外科,2检验科
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是一种恶性程度极高、预后极差的恶性肿瘤,5年总生存率不足10%[1]。根治性切除是其首选的治疗手段,但因大多患者诊断时已处于肿瘤晚期[2-3],仅15%的PDAC患者可获得根治性切除机会[3-4]。研究发现无法手术的PDAC患者新辅助治疗可能获益[5-6]。因此筛选新辅助化疗获益者对提高患者预后尤为关键。然而目前临床中尚缺乏评估新辅助治疗效果的可靠标志物。CA19-9是最常用的胰腺癌诊疗标志物,但评估新辅助化疗效果不佳[7-8],CT或MRI等影像学检查也不理想[5,9]。研究报道炎症介质在PDAC肿瘤微环境中发挥重要作用,可促进细胞生长和播散,支持免疫调节适应性免疫反应,从而降低化疗药物疗效[10]。系统免疫炎症指数(systemic immuneinflammation index,SII)是通过淋巴细胞、中性粒细胞和血小板计数计算获得的综合炎症指标。多项研究发现SII是可手术切除PDAC患者无病生存的独立预测因子[11-12]。但SII评估新辅助化疗疗效及其预后的价值尚不明确。本研究检测PDAC患者接受新辅助化疗后的SII,并分析其评估预后的价值。
1 资料与方法
1.1 研究对象
本研究回顾性分析2013年1月至2016年12月在盘锦辽油宝石花医院普通外科收治的234例诊断为PDAC患者临床资料,其中接受新辅助化疗并行胰腺癌根治性切除术119例,将完成手术且具有完整随访资料的95例患者纳入本研究。纳入标准:⑴经术后病理学检查确诊为PDAC者;⑵术前影像学检查明确无远处转移者;⑶具有完整的临床病理资料。排除标准:⑴术前合并其他肿瘤,或伴严重基础疾病,不能耐受手术者;⑵术后病理学检查切缘阳性者;⑶术前存在远处转移或术中发现存在腹膜转移者。患者或患者家属知晓全部诊疗计划,并签署知情同意书。
1.2 治疗方法
新辅助化疗采用吉西他滨+替吉奥方案(GS方案),剂量基于早前研究结果[13],静脉输注吉西他滨1 000 mg/m2,d1,8;替吉奥口服,每日 2 次,体表面积≤1.5 m2者 40 mg/次;体表面积>1.5 m2者,60 mg/次,连续14 d,停药7 d,每21 d为1个疗程;共2个疗程。所有患者根据肿瘤位置,由同一组医师行胰十二指肠切除术或胰远端切除术伴区域淋巴结清扫。
1.3 资料收集和随访
收集患者的一般资料、实验室检查结果及随访资料(表1)。新辅助化疗后的第21天计算SII,计算公式:SII=血小板计数×(中性粒细胞计数/淋巴细胞计数),采用受试者工作特征曲线(ROC曲线)确定新辅助化疗后SII的最佳临界值。
通过门诊和入院方式完成患者术后随访,以完成手术治疗为随访起点,于2019年12月31日随访终止。所有患者术后每3个月复查血常规、肝肾功能、肿瘤标志物,并行胸部和腹部CT扫描,若病情需要,可将检查日期提前或增加磁共振成像,监测患者术后复发、并发症发生情况及生存时间。术后并发症定义为手术后30 d内发生的并发症,根据Clavien-Dindo分级系统[14]进行胰腺癌术后并发症的分级,具体分为Ⅰ~Ⅴ级,其中Ⅲ级及以上并发症患者纳入并发症组。总生存期定义为手术日至死亡或随访结束的时间。
1.4 统计学方法
采用SPSS 18.0软件进行数据分析。计数资料用n(%)表示,组间比较采用χ2检验。绘制ROC曲线,并根据约登指数的最大值确定SII的最佳临界值。采用Kaplan-Meier法计算3年生存率,组间生存率比较用Log-rank检验,采用Cox回归模型分析SII与PDAC患者的术后生存的关系,将单因素Cox回归分析有统计学意义的纳入多因素Cox回归模型,并计算风险比(HR)及其对应的95%可信区间(CI)。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 SII最佳临界值的确定
新辅助化疗后计数获得SII值中位数为398(范围:285~942),依据ROC曲线确定新辅助化疗后SII的最佳临界值为885,对应的ROC曲线下面积(AUC)为 0.696,约登指数为0.46,根据最佳临界值将患者分为 SII≤885组(n=58)和 SII>885组(n=37)。见图1。
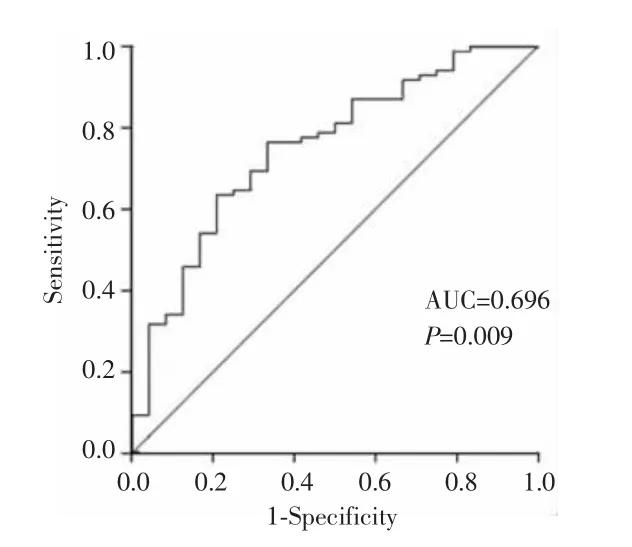
图1 ROC曲线确定SII的最佳临界值Fig.1 The ROC curve determined the optimal cutoff value of SII
2.2 新辅助化疗后SII与PDAC患者临床病理特征的关系
新辅助化疗后SII与术中肿瘤大小、术前胆道引流、术前CA19-9水平有关(P<0.05),但未发现与其他临床病理特征有关(P>0.05),见表 1。
2.3 新辅助化疗后SII与PDAC患者术后生存的关系
95例PDAC患者中,71例(74.7%)患者术后继续给予GS方案化疗,19例(18.9%)因无法耐受联合化疗毒副反应选择单药替吉奥,5例未进行化疗。随访期间,死亡63例,存活32例,无失访病例。随访时间最短为7个月,中位随访时间为16.0个月。所有患者术后中位生存期为14.2个月,其中SII>885组和SII≤885组患者的中位生存期分别为12.6个月、16.5个月,3年生存率分别为18.9%和43.1%(P=0.015),见图2。
2.4 影响PDAC患者术后生存的单因素和多因素分析
单因素分析结果表明,术中肿瘤大小、胆道引流、新辅助化疗后CA19-9水平、TNM分期、术后并发症和新辅助化疗后SII与PDAC患者术后生存相关(P<0.05)。多因素分析表明,术中肿瘤大小>3 cm(HR=1.367,95%CI:1.227~2.215)、CA19-9 >37 IU/mL(HR=1.292,95%CI:1.132~1.931)及 SII>885(HR=1.451,95%CI:1.327~2.431)是影响PDAC患者术后生存的独立危险因素。见表3。
3 讨论
PDAC患者行新辅助化疗可能获益,但目前尚无有效的生物学标志物评估此类患者的治疗效果。SII是依靠外周血中淋巴细胞计数、中性粒细胞计数和血小板计数计算获得的综合炎症指标,能全面地反映宿主免疫及炎症情况,更好地评估患者预后[15],有望成为潜在的首选炎症标志物。郭静等[15]通过ROC曲线计算SII最佳截点值并分析其与晚期非小细胞肺癌预后的关系,发现SII≥767.24×109是晚期非小细胞肺癌患者总生存期的独立危险因素,可作为预后评估指标。此外,CHEN等[16]发现SII与结直肠癌的肿瘤大小、分化程度、TNM分期等因素有关。另有研究[17-18]发现SII与胃癌和膀胱癌的肿瘤位置有关。本研究检测PDAC患者行新辅助化疗后的SII,采用ROC曲线确定SII最佳临界值并分为SII>885组和SII≤885组,观察两组患者与临床病理特征的关系,发现SII与肿瘤大小、CA19-9和胆道引流有关,对可能影响术后生存的因素进行分析,也发现肿瘤大小>3 cm、CA19-9>37I U/mL及SII>885的患者预后较差,是影响术后生存的独立危险因素,且低SII组的患者中位生存时间将延长大约4个月,说明SII可作为评估新辅助化疗PDAC患者术后预后的指标,有助于此类患者制定后续治疗决策。
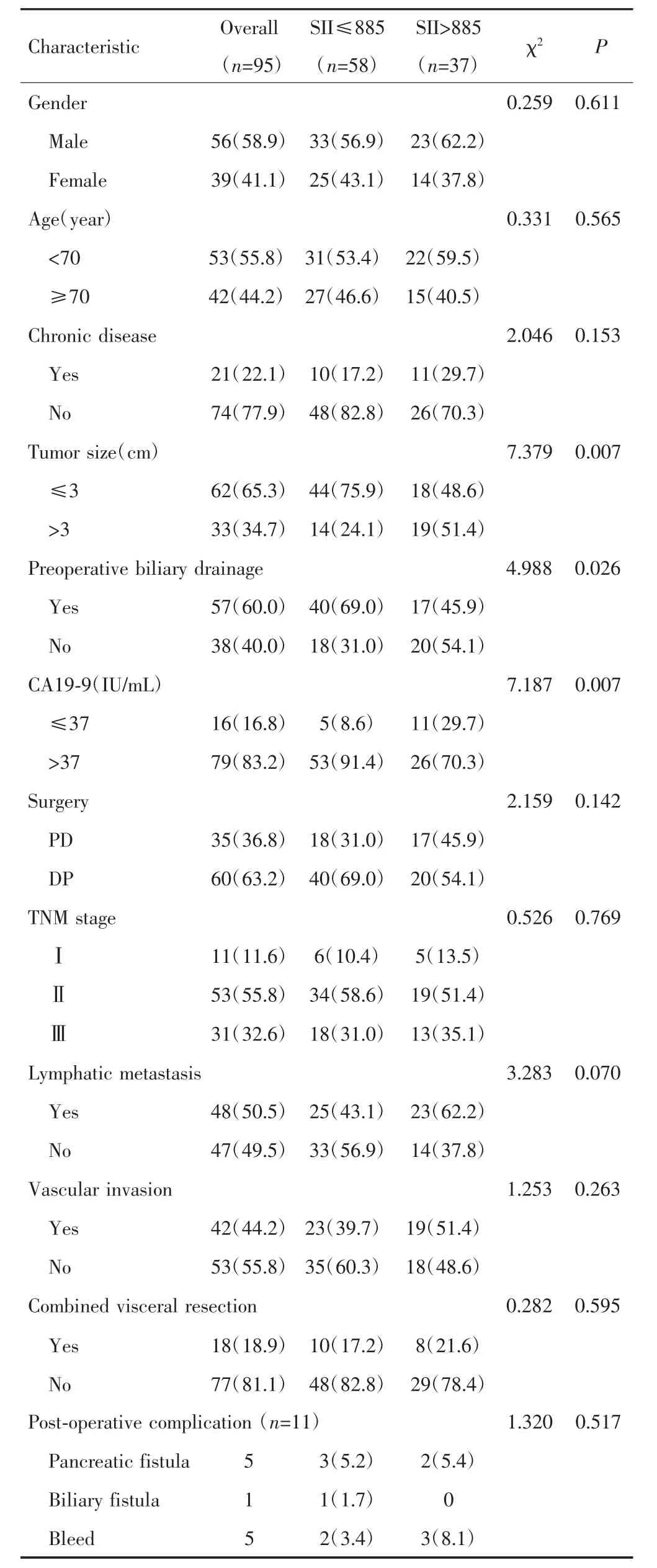
表1 新辅助化疗后SII与PDAC患者临床病理特征的关系[n(%)]Tab.1 The relationship between SII and clinicopathological factors of PDAC patients after neoadjuvant chemotherapy[n(%)]
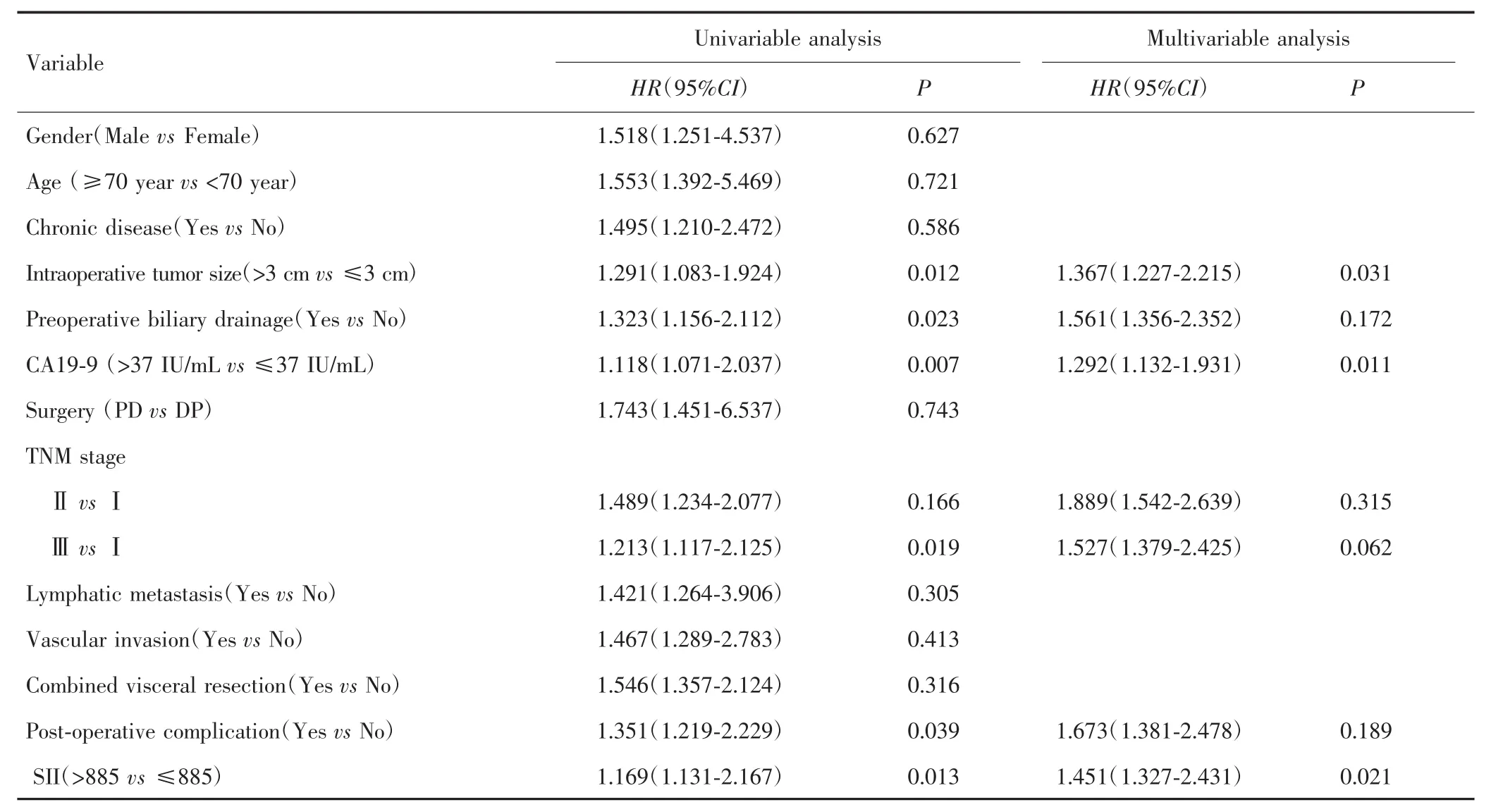
表3 影响新辅助化疗后PDAC患者术后生存的单因素分析和多因素分析Tab.3 Univariable and multivariable analysis on influence factors of postoperative survival of PDAC patients after neoadjuvant chemotherapy
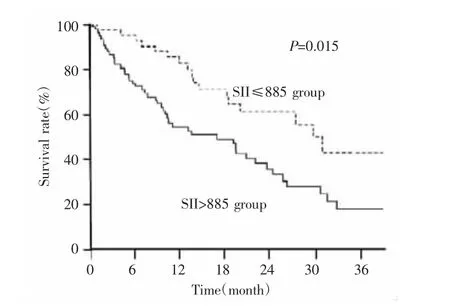
图2 不同SII组PDAC患者术后生存曲线比较Fig.2 Comparison of postoperative survival curves of PDAC patients in different SII groups
分析SII影响PDAC预后的原因可能有以下几个方面:⑴患者总体预后取决于PDAC的肿瘤生物学行为,慢性炎症与PDAC的发生发展密切相关,它能促进细胞增殖,增强肿瘤细胞侵袭、迁移和转移,而慢性胰腺炎可导致胰腺上皮细胞恶变,是已知的PDAC危险因素[19]。⑵近期发表的数据显示[20],中性粒细胞和血小板增多具有促进肿瘤细胞增殖作用,而癌症相关的血小板增多是通过抑制T细胞对肿瘤的反应而抑制宿主免疫;相反,淋巴细胞减少提示免疫监测系统无效,而免疫监测系统可能为循环肿瘤细胞的扩散提供良好的微环境[21]。⑶血小板增多一方面可促进肿瘤细胞与微血管内皮的黏附,另一方面可以在循环中的肿瘤细胞周围形成防御屏障,使肿瘤细胞逃脱宿主的免疫监视,这也可能是PDAC患者术后短期出现复发的原因之一[21-22]。需要特别指出的是,尽管术前胆道引流将有助于SII下降,但在多因素分析中发现胆道引流并不能改善PDAC患者远期预后,这与既往文献报道一致[23]。笔者认为是由于胆红素浓度升高导致患者的营养状况较差,即便在胆道引流后亦是如此[24]。
综上所述,本研究提示新辅助化疗后SII>885是PDAC术后生存的独立危险因素,SII有望作为评估预后指标。考虑化疗可能抑制血细胞计数,故本研究将新辅助化疗结束3周后的数值作为评估参考值,以减少由此带来的误差;但纳入分析的患者均接受手术治疗,SII对化疗但未接受手术患者的影响尚不清楚且未排除SII在术后不同化疗方案甚至化疗缺失中对预后的影响,今后仍需在整体方案变化不大的队列中进一步分析SII与预后之间的关系。

